名校
解题方法
1 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
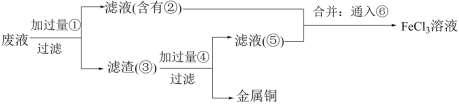
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
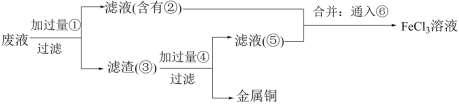
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
406次组卷
|
2卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
2 . 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________ ;该反应中氧化剂是_____ ;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______ 。(用NA表示)
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性: 维生素C > Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________ 。
| 药品 | NaNO2 (亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性: 维生素C > Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
您最近一年使用:0次
2018-01-31更新
|
532次组卷
|
6卷引用:【全国校级联考】辽宁省六校协作体2018-2019学年高二上学期期初考试化学试题
3 . 某班同学用如下实验探究Fe2+、Fe3+和FeO42-的性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是________ ;将FeCl3晶体溶于浓盐酸,再稀释到需要的浓度,盐酸的作用是________ 。
(2)制备K2FeO4(夹持装置略)后,取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
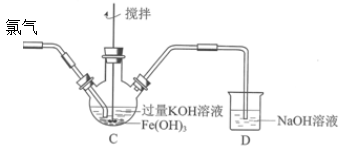
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________ 产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________ 。根据K2FeO4的制备原理3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O得出:氧化性Cl2______ FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是
(2)制备K2FeO4(夹持装置略)后,取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |

Ⅰ.由方案Ⅰ中溶液变红可知a中含有
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
您最近一年使用:0次
名校
解题方法
4 . 高铁酸钾(K2FeO4)是一种优良的杀菌消毒剂和净水剂,实验小组制备高铁酸钾并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液,在碱性条件下较稳定;具有强氧化性,易发生还原反应生成Fe(OH)3胶体;在Fe3和Fe(OH)3催化作用下发生分解。
回答下列问题:
Ⅰ.制备KClO,装置如图。_____ ;A中反应的化学方程式为_____ 。
(2)装置B盛放的试剂为_____ ,若省略该装置造成的后果为_____ 。
(3)Cl2和KOH的反应为放热反应,随着反应的进行,溶液中局部温度过高时会生成KClO3.为避免KClO3生成,实验中可采取的措施有_____ (任答两点)。
Ⅱ.制备K2FeO4。
(4)将反应后C中所得溶液与Fe(NO3)3饱和溶液混合可得到紫色固体和溶液,其混合方式为_____ (填选项字母),原因为_____ 。
a.在搅拌下,将C中溶液缓慢滴加到Fe(NO3)3溶液
b.在搅拌下,将Fe(NO3)2溶液缓慢滴加到C中溶液
(5)得到紫色固体的离子方程式为_____ 。
Ⅲ.探究K2FeO4的性质。
(6)向含有细菌和少量忌浮物的废水中加入少量K2FeO4溶液一段时间后,测得废水中细菌基本被除尽,且水变澄清。最终水变澄清的原因为_____ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液,在碱性条件下较稳定;具有强氧化性,易发生还原反应生成Fe(OH)3胶体;在Fe3和Fe(OH)3催化作用下发生分解。
回答下列问题:
Ⅰ.制备KClO,装置如图。
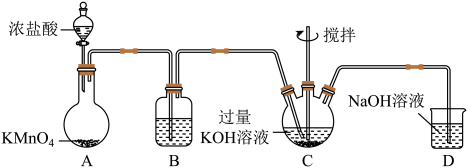
(2)装置B盛放的试剂为
(3)Cl2和KOH的反应为放热反应,随着反应的进行,溶液中局部温度过高时会生成KClO3.为避免KClO3生成,实验中可采取的措施有
Ⅱ.制备K2FeO4。
(4)将反应后C中所得溶液与Fe(NO3)3饱和溶液混合可得到紫色固体和溶液,其混合方式为
a.在搅拌下,将C中溶液缓慢滴加到Fe(NO3)3溶液
b.在搅拌下,将Fe(NO3)2溶液缓慢滴加到C中溶液
(5)得到紫色固体的离子方程式为
Ⅲ.探究K2FeO4的性质。
(6)向含有细菌和少量忌浮物的废水中加入少量K2FeO4溶液一段时间后,测得废水中细菌基本被除尽,且水变澄清。最终水变澄清的原因为
您最近一年使用:0次
解题方法
5 . 某小组研究Cu2+和Fe3+的氧化性,进行如下实验。
实验Ⅰ: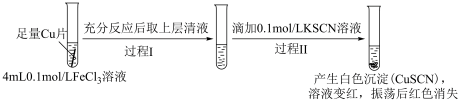
已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是___________ 。
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:___________ 。
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ: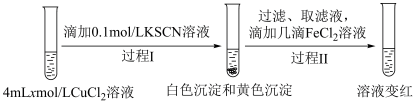
i.
___________ 。
ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为___________ 。
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:
①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若___________ (写出实验现象),
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在答题卡方框中用文字或图示 设计实验方案,并描述相关的实验现象:___________ 。
实验Ⅰ:

已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ:

i.

ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:

①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在
您最近一年使用:0次
名校
解题方法
6 . 某小组在验证H2O2氧化Fe2+时发现异常现象,并对其进行深入探究。
实验I:
(1)实验I中溶液变红是因为Fe3+与SCN-发生了反应,其离子方程式是__ 。
(2)探究实验I中红色褪去的原因:取反应后溶液,___ (填实验操作和现象),证明溶液中有Fe3+,而几乎无SCN-。
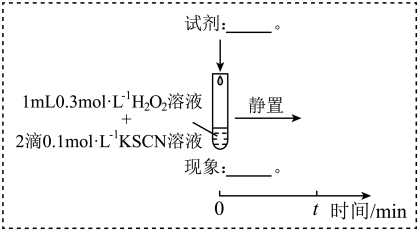
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:__ 。
实验II:
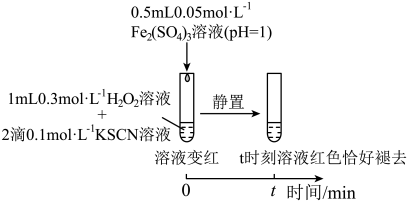
实验III:
(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,___ 。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:____ 。
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有___ 。
实验I:
| 装置与操作 | 现象 |
 | 溶液立即变红,继续滴加H2O2溶液,红色变浅并逐渐褪去 |
(2)探究实验I中红色褪去的原因:取反应后溶液,
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:
实验II:

实验III:

(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有
您最近一年使用:0次
2021-08-13更新
|
631次组卷
|
7卷引用:北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题
名校
7 . 某实验小组金属的电化学腐蚀实验探究
已知:铁氰化钾是一种无机物,化学式K3[Fe(CN)6],俗称赤血盐、赤血盐钾,为红色晶体,可溶于水,水溶液带有黄绿色荧光,含有铁氰根配离子[Fe(CN)6]3- 。可以和各种盐类反应,对金属盐可能产生沉淀,其试验列表(铁氰化钾为0.1mol·L-1)如下表:
(1)完成下列问题。
①请解释铜丝区域溶液变红的原因是___________ (电极反应式及文字说明)。
②写出生成蓝色沉淀{ Fe3[Fe(CN)6]2 }的离子方程式___________ 。
(2)完成下列问题。
根据实验二的现象,推测K3[Fe(CN)6]可能具有___________ “填氧化性或还原性”。
(3)依据实验二的现象,甲同学认为实验一不一定能说明Fe发生了电化学腐蚀,设计如下实验证明其结论。
根据实验现象推出实验三的结论是:在NaCl溶液中情况下,___________ 。
(4)结合实验一~实验三,乙同学设计如下装置进行实验四,证明金属可以发生电化学腐蚀,当电极X为Fe时,实验四的两个实验方案均可以证明Fe发生电化学腐蚀
①补全实验方案2中的空格部分
②思考:若电极X为Mg时,电流表读数为1.5I,推测电极X为Zn时电流表读数的范围是___________ 。
已知:铁氰化钾是一种无机物,化学式K3[Fe(CN)6],俗称赤血盐、赤血盐钾,为红色晶体,可溶于水,水溶液带有黄绿色荧光,含有铁氰根配离子[Fe(CN)6]3- 。可以和各种盐类反应,对金属盐可能产生沉淀,其试验列表(铁氰化钾为0.1mol·L-1)如下表:
| 加入试剂 | 现象 |
| FeCl3 | 绿褐色沉淀 |
| MgCl2 | 无明显现象 |
| 现配的FeCl2 | 产生深蓝色沉淀 |
| CuSO4 | 深土黄色沉淀 |
(1)完成下列问题。
| 实验序号 | 实验装置 | 实验方案 | 实验现象 |
| 实验一 | 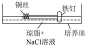 | 1.将0.5g琼脂加入250mL烧杯中,再加入25mL饱和食盐水和75mL水。搅拌、加热煮沸,使琼脂溶解,转入培养皿中。滴入5~6滴酚酞溶液和0.1mol·L-1K3[Fe(CN)6]溶液 | |
| 2.将一个铁钉用砂纸打磨光滑,一端缠有铜丝,放入培养皿中一段时间。 | 铜丝的区域溶液变红色;铁钉区域出现蓝色沉淀 |
②写出生成蓝色沉淀{ Fe3[Fe(CN)6]2 }的离子方程式
(2)完成下列问题。
| 实验序号 | 实验方案 | 实验现象 |
| 实验二 | 取2mL饱和KI溶液于试管中,滴加几滴淀粉,振荡。继续滴加5~6滴0.1mol·L-1K3[Fe(CN)6]溶液,振荡。 | 滴入0.1mol·L-1K3[Fe(CN)6]溶液后,溶液变蓝色。 |
(3)依据实验二的现象,甲同学认为实验一不一定能说明Fe发生了电化学腐蚀,设计如下实验证明其结论。
| 实验序号 | 实验装置 | 实验方案 | 实验现象 |
| 实验三 | 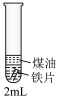 | 1.取2mL煮沸过的0.1mol·L-1K3[Fe(CN)6]溶液于试管中,向试管中加入一小段铁片,再加入1mL煤油液封。 | 溶液无明显变化 |
| 2.继续向试管中加入少许NaCl固体。 | 一段时间后,铁片表面产生大量的蓝色沉淀 |
(4)结合实验一~实验三,乙同学设计如下装置进行实验四,证明金属可以发生电化学腐蚀,当电极X为Fe时,实验四的两个实验方案均可以证明Fe发生电化学腐蚀
①补全实验方案2中的空格部分
| 实验序号 | 实验装置 | 实验方案 | 实验现象 |
| 实验四 |  | 1.按图连接好装置,准确读取电流表读数。 | 电流表指针偏转,读数为I |
| 2.取少量烧杯中溶液于试管中,加入 | 产生蓝色沉淀。 |
您最近一年使用:0次
名校
8 . 某小组同学对FeCl3与KI的反应进行探究。
【初步探究】室温下进行下表所列实验。
(1)证明实验Ⅰ中有I2生成,加入的试剂为_______ 。
(2)实验Ⅱ可以证明Fe3+与I-发生可逆反应,其操作为_______ 。
(3)写出实验Ⅰ反应的离子方程式:_______ 。
(4)实验Ⅰ中溶液的颜色不变后再进行后续实验,其目的是_______ 。
【深入探究】20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:_______ ,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素 可能是_______ (写出1条即可)。
(6)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I-+I2 I
I ,I
,I 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:_______ 。
【初步探究】室温下进行下表所列实验。
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 取5 mL0.1 mol·L-1KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
| 实验Ⅱ | _______ | 溶液变红 |
(2)实验Ⅱ可以证明Fe3+与I-发生可逆反应,其操作为
(3)写出实验Ⅰ反应的离子方程式:
(4)实验Ⅰ中溶液的颜色不变后再进行后续实验,其目的是
【深入探究】20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:
(6)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I-+I2
 I
I ,I
,I 呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
您最近一年使用:0次
2022-10-22更新
|
212次组卷
|
3卷引用:北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题
解题方法
9 . 菠菜是常见食品,可以补充入体所必需的微量元素铁。某兴趣小组设计实验,探究菠菜中铁元素的价态和含量,实验流程如下:
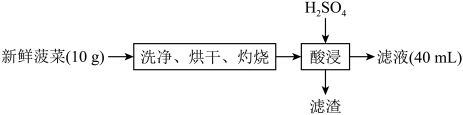
回答下列问题:
(1)灼烧过程中必须用到下列仪器中的___________(填标号)。
(2)灼烧的灰烬中含有铁的氧化物,硫酸酸浸的目的是___________ 。
(3)取少许滤液于试管中,滴入几滴KSCN溶液,显红色,说明滤液中含有_______ ;另取滤液检验,滤液能使 溶液紫色褪去,说明滤液中存在具有
溶液紫色褪去,说明滤液中存在具有_____ (填“氧化性”或“还原性”)的粒子。
(4)为进一步探究 和
和 的氧化性和还原性,该兴趣小组设计并进行如下实验,记录现象,完成实验报告。
的氧化性和还原性,该兴趣小组设计并进行如下实验,记录现象,完成实验报告。
(5)分光光度法测量铁元素含量的流程示意如下:

①用离子方程式解释加入且 的目的是
的目的是___________ 。
②溶液颜色越深,光的透过能力越差,即透光率越小。若不加 ,测出菠菜中铁元素的含量
,测出菠菜中铁元素的含量___________ (填“偏大”或“偏小”)。
③测得10mL滤液中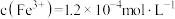 ,该菠菜中铁元素的含量为
,该菠菜中铁元素的含量为________ mg/100g。

回答下列问题:
(1)灼烧过程中必须用到下列仪器中的___________(填标号)。
A. | B. | C. | D. |
(3)取少许滤液于试管中,滴入几滴KSCN溶液,显红色,说明滤液中含有
 溶液紫色褪去,说明滤液中存在具有
溶液紫色褪去,说明滤液中存在具有(4)为进一步探究
 和
和 的氧化性和还原性,该兴趣小组设计并进行如下实验,记录现象,完成实验报告。
的氧化性和还原性,该兴趣小组设计并进行如下实验,记录现象,完成实验报告。| 实验操作 | 实验现象 | 离子方程式 | 实验结论 |
向 溶液中添加新制氯水 溶液中添加新制氯水 | 溶液由浅绿色变为棕黄色 |  | ① |
向 溶液加入足量的铁粉 溶液加入足量的铁粉 | 铁粉逐渐溶解,溶液由棕黄色变为浅绿色 | ② |  具有氧化性 具有氧化性 |

①用离子方程式解释加入且
 的目的是
的目的是②溶液颜色越深,光的透过能力越差,即透光率越小。若不加
 ,测出菠菜中铁元素的含量
,测出菠菜中铁元素的含量③测得10mL滤液中
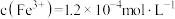 ,该菠菜中铁元素的含量为
,该菠菜中铁元素的含量为
您最近一年使用:0次
10 . 为了探究铁及其化合物的氧化性或还原性,某同学设计如下实验操作,对应的实验现象、实验结论及离子方程式均正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 | 离子方程式 |
| A | 向 溶液中加入 溶液中加入 片 片 | 浅绿色溶液变为无色,溶液中有黑色固体生成 |  具有还原性 具有还原性 |  |
| B | 向 溶液中滴加新制氯水 溶液中滴加新制氯水 | 浅绿色溶液变为棕黄色 |  具有还原性 具有还原性 | 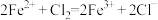 |
| C | 向 溶液中加入铁粉 溶液中加入铁粉 | 棕黄色溶液变为浅绿色 |  具有还原性 具有还原性 | 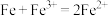 |
| D | 向 溶液中加入铜粉 溶液中加入铜粉 | 蓝色溶液变为棕黄色 |  具有氧化性 具有氧化性 | 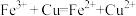 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-05更新
|
1073次组卷
|
8卷引用:湖南省泸溪县第一中学等多校联考2023-2024学年高二上学期8月月考化学试题
湖南省泸溪县第一中学等多校联考2023-2024学年高二上学期8月月考化学试题(苏教版2019)必修第二册专题9 金属与人类文明 第二单元 探究铁及其化合物的转化(已下线)微专题13 亚铁离子、三价铁离子的性质及检验-备战2022年高考化学考点微专题(已下线)3.1.2 铁盐和亚铁盐-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)第三章 铁 金属材料(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)重庆市万州第二高级中学2022-2023学年高一上学期12月线上考试化学试题内蒙古巴彦淖尔市第一中学2022-2023学年高一上学期1月期末考试化学试题云南省保山市腾冲市第八中学2023--2024学年高一上学期期末化学强化训练



