名校
1 . 某实验小组金属的电化学腐蚀实验探究
已知:铁氰化钾是一种无机物,化学式K3[Fe(CN)6],俗称赤血盐、赤血盐钾,为红色晶体,可溶于水,水溶液带有黄绿色荧光,含有铁氰根配离子[Fe(CN)6]3- 。可以和各种盐类反应,对金属盐可能产生沉淀,其试验列表(铁氰化钾为0.1mol·L-1)如下表:
(1)完成下列问题。
①请解释铜丝区域溶液变红的原因是___________ (电极反应式及文字说明)。
②写出生成蓝色沉淀{ Fe3[Fe(CN)6]2 }的离子方程式___________ 。
(2)完成下列问题。
根据实验二的现象,推测K3[Fe(CN)6]可能具有___________ “填氧化性或还原性”。
(3)依据实验二的现象,甲同学认为实验一不一定能说明Fe发生了电化学腐蚀,设计如下实验证明其结论。
根据实验现象推出实验三的结论是:在NaCl溶液中情况下,___________ 。
(4)结合实验一~实验三,乙同学设计如下装置进行实验四,证明金属可以发生电化学腐蚀,当电极X为Fe时,实验四的两个实验方案均可以证明Fe发生电化学腐蚀
①补全实验方案2中的空格部分
②思考:若电极X为Mg时,电流表读数为1.5I,推测电极X为Zn时电流表读数的范围是___________ 。
已知:铁氰化钾是一种无机物,化学式K3[Fe(CN)6],俗称赤血盐、赤血盐钾,为红色晶体,可溶于水,水溶液带有黄绿色荧光,含有铁氰根配离子[Fe(CN)6]3- 。可以和各种盐类反应,对金属盐可能产生沉淀,其试验列表(铁氰化钾为0.1mol·L-1)如下表:
| 加入试剂 | 现象 |
| FeCl3 | 绿褐色沉淀 |
| MgCl2 | 无明显现象 |
| 现配的FeCl2 | 产生深蓝色沉淀 |
| CuSO4 | 深土黄色沉淀 |
(1)完成下列问题。
| 实验序号 | 实验装置 | 实验方案 | 实验现象 |
| 实验一 | 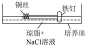 | 1.将0.5g琼脂加入250mL烧杯中,再加入25mL饱和食盐水和75mL水。搅拌、加热煮沸,使琼脂溶解,转入培养皿中。滴入5~6滴酚酞溶液和0.1mol·L-1K3[Fe(CN)6]溶液 | |
| 2.将一个铁钉用砂纸打磨光滑,一端缠有铜丝,放入培养皿中一段时间。 | 铜丝的区域溶液变红色;铁钉区域出现蓝色沉淀 |
②写出生成蓝色沉淀{ Fe3[Fe(CN)6]2 }的离子方程式
(2)完成下列问题。
| 实验序号 | 实验方案 | 实验现象 |
| 实验二 | 取2mL饱和KI溶液于试管中,滴加几滴淀粉,振荡。继续滴加5~6滴0.1mol·L-1K3[Fe(CN)6]溶液,振荡。 | 滴入0.1mol·L-1K3[Fe(CN)6]溶液后,溶液变蓝色。 |
(3)依据实验二的现象,甲同学认为实验一不一定能说明Fe发生了电化学腐蚀,设计如下实验证明其结论。
| 实验序号 | 实验装置 | 实验方案 | 实验现象 |
| 实验三 | 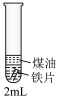 | 1.取2mL煮沸过的0.1mol·L-1K3[Fe(CN)6]溶液于试管中,向试管中加入一小段铁片,再加入1mL煤油液封。 | 溶液无明显变化 |
| 2.继续向试管中加入少许NaCl固体。 | 一段时间后,铁片表面产生大量的蓝色沉淀 |
(4)结合实验一~实验三,乙同学设计如下装置进行实验四,证明金属可以发生电化学腐蚀,当电极X为Fe时,实验四的两个实验方案均可以证明Fe发生电化学腐蚀
①补全实验方案2中的空格部分
| 实验序号 | 实验装置 | 实验方案 | 实验现象 |
| 实验四 |  | 1.按图连接好装置,准确读取电流表读数。 | 电流表指针偏转,读数为I |
| 2.取少量烧杯中溶液于试管中,加入 | 产生蓝色沉淀。 |
您最近一年使用:0次
解题方法
2 . 某化学兴趣小组为制取氯气并探究其性质,按下列装置(部分夹持仪器已略去)进行实验。
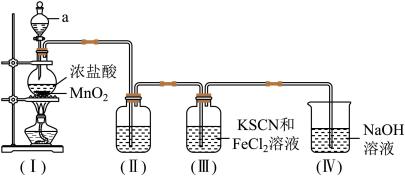
【装置(I)中发生反应的化学方程式:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O】
MnCl2+Cl2↑+2H2O】
【实验探究】
(1)装置(I)中仪器a的名称是___________ 。
(2)为除去Cl2中混有的HCl气体,装置(II)中的溶液是_________ (填“饱和食盐水”或“浓硫酸”)
(3)实验进行一段时间后,装置(III)中溶液颜色变为___________ (填“红色”或“紫色”),该反应中Cl2表现出___________ (填“氧化性”或“还原性”)。
(4)装置(IV)中NaOH溶液的作用是___________ 。
(5)若要生成标准状况下2.24LCl2,理论上参加反应的MnO2的质量是___________ g。(MnO2的摩尔质量为87g·mol-1)
【实验拓展】
(6)图是探究Cl2性质的微型实验,a处是湿润的红纸,b处是浸有淀粉KI溶液的滤纸。向KClO3晶体中滴加浓盐酸后,立即用另一培养皿扣在上面。
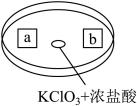
已知:KC1O3+6HCl(浓)=KC1+3C12↑+3H2O
回答下列问题:
①a处湿润的红纸___________ (填“褪色”或“不褪色”)
②b处滤纸变蓝色,写出Cl2与KI反应的化学方程式:___________
【知识应用】
(7)84消毒液(有效成分是NaClO)是常用的消毒剂,NaClO与水和空气里的二氧化碳反应生成___________ 可以消毒杀菌;84消毒液与洁厕灵(其中含盐酸)混合使用会发生反应,补充完整该反应的化学方程式:NaClO+2HCl=NaCl+___________ ↑+H2O。

【装置(I)中发生反应的化学方程式:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O】
MnCl2+Cl2↑+2H2O】【实验探究】
(1)装置(I)中仪器a的名称是
(2)为除去Cl2中混有的HCl气体,装置(II)中的溶液是
(3)实验进行一段时间后,装置(III)中溶液颜色变为
(4)装置(IV)中NaOH溶液的作用是
(5)若要生成标准状况下2.24LCl2,理论上参加反应的MnO2的质量是
【实验拓展】
(6)图是探究Cl2性质的微型实验,a处是湿润的红纸,b处是浸有淀粉KI溶液的滤纸。向KClO3晶体中滴加浓盐酸后,立即用另一培养皿扣在上面。

已知:KC1O3+6HCl(浓)=KC1+3C12↑+3H2O
回答下列问题:
①a处湿润的红纸
②b处滤纸变蓝色,写出Cl2与KI反应的化学方程式:
【知识应用】
(7)84消毒液(有效成分是NaClO)是常用的消毒剂,NaClO与水和空气里的二氧化碳反应生成
您最近一年使用:0次
名校
3 . 为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
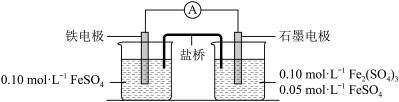
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L−1 FeSO4溶液,需要的仪器有药匙、玻璃棒、_______ (从下列图中选择,写出名称)。

(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择_______ 作为电解质。
(3)电流表显示电子由铁电极流向石墨电极。可知盐桥中的阳离子进入_______ 电极溶液中(填“铁电极”或“石墨电极”)。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L−1.石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=_______ 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______ ,因此,验证了Fe2+氧化性小于_______ ,(填“Fe”或“Fe3+” ,下同)还原性小于_______ 。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_______ 。

回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L−1 FeSO4溶液,需要的仪器有药匙、玻璃棒、

(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择
阳离子 | u∞×108/(m2·s−1·V−1) | 阴离子 | u∞×108/(m2·s−1·V−1) |
Li+ | 4.07 |
| 4.61 |
Na+ | 5.19 |
| 7.40 |
Ca2+ | 6.59 | Cl− | 7.91 |
K+ | 7.62 |
| 8.27 |
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L−1.石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是
您最近一年使用:0次
名校
解题方法
4 . 物质的性质决定着其在生产生活中的应用。下列对应关系正确的是
| 选项 | 性质 | 应用 |
| A | NaHCO3受热分解产生CO2 | 用作膨松剂 |
| B | NaClO的水溶液显碱性 | NaClO是84消毒液的有效成分 |
| C | Fe的金属性强于Cu | 用FeCl3溶液刻蚀Cu电路板 |
| D | FeCl3溶液具有氧化性 | 用于伤口止血 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 下列有关物质性质和该性质的应用均正确的是
| A.二氧化锰具有强氧化性,可用作H202分解的氧化剂 |
| B.K2Fe04具有还原性,可用于自来水的杀菌消毒 |
| C.Fe3+具有氧化性,可溶解印刷线路板上的金属铜 |
| D.二氧化硫和氯水均具有漂白性,可将两者混合使用增强漂白效果 |
您最近一年使用:0次
2018-08-19更新
|
186次组卷
|
3卷引用:福建省厦门双十中学2018-2019学年高二上学期第一次返校考试化学试题
11-12高三上·广东揭阳·开学考试
名校
6 . 近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面。高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂。干燥的高铁酸钾受热易分解,在198℃以下是稳定的。高铁酸钾在水处理过程中涉及的变化过程有( )
①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
| A.①②③④ | B.①③④⑥ | C.②③④⑤ | D.②③⑤⑥ |
您最近一年使用:0次
2019-12-13更新
|
981次组卷
|
30卷引用:福建省平和县第一中学2018-2019学年高二下学期第二次月考化学试题
福建省平和县第一中学2018-2019学年高二下学期第二次月考化学试题2014-2015安徽省濉溪县高二上学期期末考试化学试卷山西省怀仁县第一中学(两校区)2016-2017学年高二下学期期末考试化学试题人教版2017-2018学年高二化学同步练习:选修五 4-3-1 蛋白质和核酸2【全国百强校】福建省莆田市第一中学2019届高三上学期第一次月考化学试题黑龙江省龙东南联合体2018-2019学年高二下学期期末考试化学试题(已下线)【新东方】 2020-17新疆石河子第一中学2021-2022学年高二5月月考化学试题(已下线)2012届广东省揭阳第一中学高三上学期摸底考试理综卷(化学部分)(已下线)2014届辽宁省五校协作体高三上学期期初考试化学试卷(已下线)2014高考化学二轮复习限时集训 专题1物质的组成分类变化和用语练习卷(已下线)2014届江西省金溪一中高三理科综合训练题(二)化学试卷(已下线)2015届甘肃省河西三校普通高中高三第一次联考化学试卷2016届江苏省宿迁市三校高三9月学情调研化学试卷2018版化学(苏教版)高考总复习专题五课时跟踪训练--原子结构与核外电子排布新疆阿克苏市农一师中学2018届高三上学期第二次月考化学试题(已下线)二轮复习 专题1 物质的组成、性质、分类与化学用语 押题专练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第1讲 物质的组成、性质和分类 【教学案】【全国百强校】山东省济南市历城第二中学2019届高三上学期11月调研检测化学试题(已下线)2019高考备考二轮复习精品资料-专题1 物质的组成、性质、分类与化学用语(押题专练)河北省隆化县存瑞中学2020届高三上学期第一次质检化学试题河北省辛集中学2020届高三上学期期中考试化学试题河南省信阳市罗山县高级中学老校区2020届高三第七次模拟考试化学试题湖南省浏阳一中、株洲二中等湘东七校2020届高三12月联考化学试题山西省太原市实验中学2020届高三上学期第一次月考化学试题(已下线)专题3.2 铁及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》(已下线)第05讲 物质的组成、性质和分类(精讲)——2021年高考化学一轮复习讲练测山西省榆社中学2021届高三上学期第六次模块诊断化学试题河南省温县第一高级中学2021-2022学年高三上学期11月月考化学试题(已下线)考点01 物质的分类及转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
14-15高二上·福建莆田·期中
7 . 化学兴趣小组为探究某铁矿石(主要成分为Fe2O3和SiO2)的性质,进行如下实验:
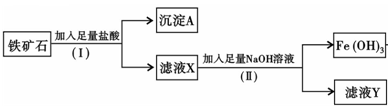
(1)步骤(I)中分离溶液和沉淀的操作名称是 ;
(2)沉淀A中一定含有 ,该物质属于 (填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈 (填“黄色”或“红色”)
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式 。

(1)步骤(I)中分离溶液和沉淀的操作名称是 ;
(2)沉淀A中一定含有 ,该物质属于 (填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈 (填“黄色”或“红色”)
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式 。
您最近一年使用:0次
名校
8 . (I)FeCl3 具有净水作用,但会腐蚀设备.请回答下列问题:
(1)FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)___________ .
(2)为节约成本,工业上通常用ClO2 氧化酸性FeCl2 废液得到FeCl3,并不产生污染.
①若某酸性FeCl2 废液中:c(Fe2+)=2.0×10﹣2mol•L﹣1,c(Fe3+)=1.0×10﹣3mol•L﹣1,c(Cl﹣)=5.3×10﹣2mol•L﹣1,则该溶液的pH约为_____________ .
②完成ClO2 处理酸性FeCl2的离子方程式:_________________
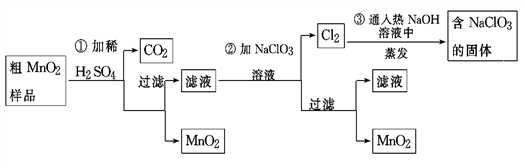
(II)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
(1)第①步加稀H2SO4时,粗MnO2样品中的________________ (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式并配平:□_____ +□ClO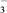 +□____===□MnO2↓+□Cl2↑+□____。
+□____===□MnO2↓+□Cl2↑+□____。
(3)两次过滤后对MnO2固体洗涤2~3次,如何确定是否洗涤干净?___________________
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要____ mol NaClO3 。
(1)FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)
(2)为节约成本,工业上通常用ClO2 氧化酸性FeCl2 废液得到FeCl3,并不产生污染.
①若某酸性FeCl2 废液中:c(Fe2+)=2.0×10﹣2mol•L﹣1,c(Fe3+)=1.0×10﹣3mol•L﹣1,c(Cl﹣)=5.3×10﹣2mol•L﹣1,则该溶液的pH约为
②完成ClO2 处理酸性FeCl2的离子方程式:
(II)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
(1)第①步加稀H2SO4时,粗MnO2样品中的
(2)第②步反应的离子方程式并配平:□
 +□____===□MnO2↓+□Cl2↑+□____。
+□____===□MnO2↓+□Cl2↑+□____。(3)两次过滤后对MnO2固体洗涤2~3次,如何确定是否洗涤干净?
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要
您最近一年使用:0次






