名校
解题方法
1 . 由硫铁矿烧渣(主要含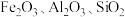 )制取绿矾
)制取绿矾 的流程如下:
的流程如下:
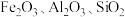 )制取绿矾
)制取绿矾 的流程如下:
的流程如下:
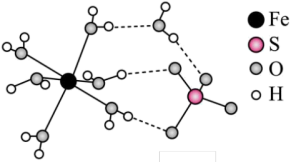
A.“检验”时可用 溶液检验上一步“反应”是否进行完全 溶液检验上一步“反应”是否进行完全 |
| B.将第二次“过滤”所得滤液加热,经蒸发结晶可以制得绿矾 |
C.绿矶中 为配体,中心离子的配位数为7 为配体,中心离子的配位数为7 |
| D.绿矾中存在共价键、配位键、氢键、离子键 |
您最近一年使用:0次
名校
2 .  的配位化合物较稳定且用运广泛。
的配位化合物较稳定且用运广泛。 可与
可与 、
、 、
、 等配体形成溶液呈浅紫色的
等配体形成溶液呈浅紫色的 、红色的
、红色的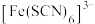 、无色的
、无色的 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: 的溶液中加入KSCN溶液生成蓝色的
的溶液中加入KSCN溶液生成蓝色的 的配离子,
的配离子, 不能与
不能与 形成配位离子。下列说法错误的是
形成配位离子。下列说法错误的是
 的配位化合物较稳定且用运广泛。
的配位化合物较稳定且用运广泛。 可与
可与 、
、 、
、 等配体形成溶液呈浅紫色的
等配体形成溶液呈浅紫色的 、红色的
、红色的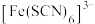 、无色的
、无色的 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: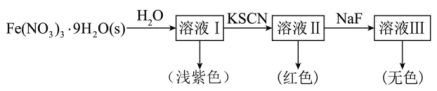
 的溶液中加入KSCN溶液生成蓝色的
的溶液中加入KSCN溶液生成蓝色的 的配离子,
的配离子, 不能与
不能与 形成配位离子。下列说法错误的是
形成配位离子。下列说法错误的是| A.Fe晶体中原子通过金属阳离子和自由电子间的静电作用相结合 |
B.可用NaF和KSCN溶液检验 溶液中是否含有 溶液中是否含有 |
C.溶液Ⅰ中 仅参与形成范德华力和氢键 仅参与形成范德华力和氢键 |
D.上述实验可得出,与 形成配合物的能力: 形成配合物的能力: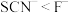 |
您最近一年使用:0次
2024-04-22更新
|
216次组卷
|
3卷引用:福建省宁德市福安市第一中学2023-2024学年高二下学期3月月考化学试题
名校
3 . 下列方程式与所给事实不相符的是
A.用KSCN溶液检验 : :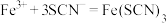 |
B.甲醛使高锰酸钾溶液褪色: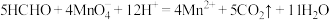 |
C.硫酸铜溶液中加过量氨水: |
D.加热 溶液,溶液变成黄绿色: 溶液,溶液变成黄绿色: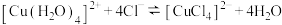  |
您最近一年使用:0次
解题方法
4 . 某学习小组欲利用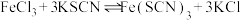 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变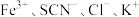 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是___________ (填A或B)。原因是:___________ 。
(2)取 溶液X,加入5滴
溶液X,加入5滴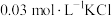 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:①___________ 对平衡产生了影响;②不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.为了探究KCl对 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
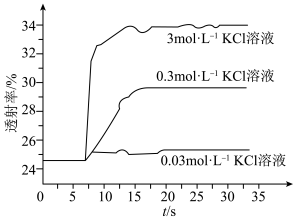
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响___________ 移动(填“正向、逆向或不”)。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:___________ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:
a.溶液中的 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②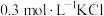 溶液、③
溶液、③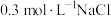 溶液、④
溶液、④ 溶液、⑤
溶液、⑤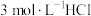 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
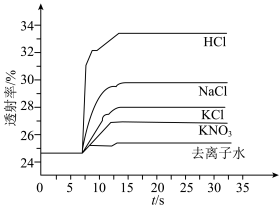
上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是___________ 。盐效应影响较大的阳离子是___________ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)已知 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:___________ 。
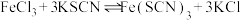 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
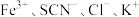 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取
 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是(2)取
 溶液X,加入5滴
溶液X,加入5滴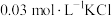 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:① 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.为了探究KCl对
 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。 猜想②:
 产生的影响。
产生的影响。 猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:a.溶液中的
 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取
 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②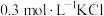 溶液、③
溶液、③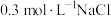 溶液、④
溶液、④ 溶液、⑤
溶液、⑤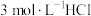 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)已知
 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:
您最近一年使用:0次
名校
5 . 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
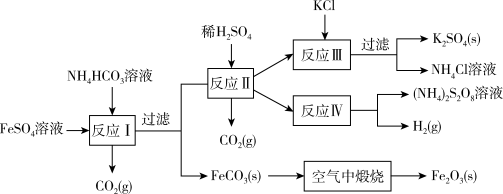
(1)反应Ⅰ前需在 溶液中加入___________(填字母),以除去溶液中的
溶液中加入___________(填字母),以除去溶液中的 ;
;
(2)反应Ⅰ需控制反应温度低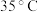 ,其目的是
,其目的是___________ 。
(3)反应Ⅳ常被用于电解生产 (过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为
(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为___________ 。
(4)反应Ⅰ的离子方程式为___________ 。
(5)空气中煅烧的化学方程式为___________ 。

(1)反应Ⅰ前需在
 溶液中加入___________(填字母),以除去溶液中的
溶液中加入___________(填字母),以除去溶液中的 ;
;| A.锌粉 | B.铁屑 | C. 溶液 溶液 | D. |
(2)反应Ⅰ需控制反应温度低
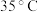 ,其目的是
,其目的是(3)反应Ⅳ常被用于电解生产
 (过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为
(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为(4)反应Ⅰ的离子方程式为
(5)空气中煅烧的化学方程式为
您最近一年使用:0次
6 . 常温下,下列各组离子在制定溶液中一定能大量共存的是
A. 的溶液: 的溶液: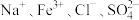 |
B.甲基橙呈红色的溶液: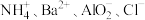 |
C.纯碱的稀溶液: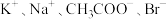 |
D.与铝反应产生大量氢气的溶液: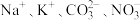 |
您最近一年使用:0次
7 . 下列实验现象描述正确的是
| A.KOH溶液中滴加酚酞试液,一段时间后溶液呈无色 |
| B.新制Cu(OH)2悬浊液中加入葡萄糖溶液并加热,产生砖红色沉淀 |
| C.FeCl3溶液中滴入KSCN溶液,溶液呈蓝色 |
| D.H2在Cl2中燃烧,发出黄色火焰 |
您最近一年使用:0次
名校
8 . 5mL0.1mol·L-1FeCl3溶液与1mL0.1mol·L-1KI溶液发生反应: ,达到平衡。下列说法正确的是
,达到平衡。下列说法正确的是
 ,达到平衡。下列说法正确的是
,达到平衡。下列说法正确的是| A.加入四氯化碳,振荡,静置分层,下层为紫红色,表明该化学反应存在限度 |
| B.在溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度 |
| C.加入苯,振荡,平衡不移动 |
| D.向该平衡体系中加水,平衡逆向移动 |
您最近一年使用:0次
2023-10-17更新
|
31次组卷
|
3卷引用:福建省南平市高级中学2023-2024学年高二上学期期中考试化学试题
名校
9 . 某实验小组金属的电化学腐蚀实验探究
已知:铁氰化钾是一种无机物,化学式K3[Fe(CN)6],俗称赤血盐、赤血盐钾,为红色晶体,可溶于水,水溶液带有黄绿色荧光,含有铁氰根配离子[Fe(CN)6]3- 。可以和各种盐类反应,对金属盐可能产生沉淀,其试验列表(铁氰化钾为0.1mol·L-1)如下表:
(1)完成下列问题。
①请解释铜丝区域溶液变红的原因是___________ (电极反应式及文字说明)。
②写出生成蓝色沉淀{ Fe3[Fe(CN)6]2 }的离子方程式___________ 。
(2)完成下列问题。
根据实验二的现象,推测K3[Fe(CN)6]可能具有___________ “填氧化性或还原性”。
(3)依据实验二的现象,甲同学认为实验一不一定能说明Fe发生了电化学腐蚀,设计如下实验证明其结论。
根据实验现象推出实验三的结论是:在NaCl溶液中情况下,___________ 。
(4)结合实验一~实验三,乙同学设计如下装置进行实验四,证明金属可以发生电化学腐蚀,当电极X为Fe时,实验四的两个实验方案均可以证明Fe发生电化学腐蚀
①补全实验方案2中的空格部分
②思考:若电极X为Mg时,电流表读数为1.5I,推测电极X为Zn时电流表读数的范围是___________ 。
已知:铁氰化钾是一种无机物,化学式K3[Fe(CN)6],俗称赤血盐、赤血盐钾,为红色晶体,可溶于水,水溶液带有黄绿色荧光,含有铁氰根配离子[Fe(CN)6]3- 。可以和各种盐类反应,对金属盐可能产生沉淀,其试验列表(铁氰化钾为0.1mol·L-1)如下表:
| 加入试剂 | 现象 |
| FeCl3 | 绿褐色沉淀 |
| MgCl2 | 无明显现象 |
| 现配的FeCl2 | 产生深蓝色沉淀 |
| CuSO4 | 深土黄色沉淀 |
(1)完成下列问题。
| 实验序号 | 实验装置 | 实验方案 | 实验现象 |
| 实验一 |  | 1.将0.5g琼脂加入250mL烧杯中,再加入25mL饱和食盐水和75mL水。搅拌、加热煮沸,使琼脂溶解,转入培养皿中。滴入5~6滴酚酞溶液和0.1mol·L-1K3[Fe(CN)6]溶液 | |
| 2.将一个铁钉用砂纸打磨光滑,一端缠有铜丝,放入培养皿中一段时间。 | 铜丝的区域溶液变红色;铁钉区域出现蓝色沉淀 |
②写出生成蓝色沉淀{ Fe3[Fe(CN)6]2 }的离子方程式
(2)完成下列问题。
| 实验序号 | 实验方案 | 实验现象 |
| 实验二 | 取2mL饱和KI溶液于试管中,滴加几滴淀粉,振荡。继续滴加5~6滴0.1mol·L-1K3[Fe(CN)6]溶液,振荡。 | 滴入0.1mol·L-1K3[Fe(CN)6]溶液后,溶液变蓝色。 |
(3)依据实验二的现象,甲同学认为实验一不一定能说明Fe发生了电化学腐蚀,设计如下实验证明其结论。
| 实验序号 | 实验装置 | 实验方案 | 实验现象 |
| 实验三 | 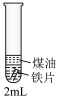 | 1.取2mL煮沸过的0.1mol·L-1K3[Fe(CN)6]溶液于试管中,向试管中加入一小段铁片,再加入1mL煤油液封。 | 溶液无明显变化 |
| 2.继续向试管中加入少许NaCl固体。 | 一段时间后,铁片表面产生大量的蓝色沉淀 |
(4)结合实验一~实验三,乙同学设计如下装置进行实验四,证明金属可以发生电化学腐蚀,当电极X为Fe时,实验四的两个实验方案均可以证明Fe发生电化学腐蚀
①补全实验方案2中的空格部分
| 实验序号 | 实验装置 | 实验方案 | 实验现象 |
| 实验四 |  | 1.按图连接好装置,准确读取电流表读数。 | 电流表指针偏转,读数为I |
| 2.取少量烧杯中溶液于试管中,加入 | 产生蓝色沉淀。 |
您最近一年使用:0次
名校
解题方法
10 . 为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计不合理的是

| A.④ | B.③ |
| C.③④ | D.①②③④⑤ |
您最近一年使用:0次
2023-08-16更新
|
921次组卷
|
43卷引用:2015-2016学年福建省龙海二中高二下学期期末化学试卷
2015-2016学年福建省龙海二中高二下学期期末化学试卷上海市控江中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2014届辽宁省新民市第一高级中学高三上学期期末考试化学试卷(已下线)2015届宁夏银川市唐徕回民中学高三上学期期中考试化学试卷2014-2015天津市和平区高一上学期期末考试化学试卷2017届吉林省汪清六中高三上第二次月考化学试卷2016-2017学年河北石家庄辛集中学高一上阶段考二化学卷河北省辛集中学2017-2018学年高一上学期12月月考化学试题河南省商丘市第一高级中学2017-2018学年高一上学期第二次月考化学试题黑龙江省大庆第一中学2017-2018学年高一上学期期末考试化学试题广西陆川县中学2017-2018学年高一上学期期末考试化学试题吉林省柳河中学2017-2018学年高一上学期期末考试化学试题【校级联考】天津市静海区2019届高三上学期三校联考化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高一上学期第二次月考化学试题内蒙古自治区翁牛特旗乌丹第一中学2018-2019学年高一上学期期中考试化学试题山东省莒县第一中学2018-2019学年高一上学期12月月考化学试题西藏自治区拉萨市那曲第二高级中学2019-2020学年高一上学期期末考试化学试题河北省张家口市宣化区第一中学2019-2020学年高一3月月考化学试题江西省临川第一中学2019-2020学年高一上学期12月月考化学试题人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物(已下线)第三章 铁 金属材料(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版2019必修第一册)北京首都师范大学第二附属中学2021届高三9月月考化学试题(已下线)3.2.3 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(已下线)3.1.2 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)云南省普洱市景东彝族自治县第一中学2020-2021学年高一上学期月考化学试题江西省会昌中学2020-2021学年高一上学期第二次月考化学试题江西省新余市第四中学2020-2021学年高一上学期第二次段考化学试题云南省文山州砚山县第三高级中学2020-2021学年高一12月月考化学试题(已下线)3.1.2 铁盐和亚铁盐-2021-2022学年高一化学课后培优练(人教版2019必修第一册)吉林省长春外国语学校2021-2022学年高一上学期第二次月考化学试题(已下线)易错专题23 Fe2+和Fe3+的检验与转化-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)新疆乌鲁木齐市第四中学2021-2022学年高一上学期期末考试化学试题河北省辛集市第一中学2021-2022学年高一上学期第四次月考化学试题宁夏石嘴山市第三中学2021-2022学年高一上学期期末考试化学试题(已下线)第12讲 铁、亚铁盐和铁盐-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)云南省大理市黄冈实验中学2021-2022学年高一上学期12月月考化学试题第2课时 铁盐和亚铁盐第1课时 亚铁盐和铁盐安徽省合肥市第三中学2023-2024学年高一上学期12月份学情调研化学试题天津北京师范大学静海附属学校 (天津市静海区北师大实验学校)2023-2024学年高三上学期第二次阶段检测(期中)化学试题



