1 . 下列有关实验操作的解释或结论正确的是
实验操作 | 解释或结论 | |
A | 向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色变浅 固体,溶液红色变浅 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
B | 用蒸馏水润湿的 试纸测溶液 试纸测溶液 | 一定会使测定结果偏低 |
C | 向某溶液中滴入氯水,再滴加 溶液,溶液显红色 溶液,溶液显红色 | 证明原溶液中一定有 |
D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得 偏大 偏大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 常温下,下列各组离子能大量共存的是
A. 的溶液中: 的溶液中: 、 、 、 、 、 、 |
B. 的溶液中: 的溶液中: 、 、 、 、 、 、 |
C. 的溶液中: 的溶液中: 、 、 、 、 、 、 |
D.新制的双氧水溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
2022-07-15更新
|
170次组卷
|
2卷引用:福建省莆田市2021-2022学年高二下学期期末质量监测化学试题
名校
解题方法
3 . 下列实验现象描述正确的是
| A.FeCl3溶液中滴入KSCN溶液,溶液呈蓝色 |
| B.新制Cu(OH)2悬浊液中加入葡萄糖溶液并加热,产生砖红色沉淀 |
| C.NaOH溶液中滴入酚酞试液,溶液呈无色 |
| D.品红溶液中通入SO2气体,溶液呈紫色 |
您最近一年使用:0次
4 . 常温时,下列各组溶液中的离子一定能够大量共存的是
A. 的 的 溶液: 溶液: 、 、 、 、 、 、 |
B.含有大量 的溶液: 的溶液: 、 、 、 、 、 、 |
C.使甲基橙试液变黄的溶液: 、 、 、 、 、 、 |
D.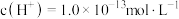 的溶液: 的溶液: 、 、 、 、 、 、 |
您最近一年使用:0次
解题方法
5 . 向H2O2溶液中滴加少量FeSO4溶液,溶液迅速变黄,稍后产生气体;再加入KSCN溶液,溶液变红,一段时间后,溶液颜色明显变浅。依据实验现象,下列分析正确 的是
| A.产生气体的原因是FeSO4将H2O2还原生成了O2 |
| B.H2O2溶液与FeSO4溶液反应生成Fe3+的证据是“溶液迅速变黄”和“溶液变红” |
| C.溶液颜色变浅,可能是反应过程生成的水将Fe(SCN)3浓度稀释了 |
D.溶液变红的原因可用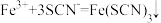 表示 表示 |
您最近一年使用:0次
6 . 配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:
I.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是______ 。
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为______ 。
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于______ (填字母代号)。
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:______ ;能使该反应发生的可能原因是______ 。
II.已知: 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色
在溶液中为黄色
(1)下列反应曾用于检测司机是否酒后驾驶:2 +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
①基态Cr原子外围电子排布图为______ ;配合物[Cr(H2O)6]3+中与Cr3+形成配位键的原子是______ (填元素符号)。
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为______ 。
(2)有下列实验:
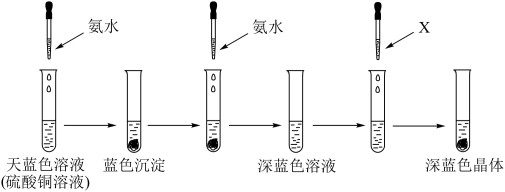
①呈天蓝色的离子的化学式为______ ,溶剂X可以是______ (填名称),继续添加氨水,沉淀溶解的离子方程式为______ 。
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是______ 。
③下列有关化学实验的“操作→现象→解释”均正确的是______ 。
I.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:
II.已知:
 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色
在溶液中为黄色(1)下列反应曾用于检测司机是否酒后驾驶:2
 +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH①基态Cr原子外围电子排布图为
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为
(2)有下列实验:

①呈天蓝色的离子的化学式为
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是
③下列有关化学实验的“操作→现象→解释”均正确的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | Fe3++3SCN-=Fe(SCN)3↓ |
| B | 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知Cr3+的配位数为6,则 CrCl3·6H2O的化学式可表示为[Cr(H2O)5Cl]Cl2·H2O |
| C | 向溶液K2Cr2O7溶液中先滴加3滴浓硫酸,再改加10滴浓NaOH | 溶液先橙色加深,后变为黄 色 | 溶液中存在 +H2O⇌2 +H2O⇌2 +2H+ +2H+ |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
您最近一年使用:0次
名校
解题方法
7 . 硫酸镍广泛应用于电镀、电池、催化剂等工业。某科研小组以粗硫酸镍(含Cu2+、Fe3+、Ca2+、Mg2+、Zn2+等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。回答下列问题。

(1)滤渣1的主要成分是__ (写化学式),写出“硫化除铜”过程中发生的氧化还原反应的离子方程式___ 。
(2)“氧化除杂”时加入Cl2和Ni(OH)2的作用分别是___ 。
(3)已知25℃时,Ksp[CaF2]=3.95×10-11;Ksp[MgF2]=6.40×10-9。则“氟化除杂”过后滤液3中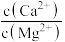 =
=__ 。(保留三位有效数字)
(4)“萃取”时使用萃取剂R在硫酸盐中对某些金属离子的萃取率与溶液pH的关系如图。则实验时需控制的pH适宜范围是___ (填字母序号)。

A.1~2 B.3~4 C.4~5 D.5~6
(5)将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为___ 、___ 、过滤、洗涤等。
(6)称取2.000g硫酸镍晶体(NiSO4·6H2O)样品溶解,定容至250mL。取25.00mL试液,用0.0200mol·L-1的EDTA(Na2H2Y)标准溶液滴定至终点。重复实验,平均消耗EDTA标准溶液体积为36.50mL。反应为Ni2++H2Y2-=NiY2-+2H+。计算样品纯度为__ %。(保留三位有效数字,且不考虑杂质反应)

(1)滤渣1的主要成分是
(2)“氧化除杂”时加入Cl2和Ni(OH)2的作用分别是
(3)已知25℃时,Ksp[CaF2]=3.95×10-11;Ksp[MgF2]=6.40×10-9。则“氟化除杂”过后滤液3中
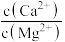 =
=(4)“萃取”时使用萃取剂R在硫酸盐中对某些金属离子的萃取率与溶液pH的关系如图。则实验时需控制的pH适宜范围是

A.1~2 B.3~4 C.4~5 D.5~6
(5)将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为
(6)称取2.000g硫酸镍晶体(NiSO4·6H2O)样品溶解,定容至250mL。取25.00mL试液,用0.0200mol·L-1的EDTA(Na2H2Y)标准溶液滴定至终点。重复实验,平均消耗EDTA标准溶液体积为36.50mL。反应为Ni2++H2Y2-=NiY2-+2H+。计算样品纯度为
您最近一年使用:0次
2020-06-23更新
|
174次组卷
|
2卷引用:福建省漳浦第一中学、双十中学漳州校区2021-2022学年高二下学期期末联考化学试题



