解题方法
1 . 长期放置的FeSO4溶液易被氧化而变质。某兴趣小组分别对新制和久置的两瓶FeSO4溶液进行了如表实验。
I.分别取2mL新制的FeSO4溶液于两支试管中,进行如图实验。
(1)实验i中,现象a是___________ 。
(2)写出实验ii中酸性双氧水参与反应的的离子方程式:___________ 。
II.久置的FeSO4溶液。
(3)为证明FeSO4溶液部分变质,实验iv操作是___________ 。
(4)小组同学查阅资料得知,“维生素C可将Fe3+转化为Fe2+”。为了验证维生素C的作用,设计了如表实验v。
由实验v能否得出___________ (填“能”或“否”)“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由___________ 。
I.分别取2mL新制的FeSO4溶液于两支试管中,进行如图实验。
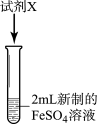 | 实验 | 试剂X | 实验现象 |
| 实验i | 1mL1mol/LNaOH溶液 | 现象a | |
| 实验ii | 依次加入5滴KSCN溶液、5滴酸性双氧水 | 现象b:加入KSCN后无明显现象,加入双氧水后溶液变成红色 |
(1)实验i中,现象a是
(2)写出实验ii中酸性双氧水参与反应的的离子方程式:
II.久置的FeSO4溶液。
| 实验操作 | 实验现象 | 实验结论 | |
| 实验iii | 取少量久置的FeSO4溶液于试管中,向其中滴加5滴KSCN溶液 | 溶液变红 | FeSO4溶液部分变质 |
| 实验iv | |||
(3)为证明FeSO4溶液部分变质,实验iv操作是
(4)小组同学查阅资料得知,“维生素C可将Fe3+转化为Fe2+”。为了验证维生素C的作用,设计了如表实验v。
| 实验操作 | 实验现象 | |
| 实验v | 取一定量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性KMnO4溶液 | 紫色褪去 |
由实验v能否得出
您最近一年使用:0次
名校
解题方法
2 . 高中常用“价类二维”思路研究物质的性质,右下图是铁及其化合物的二维图的部分信息。

(1)X的化学式为______ 。
图中物质只具有还原性的是______ 。(写化学式)
(2)将 溶液转化为
溶液转化为 的试剂可选
的试剂可选______ 。
a.稀硫酸 b. 溶液 c.酸性
溶液 c.酸性 d.溴水
d.溴水
(3)某中学实验小组设计如下实验探究亚铁盐的性质。
①实验Ⅰ中由白色沉淀生成红褐色沉淀的化学方程式__________________ 。
②对实验Ⅱ所得白色沉淀展开研究:
查阅资料:在溶液中不存在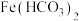
i.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量氯水,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为__________________ 。
(4) 可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 以利于人体吸收。为了验证这一猜想,设计如下实验:
以利于人体吸收。为了验证这一猜想,设计如下实验:
由上述实验能否得出维生素C可将 转化为
转化为 为的结论?
为的结论?_______ (填“能”或“否”),请说明理由:_____________________ 。

(1)X的化学式为
图中物质只具有还原性的是
(2)将
 溶液转化为
溶液转化为 的试剂可选
的试剂可选a.稀硫酸 b.
 溶液 c.酸性
溶液 c.酸性 d.溴水
d.溴水(3)某中学实验小组设计如下实验探究亚铁盐的性质。
实验方案 | 现象 | |
Ⅰ | 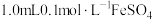 溶液中滴加1.0mL0.5 mol∙L−1 NaOH溶液 溶液中滴加1.0mL0.5 mol∙L−1 NaOH溶液 | 生成白色沉淀,后沉淀基本变为红褐色 |
Ⅱ | 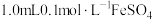 溶液中滴加1.0mL0.5 mol∙L−1 溶液中滴加1.0mL0.5 mol∙L−1 溶液 溶液 | 生成白色沉淀,后沉淀颜色几乎不变 |
②对实验Ⅱ所得白色沉淀展开研究:
查阅资料:在溶液中不存在
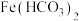
i.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量氯水,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为
(4)
 可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 以利于人体吸收。为了验证这一猜想,设计如下实验:
以利于人体吸收。为了验证这一猜想,设计如下实验:实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 溶液紫红色褪去 |
 转化为
转化为 为的结论?
为的结论?
您最近一年使用:0次
2022-09-06更新
|
599次组卷
|
4卷引用:天津市河西区2021-2022学年高一上学期期末质量调查化学试题
天津市河西区2021-2022学年高一上学期期末质量调查化学试题上海市敬业中学2022-2023学年高二上学期10月月考(等级考)化学试题天津市河西区微山路中学2022-2023学年高一上学期期末考试化学试题(已下线)专题07 铁及其化合物 金属材料-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)
解题方法
3 . 利用“价一类”二维图研究物质的性质是一种有效的学习方法。铁及其部分化合物的“价一类”二维图如图所示。

(1)X、Y的化学式分别为_______ 、_______ 。
(2)图中只具有还原性的物质是_______ (填化学式)。
(3)要证明FeCl2有氧化性,还原性的试剂分别为_______ 、_____ 。
(4)某实验小组设计如下实验探究亚铁盐的性质。
①对实验Ⅱ所得白色沉淀展开研究(已知 在水中不能大量存在):
在水中不能大量存在):
i.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ⅱ.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
ⅲ.向ⅱ所得溶液中再滴入少量 溶液,溶液立即变为红色。
溶液,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为______ 。
②研究过程中发现实验Ⅱ中白色沉淀在空气中久置最终也变为红褐色。则该沉淀的还原性比实验Ⅰ中所得的Fe(OH)2的还原性_______ (填“强”或“弱”)。

(1)X、Y的化学式分别为
(2)图中只具有还原性的物质是
(3)要证明FeCl2有氧化性,还原性的试剂分别为
(4)某实验小组设计如下实验探究亚铁盐的性质。
| 实验 | 操作 | 现象 |
| Ⅰ | 1.0mL 0.1mol/L 溶液中滴入1.0mL 0.5mol/L NaOH溶液 溶液中滴入1.0mL 0.5mol/L NaOH溶液 | 生成白色沉淀,3min后沉淀基本变为红褐色 |
| Ⅱ | 1.0mL 0.1mol/L 溶液中滴入1.0mL 0.5mol/L 溶液中滴入1.0mL 0.5mol/L 溶液 溶液 | 生成白色沉淀,3min后沉淀颜色几乎不变 |
①对实验Ⅱ所得白色沉淀展开研究(已知
 在水中不能大量存在):
在水中不能大量存在):i.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ⅱ.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
ⅲ.向ⅱ所得溶液中再滴入少量
 溶液,溶液立即变为红色。
溶液,溶液立即变为红色。根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为
②研究过程中发现实验Ⅱ中白色沉淀在空气中久置最终也变为红褐色。则该沉淀的还原性比实验Ⅰ中所得的Fe(OH)2的还原性
您最近一年使用:0次
2020-09-15更新
|
348次组卷
|
2卷引用:鲁科版(2019)高一必修第一册第三章第1节 铁的多样性 课时2 铁及其化合物之间的转化关系
4 . 坦克、导弹的制造材料主要是金属合金,钢铁便是其中十分重要的一种。下列关于铁的说法中正确的是
| A.铁元素属于过渡元素,其原子序数为26 |
| B.单质铁与浓硫酸在常温下不反应 |
| C.铁单质只具有还原性,其阳离子只具有氧化性 |
| D.与相同浓度的盐酸反应生成氢气的速率,纯铁比生铁的快 |
您最近一年使用:0次
5 . 下列有关实验现象与物质性质对应关系的说法中,错误 的是
| A.Na2CO3溶液遇酚酞变红,说明Na2CO3溶液呈碱性 |
| B.Cl2使湿润的有色布条褪色,说明Cl2具有漂白性 |
| C.NO遇空气变为红棕色,说明NO具有还原性 |
| D.新制的Fe(OH)2遇氧气变为红褐色,说明Fe(OH)2具有还原性 |
您最近一年使用:0次
2019-01-24更新
|
215次组卷
|
2卷引用:【区级联考】北京市西城区2018-2019学年高一第一学期期末考试化学试题
名校
6 . 铁黑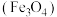 是常见的铁系颜料,:可利用硫铁矿废水为原料进行制备,不仅为硫铁矿废水的处理开辟了新途径,同时也实现了资源利用,生产流程如下:
是常见的铁系颜料,:可利用硫铁矿废水为原料进行制备,不仅为硫铁矿废水的处理开辟了新途径,同时也实现了资源利用,生产流程如下:
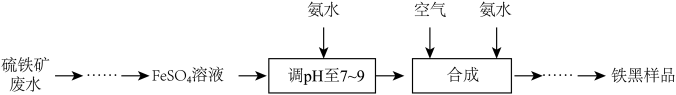
(1)在实验室中,为防止 溶液被氧化变质,需要往试剂瓶中加入
溶液被氧化变质,需要往试剂瓶中加入_______ ,检验 溶液是否变质的常用试剂是
溶液是否变质的常用试剂是_______ 。
(2)加入氨水调 至7~9时,发生反应的离子方程式为
至7~9时,发生反应的离子方程式为_______ ; “合成”步骤中, 转化为
转化为 的化学方程式为
的化学方程式为_______ 。
(3)某化学学习小组测定产品中铁的含量,实验步骤如下:
步骤一:取 铁黑样品于锥形瓶中,加入足量盐酸,加热使之完全溶解。
铁黑样品于锥形瓶中,加入足量盐酸,加热使之完全溶解。
步骤二:加入过量的 溶液将
溶液将 还原成
还原成 ,再加入
,再加入 溶液。
溶液。
步骤三:在酸性条件下,加入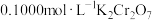 溶液与
溶液与 发生反应:
发生反应:  ,恰好完全反应时,消耗
,恰好完全反应时,消耗 溶液
溶液 。
。
由步骤二得出 的还原性
的还原性_______  的还原性(填“强于”或“弱于”);加入
的还原性(填“强于”或“弱于”);加入 溶液的目的是
溶液的目的是_______ 。样品中 元素的质量分数为
元素的质量分数为_______  。
。
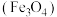 是常见的铁系颜料,:可利用硫铁矿废水为原料进行制备,不仅为硫铁矿废水的处理开辟了新途径,同时也实现了资源利用,生产流程如下:
是常见的铁系颜料,:可利用硫铁矿废水为原料进行制备,不仅为硫铁矿废水的处理开辟了新途径,同时也实现了资源利用,生产流程如下:
(1)在实验室中,为防止
 溶液被氧化变质,需要往试剂瓶中加入
溶液被氧化变质,需要往试剂瓶中加入 溶液是否变质的常用试剂是
溶液是否变质的常用试剂是(2)加入氨水调
 至7~9时,发生反应的离子方程式为
至7~9时,发生反应的离子方程式为 转化为
转化为 的化学方程式为
的化学方程式为(3)某化学学习小组测定产品中铁的含量,实验步骤如下:
步骤一:取
 铁黑样品于锥形瓶中,加入足量盐酸,加热使之完全溶解。
铁黑样品于锥形瓶中,加入足量盐酸,加热使之完全溶解。步骤二:加入过量的
 溶液将
溶液将 还原成
还原成 ,再加入
,再加入 溶液。
溶液。步骤三:在酸性条件下,加入
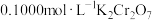 溶液与
溶液与 发生反应:
发生反应:  ,恰好完全反应时,消耗
,恰好完全反应时,消耗 溶液
溶液 。
。由步骤二得出
 的还原性
的还原性 的还原性(填“强于”或“弱于”);加入
的还原性(填“强于”或“弱于”);加入 溶液的目的是
溶液的目的是 元素的质量分数为
元素的质量分数为 。
。
您最近一年使用:0次
2023-04-23更新
|
200次组卷
|
2卷引用:山东省菏泽市2022-2023学年高一上学期教学质量检测(期末)化学试题
2022高一·上海·专题练习
名校
解题方法
7 . 有关铁的氢氧化物的说法中,错误的是
| A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色固体 |
| B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3 |
| C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解 |
| D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔现象 |
您最近一年使用:0次
2022-02-09更新
|
731次组卷
|
6卷引用:5.2.2 重要的金属化合物(第2课时)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)
(已下线)5.2.2 重要的金属化合物(第2课时)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)(已下线)第14讲 铁的单质、氧化物和氢氧化物(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)铁 金属材料——课时1 铁的单质、氧化物和氢氧化物第1课时 铁的单质、氧化物、氢氧化物(已下线)【精品卷】3.1.2 铁的重要化合物课堂例题-人教版2023-2024学年必修第一册河北师范大学附属中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
8 . 下列说法正确的是
| A.常温下,可用浓盐酸与二氧化锰混合制取氯气 |
| B.铝制餐具可用来蒸煮碱性食物 |
C. 在空气中易被氧化成红褐色的 在空气中易被氧化成红褐色的 |
| D.青铜是我国使用最早的合金材料,也是目前世界上使用量最大的合金 |
您最近一年使用:0次
解题方法
9 . 利用元素的化合价推测物质的性质是化学研究的重要于段。下图是铁元素的“价—类”二维图,完成下列问题:

(1)物质的分类:
Fe2O3属于___________ 氧化物(填“酸性”“碱性”或“两性”)。
(2)物质的制备及转化:
Fe(OH)2的制备:在FeSO4溶液中加入NaOH溶液,生成白色沉淀。但是白色沉淀迅速变成灰绿色,一段时间后变成红褐色物质,用化学方程式表示后续颜色变化的原因:___________ 。
(3)物质的检验:
将固体FeCl2溶于盐酸中,滴加KSCN,再逐滴加入氯水,溶液由无色变为___________ ,若继续滴加氯水至过量发现溶液颜色褪去,试分析溶液颜色褪去的原因可能是___________ 。
(4)物质的应用:
高铁酸钾(K2FeO4)是紫色光泽的微细结晶粉末,常用于高铁列车车厢里的一种“绿色环保高效”消毒剂,说明高铁酸钾具有很强的______ 性。

(1)物质的分类:
Fe2O3属于
(2)物质的制备及转化:
Fe(OH)2的制备:在FeSO4溶液中加入NaOH溶液,生成白色沉淀。但是白色沉淀迅速变成灰绿色,一段时间后变成红褐色物质,用化学方程式表示后续颜色变化的原因:
(3)物质的检验:
将固体FeCl2溶于盐酸中,滴加KSCN,再逐滴加入氯水,溶液由无色变为
(4)物质的应用:
高铁酸钾(K2FeO4)是紫色光泽的微细结晶粉末,常用于高铁列车车厢里的一种“绿色环保高效”消毒剂,说明高铁酸钾具有很强的
您最近一年使用:0次
10 . 下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系(条件略去),下列说法中不正确的是
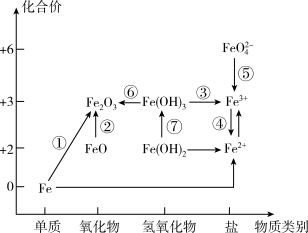

A.加热 发生转化⑥ 发生转化⑥ |
B.⑦转化的化学方程式为: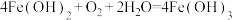 |
C.由图可预测:高铁酸盐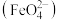 具有氧化性 具有氧化性 |
D.FeO是一种黑色粉末,不稳定,在空气中受热转化成 |
您最近一年使用:0次



