21-22高三上·全国·阶段练习
1 . 某化学兴趣小组用氧化铜制备配位化合物[Cu(NH3)x]SO4·H2O(亮蓝色),并测定该配合物的配位数。
Ⅰ.制备[Cu(NH3)x]SO4·H2O的过程:
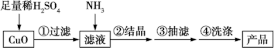
已知:2CuSO4+2NH3·H2O=(NH4)2SO4 +Cu2(OH)2SO4↓(蓝色)
Cu2(OH)2SO4+2xNH3 2[Cu(NH3)x]2++
2[Cu(NH3)x]2++ +2OH−
+2OH−
回答下列问题:
(1)为加快氧化铜的溶解速率,可采用的方法是___________ (回答两种)。
(2)所用的氨气可采用下列装置中的___________ (填字母)制备,相应的制备原理为
___________ (写化学方程式)。
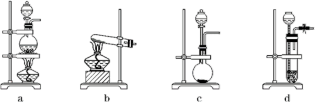
(3)当出现___________  现象时,停止通入氨气。
现象时,停止通入氨气。
(4)在步骤②中,倒入95%酒精,静置一段时间,出现大量蓝色晶体,原因是___________ 。
(5)在步骤④中,加入浓氨水洗涤沉淀的目的是___________ 。
Ⅱ.测定[Cu(NH3)x]SO4·H2O的配位数,装置如下:
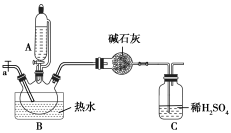
实验操作:称量反应前装置C的质量为327.65 g;取12.30 g产品加入三颈瓶中,加入氢氧化钠溶液,并加热;反应过程中从a通入空气;一段时间后装置C的质量为恒重331.05 g。
(6)根据上述数据计算该配合物的配位数x=___________ ,若反应过程中没有通入空气,则会造成所测结果___________ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备[Cu(NH3)x]SO4·H2O的过程:
已知:2CuSO4+2NH3·H2O=(NH4)2SO4 +Cu2(OH)2SO4↓(蓝色)
Cu2(OH)2SO4+2xNH3
 2[Cu(NH3)x]2++
2[Cu(NH3)x]2++ +2OH−
+2OH−回答下列问题:
(1)为加快氧化铜的溶解速率,可采用的方法是
(2)所用的氨气可采用下列装置中的
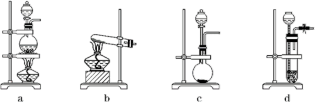
(3)当出现
 现象时,停止通入氨气。
现象时,停止通入氨气。(4)在步骤②中,倒入95%酒精,静置一段时间,出现大量蓝色晶体,原因是
(5)在步骤④中,加入浓氨水洗涤沉淀的目的是
Ⅱ.测定[Cu(NH3)x]SO4·H2O的配位数,装置如下:

实验操作:称量反应前装置C的质量为327.65 g;取12.30 g产品加入三颈瓶中,加入氢氧化钠溶液,并加热;反应过程中从a通入空气;一段时间后装置C的质量为恒重331.05 g。
(6)根据上述数据计算该配合物的配位数x=
您最近一年使用:0次
2 . 工业上常以黄铜矿(主要成分是CuFeS2)为原料制备铜以及副产物铁红(Fe2O3),两种方法均能实现铜的冶炼,其工艺流程如图:

回答下列问题:
(1)为使“焙烧”反应充分进行,工业上可采取的措施是____ (写一条),写出“焙烧”时反应的化学方程式:___ 。
(2)“灼烧1”工序中起氧化作用的物质是____ 。
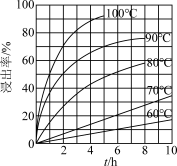
(3)FeCl3溶液“浸取”时,铜的浸出率结果如图所示。由图可知,当铜的浸出率为90%时,所采用的实验条件为____ ,写出该工序发生反应的离子方程式:______ 。
(4)“调节pH”所用试剂X是_____ ,该工序的目的是除去溶液中的Fe3+。当调节溶液的pH=3.5时,Fe3+______ (填“是”或“不是”)沉淀完全[c(Fe3+)≤1×10-5mol•L-1时可认为Fe3+沉淀完全],若滤液中c(Cu2+)=0.2mol•L-1,此时是否有Cu(OH)2析出?_______ (列式计算)。{已知:25℃时,Ksp[Fe(OH)3]=1.0×10-39、Ksp[Cu(OH)2]=2.2×10-20}
(5)方法乙比方法甲更好,其原因是_____ (写一点)。

回答下列问题:
(1)为使“焙烧”反应充分进行,工业上可采取的措施是
(2)“灼烧1”工序中起氧化作用的物质是
(3)FeCl3溶液“浸取”时,铜的浸出率结果如图所示。由图可知,当铜的浸出率为90%时,所采用的实验条件为

(4)“调节pH”所用试剂X是
(5)方法乙比方法甲更好,其原因是
您最近一年使用:0次
解题方法
3 . 现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
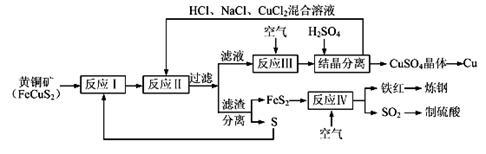
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是_____________ 、_____________ 。
(2)反应Ⅰ的产物为(填化学式)_____________ 。
(3)反应Ⅲ的离子方程式为_____________ 。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是_____________ 。
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是_____________ (填字母)。
(6)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2 + Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为_____________ 。
②反应Ⅳ所得气体中SO2的体积分数为_____________ 。

注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是
(2)反应Ⅰ的产物为(填化学式)
(3)反应Ⅲ的离子方程式为
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是| A.反应中被还原的元素只有氧 |
| B.反应生成的SO2直接排放会污染环境 |
| C.SO2既是氧化产物又是还原产物 |
| D.当有8mol铜生成时,转移电子数目为100NA |
已知:Cr2
 + Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为
②反应Ⅳ所得气体中SO2的体积分数为
您最近一年使用:0次
4 . 某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出如下的问题,探究。请你协助该小组的同学完成下列研究。
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有:CuSO4溶液、____ (填试剂),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器还有红色固体存在。据些可推得,A的化学式为___ 。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
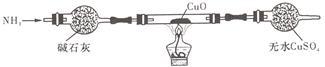
实验中观察到CuO变为红色物质,无水CuSO4变___ 色。同时生成一种对大气无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象应是_____ 。
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是____ 。
【问题讨论】
有同学认为NH3与CuO反应生成的红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质是Cu和A的混合物。
请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A___ 。
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有:CuSO4溶液、
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器还有红色固体存在。据些可推得,A的化学式为
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):

实验中观察到CuO变为红色物质,无水CuSO4变
【实验结论】
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象应是
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是
【问题讨论】
有同学认为NH3与CuO反应生成的红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质是Cu和A的混合物。
请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A
您最近一年使用:0次



