1 . 向CuSO4溶液中滴加氨水至过量,下列叙述正确的是
| A.先出现沉淀,后沉淀溶解变为无色溶液 |
| B.离子方程式为Cu2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 4H2O |
| C.Cu2+与 NH3中的氮原子以π键结合 |
| D.NH3分子中∠HNH为109º28ˊ |
您最近一年使用:0次
2020-10-12更新
|
3813次组卷
|
13卷引用:北京市第一六一中学2021-2022学年高三上学期期中考试化学试题
北京市第一六一中学2021-2022学年高三上学期期中考试化学试题天津市静海区四校2021-2022学年高三上学期12月阶段性检测化学试题福建省厦门市国祺中学2021-2022学年高三上学期第二次月考化学试题2020年海南省高考化学试卷(新高考)福建省厦门集美中学2021-2022学年高二下学期第一次月考化学试题(已下线)2020年海南卷化学高考真题变式题1-8(已下线)第10讲 金属材料及金属矿物的开发利用(练)-2023年高考化学一轮复习讲练测(全国通用)河南省南阳市第六完全学校高级中学2021-2022学年高二下学期4月月考化学试题山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省汕头市2022-2023学年高二下学期7月期末考试化学试题(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第7讲 配合物与超分子
2 . 加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。下图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。
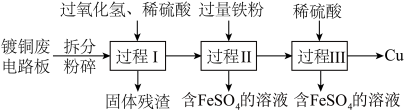
(1)上述流程中,为加快化学反应速率而采取的措施是______ 。
(2)过程Ⅰ中,Cu溶解,过氧化氢的作用是______ 。
(3)过程Ⅱ中,获得Cu的反应的离子方程式为______ 。
(4)过程Ⅲ的目的是______ 。

(1)上述流程中,为加快化学反应速率而采取的措施是
(2)过程Ⅰ中,Cu溶解,过氧化氢的作用是
(3)过程Ⅱ中,获得Cu的反应的离子方程式为
(4)过程Ⅲ的目的是
您最近一年使用:0次
2020-08-04更新
|
305次组卷
|
5卷引用:北京第七中学2020-2021学年高一下学期期中考试化学试题
3 . 实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
已知:Ⅰ.Cu2+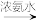 [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
Ⅱ. Cu+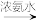 [Cu(NH3)]+(无色溶液)
[Cu(NH3)]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验Ⅰ产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_______ ,反应的离子方程式为_______ 。
(2)对实验Ⅰ产生SO2的原因进行分析,提出假设:
假设a: Cu2+水解使溶液中c(H+)增大;
假设b: Cl-存在时,Cu2+与HSO3-反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是_______ ;
②实验表明假设b合理,实验I反应的离子方程式有_____ 、H++ HSO3-= SO2↑+H2O。
(3)对比实验Ⅰ、Ⅱ,提出假设:Cl-增强了Cu2+的氧化性。
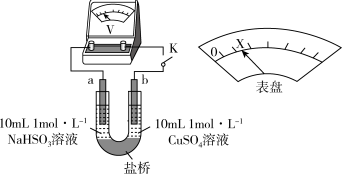
下述实验Ⅲ证实了假设合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_______ (补全实验操作及现象)。
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO32−。
①通过实验Ⅳ证实红色沉淀中含有Cu+和Cu2+。
实验Ⅳ: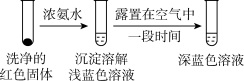
证实红色沉淀中含有Cu+的实验证据是_______ ;
②有同学认为实验Ⅳ不足以证实红色沉淀中含有Cu2+,设计实验Ⅳ的对比实验Ⅴ,证实了Cu2+的存在。实验Ⅴ的方案和现象是:_______ 。
| 实验 | 装置 | 试剂x | 操作及现象 |
| Ⅰ | 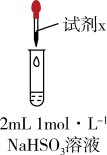 | 1 mol·L−1CuCl2溶液 | 加入2mL CuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
| Ⅱ | 1 mol·L−1CuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
 [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)Ⅱ. Cu+
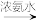 [Cu(NH3)]+(无色溶液)
[Cu(NH3)]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)(1)推测实验Ⅰ产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到
(2)对实验Ⅰ产生SO2的原因进行分析,提出假设:
假设a: Cu2+水解使溶液中c(H+)增大;
假设b: Cl-存在时,Cu2+与HSO3-反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是
②实验表明假设b合理,实验I反应的离子方程式有
(3)对比实验Ⅰ、Ⅱ,提出假设:Cl-增强了Cu2+的氧化性。
下述实验Ⅲ证实了假设合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管

(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO32−。
①通过实验Ⅳ证实红色沉淀中含有Cu+和Cu2+。
实验Ⅳ:

证实红色沉淀中含有Cu+的实验证据是
②有同学认为实验Ⅳ不足以证实红色沉淀中含有Cu2+,设计实验Ⅳ的对比实验Ⅴ,证实了Cu2+的存在。实验Ⅴ的方案和现象是:
您最近一年使用:0次
2020-01-13更新
|
291次组卷
|
4卷引用:北京市第三十五中学2021-2022学年高三上学期期中考试化学试题
4 . 硫酸铜是一种重要的化工产品。某工厂用刻蚀印刷电路板产生的碱性废液[含较多[Cu(NH3)4]2+及少量Cu2+、NH4+、NH3和Cl-]制备硫酸铜晶体,流程如下:
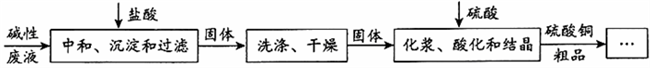
(1)通过“中和、沉淀和过滤”可得碱式氯化铜[Cu(OH)Cl]固体,请将生成该固体的反
应的离子方程式补充完整:[Cu(NH3)4]2+ +________________ 。
(2)制备Cu(OH)Cl沉淀时,溶液的pH对铜元素含量的影响如右图所示:
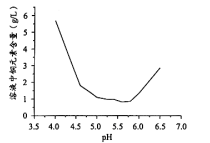
①若要提高Cu(OH)Cl沉淀的量,应将溶液的pH控制在_______ (填字母序号)。
A. <5.2 B. 5.2~5.8 C. >5.8
②pH< 5.2 时,随pH减小,溶液中铜元素含量增大,其原因用反应的离子方程式可表示为______ 。
(3) “化浆、酸化"过程可得到硫酸铜粗品,发生的反应为Cu(OH)Cl+ 4H2O+ H2SO4= CuSO4·5H2O+ HCl。则硫酸铜粗品中,含铜元素的杂质为__________ ,检验样品中含有该杂质的方法是:取少量硫酸铜粗品,加入适量水使其充分溶解,__________ 。
(4)硫酸铜粗品还需要通过重结晶法进行提纯,具体操作是:将粗晶体溶解于热水中形成饱和溶液,然后加入适量乙醇,搅拌,冷却,过滤并洗涤,得到高纯度的硫酸铜晶体。加入乙醇能够提高硫酸铜的产率,从溶解性角度解释其可能的原因是______________ 。

(1)通过“中和、沉淀和过滤”可得碱式氯化铜[Cu(OH)Cl]固体,请将生成该固体的反
应的离子方程式补充完整:[Cu(NH3)4]2+ +
(2)制备Cu(OH)Cl沉淀时,溶液的pH对铜元素含量的影响如右图所示:

①若要提高Cu(OH)Cl沉淀的量,应将溶液的pH控制在
A. <5.2 B. 5.2~5.8 C. >5.8
②pH< 5.2 时,随pH减小,溶液中铜元素含量增大,其原因用反应的离子方程式可表示为
(3) “化浆、酸化"过程可得到硫酸铜粗品,发生的反应为Cu(OH)Cl+ 4H2O+ H2SO4= CuSO4·5H2O+ HCl。则硫酸铜粗品中,含铜元素的杂质为
(4)硫酸铜粗品还需要通过重结晶法进行提纯,具体操作是:将粗晶体溶解于热水中形成饱和溶液,然后加入适量乙醇,搅拌,冷却,过滤并洗涤,得到高纯度的硫酸铜晶体。加入乙醇能够提高硫酸铜的产率,从溶解性角度解释其可能的原因是
您最近一年使用:0次
2017-11-10更新
|
315次组卷
|
4卷引用:北京市中国农业大学附属中学2021-2022学年高三上学期开学考试化学试题



