名校
1 . FeCl3是中学常见的试剂,某实验小组用以下装置制备FeCl3固体,并探究FeCl3溶液与Cu的反应。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备___________ 。
(2)F的名称为___________ ,从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a-
,正确的接口顺序为a-___________ (可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可重复使用)。
(3)写出装置D中制备 的离子方程式
的离子方程式___________ 。
Ⅱ.探究FeCl3溶液与Cu的反应
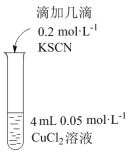
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想___________ (填“1”或“2”)不合理。
(5)根据实验2中的现象进一步查阅资料发现:
i. 与
与 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色);
(淡黄色);
反应B: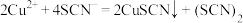 (黄色)。
(黄色)。
ii. 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A___________ (填“>”或“<”)B,说明反应B___________ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式___________ 。
(6)若向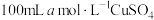 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量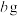 ,则
,则 的产率为
的产率为___________ (写出表达式即可)。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备
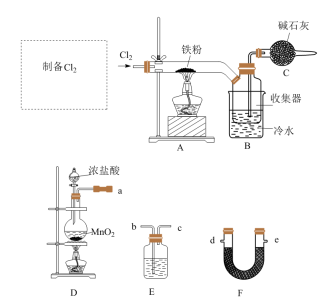
(2)F的名称为
 ,正确的接口顺序为a-
,正确的接口顺序为a-(3)写出装置D中制备
 的离子方程式
的离子方程式Ⅱ.探究FeCl3溶液与Cu的反应
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |
| 加入铜粉后无现象 |
| 实验2 |
| 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后, 溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验2中的现象进一步查阅资料发现:
i.
 与
与 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色);
(淡黄色);反应B:
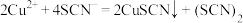 (黄色)。
(黄色)。ii.
 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式(6)若向
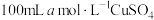 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量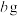 ,则
,则 的产率为
的产率为
您最近一年使用:0次
2023-03-10更新
|
1014次组卷
|
3卷引用:福建省漳州市2023届高三毕业班下学期第三次质量检测化学试卷
2023高三·全国·专题练习
2 . 某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
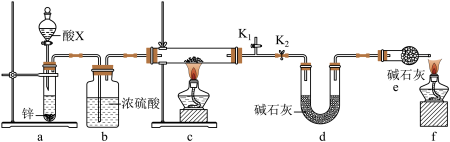
(1)装置a中所加的酸X是___________ (填化学式)。
(2)通过测定下列物理量,能达到实验目的的是___________(填字母)。
(3)熄灭酒精灯之后,仍需通一段时间H2至硬质玻璃管冷却,原因是___________ 。

(1)装置a中所加的酸X是
(2)通过测定下列物理量,能达到实验目的的是___________(填字母)。
| A.反应前后装置a的质量 |
| B.充分反应后装置c所得固体的质量 |
| C.反应前后装置d的质量 |
| D.反应前后装置e的质量 |
(3)熄灭酒精灯之后,仍需通一段时间H2至硬质玻璃管冷却,原因是
您最近一年使用:0次
3 . 某中学同学在做铜与浓硫酸(装置如图)的反应实验时,发现有如下的反应现象:加热初期,铜丝表面变黑;继续加热,有大量气泡产生,品红溶液褪色,溶液变为墨绿色浊液,试管底部开始有灰白色沉淀生成;再加热,试管中出现“白雾”,浊液逐渐变为澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多;冷却,静置,将试管中液体倒入另一支盛水试管中,管壁发汤,溶液略带蓝色,将灰白色固体倒入水中,形成蓝色溶液。

(1)资料:聚四氯乙烯受热分解产生氯化氢,[CuCl4]2-呈黄色,[Cu(H2O)4]2+呈蓝色,两者混合则成绿色,铜的化合物中CuO、CuS、Cu2S都为黑色,其中CuO溶于盐酸;CuS、Cu2S不溶于稀盐酸,但溶于浓盐酸。该反应中,品红溶液褪色,体现SO2的______ 性,NaOH溶液的作用是______ 。
该中学同学分成几个小组分别对上述现象探究:
(2)甲组同学查相关文献资料获知:在较低温度(100℃)下,浓硫酸氧化性相对较弱,生成的黑色沉淀为Cu2S,溶液变蓝,但没有气泡产生。请根据文献资料写出反应的化学方程式:______ 。
(3)乙组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
请解释形成墨绿色的原因:______ 。
(4)丙组同学对白雾的成分经检验为H2SO4,请设计实验证明该白雾为硫酸:______ 。溶液的蓝色变浅,灰白色沉淀增多,这现象体现浓硫酸的______ 性。
(5)丁组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:
滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有______ 。
滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,溶液呈略黄色[CuCln]2-n(n=1~4)。写出CuS与浓盐酸反应的离子方程式:______ 。
最后,丁组同学经过实验论证证明黑色沉淀中除了有CuS、Cu2S,还有S等。

(1)资料:聚四氯乙烯受热分解产生氯化氢,[CuCl4]2-呈黄色,[Cu(H2O)4]2+呈蓝色,两者混合则成绿色,铜的化合物中CuO、CuS、Cu2S都为黑色,其中CuO溶于盐酸;CuS、Cu2S不溶于稀盐酸,但溶于浓盐酸。该反应中,品红溶液褪色,体现SO2的
该中学同学分成几个小组分别对上述现象探究:
(2)甲组同学查相关文献资料获知:在较低温度(100℃)下,浓硫酸氧化性相对较弱,生成的黑色沉淀为Cu2S,溶液变蓝,但没有气泡产生。请根据文献资料写出反应的化学方程式:
(3)乙组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
| 现象 | ||
| I组 | 取灼烧后的铜丝 | 溶液变蓝 |
| Ⅱ组 | 直接取其铜丝(表面有聚四氯乙烯薄膜) | 溶液变成墨绿色 |
(4)丙组同学对白雾的成分经检验为H2SO4,请设计实验证明该白雾为硫酸:
(5)丁组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:
滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有
滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,溶液呈略黄色[CuCln]2-n(n=1~4)。写出CuS与浓盐酸反应的离子方程式:
最后,丁组同学经过实验论证证明黑色沉淀中除了有CuS、Cu2S,还有S等。
您最近一年使用:0次
名校
解题方法
4 . CuCl是常见的有机合成催化剂。某实验小组设想用CuCl2和Na2SO3溶液制备CuCl。
资料:①CuCl为难溶于水和酸的白色固体
②CuI为难溶于水的白色固体
③Cu+在酸性环境中易歧化为Cu和
④
Ⅰ.CuCl的制备
(1)用离子方程式表示CuCl制备的设想依据:___________ 。
(2)Na2SO3溶液易变质,使用前需要标定,配制该Na2SO3溶液所需要的玻璃仪器有:试剂瓶、玻璃棒和___________ 。
【实验一】CuCl的制备
(3)将实验一中的白色沉淀分离后,通过___________ (填字母)证明了白色沉淀为CuCl,且不含其他杂质。
A.X射线衍射实验 B.柱色谱 C.核磁共振氢谱
Ⅱ.橙黄色沉淀的成分探究
(4)实验一中橙黄色沉淀存在时间较短,难以获得。为成功制备该沉淀,可将实验一中的CuCl2溶液替换为等体积等浓度的___________ 。
【实验二】实验小组依据体系中相关物质的性质推测:橙黄色沉淀可能为Cu2SO3、CuSO3,或二者的混合物。为进一步证明该推测,实验小组继续做了下列实验。
(5)实验小组观察到实验a中___________ (填字母),证明了橙黄色沉淀中含有Cu2SO3。
A.反应后溶液呈蓝色 B.有紫红色固体析出
(6)若橙黄色沉淀中含有CuSO3,由于___________ ,实验b中上清液呈无色且不能使淀粉溶液变蓝;若橙黄色沉淀仅有Cu2SO3,现象与实验b相同。因此仅通过实验b不能证明橙黄色沉淀中含CuSO3,但可以通过检验上层清液中某种离子的存在证明橙黄色沉淀中含有CuSO3,其实验方案为:___________ 。
资料:①CuCl为难溶于水和酸的白色固体
②CuI为难溶于水的白色固体
③Cu+在酸性环境中易歧化为Cu和

④

Ⅰ.CuCl的制备
(1)用离子方程式表示CuCl制备的设想依据:
(2)Na2SO3溶液易变质,使用前需要标定,配制该Na2SO3溶液所需要的玻璃仪器有:试剂瓶、玻璃棒和
【实验一】CuCl的制备
| 实验操作 | 实验现象 |
 溶液和 溶液和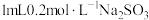 溶液混合 溶液混合 | 立即有橙黄色沉淀生成,3min后沉淀颜色变浅并伴有少量白色沉淀产生,再振荡1min后沉淀全部变为白色。 |
A.X射线衍射实验 B.柱色谱 C.核磁共振氢谱
Ⅱ.橙黄色沉淀的成分探究
(4)实验一中橙黄色沉淀存在时间较短,难以获得。为成功制备该沉淀,可将实验一中的CuCl2溶液替换为等体积等浓度的
【实验二】实验小组依据体系中相关物质的性质推测:橙黄色沉淀可能为Cu2SO3、CuSO3,或二者的混合物。为进一步证明该推测,实验小组继续做了下列实验。
| 实验 | 实验操作 |
| a | 取少量洗净的橙黄色沉淀于试管中,并加入一定量的稀硫酸 |
| b |  注:实验所用试剂均经过除氧处理 |
A.反应后溶液呈蓝色 B.有紫红色固体析出
(6)若橙黄色沉淀中含有CuSO3,由于
您最近一年使用:0次
解题方法
5 . CuCl常用作催化剂、杀菌剂、媒染剂、脱色剂和冶金工业等。实验室用如下装置(夹持仪器略去)将二氧化硫通入新制 悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。
悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。
(1)仪器a的名称是_______ ,装置A中分液漏斗中盛装的试剂为_______ 。
(2)装置B的作用是_______ 。
(3)装置D的作用是_______ ,其中发生反应的离子方程式为_______ 。
(4) 与装置C中生成的
与装置C中生成的 悬浊液反应制备CuCl的离子方程式为
悬浊液反应制备CuCl的离子方程式为_______ 。
(5)装置C中 溶液的体积为20mL,滴入足量NaOH溶液后再通入
溶液的体积为20mL,滴入足量NaOH溶液后再通入 ,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。
,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。
①先用水洗再用乙醇洗涤的目的是_______ 。
②该实验所得CuCl的产率为_______ %。
 悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。
悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。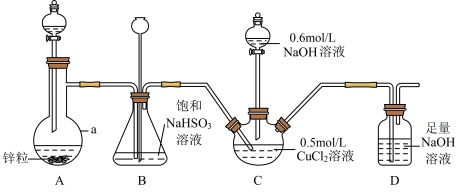
(1)仪器a的名称是
(2)装置B的作用是
(3)装置D的作用是
(4)
 与装置C中生成的
与装置C中生成的 悬浊液反应制备CuCl的离子方程式为
悬浊液反应制备CuCl的离子方程式为(5)装置C中
 溶液的体积为20mL,滴入足量NaOH溶液后再通入
溶液的体积为20mL,滴入足量NaOH溶液后再通入 ,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。
,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。①先用水洗再用乙醇洗涤的目的是
②该实验所得CuCl的产率为
您最近一年使用:0次
6 . 介孔 纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%
纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2% 、32%
、32% ,其余为
,其余为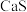 和
和 )为原料开发的一种合成介孔
)为原料开发的一种合成介孔 的路线如图所出示。回答下列问题:
的路线如图所出示。回答下列问题:
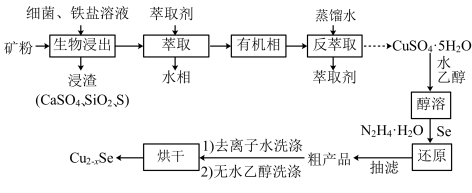
(1)基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为___________ 。
(2)“生物浸出”时, 与铁盐溶液反应的离子方程式为
与铁盐溶液反应的离子方程式为___________ 。此时铁盐___________ (填“作氧化剂”、“作还原剂”或“既不是氧化剂,也不是还原剂”)。
(3)将“浸渣”溶于 ,再过滤、蒸馏,可从“浸渣”中分离出
,再过滤、蒸馏,可从“浸渣”中分离出___________ (填化学式)。
(4)实验室“萃取”时,用到的主要仪器是___________ ,若萃取剂为苯,“萃取”后得到的“水相”位于___________ (填“上层”或“下层”)。
(5)利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是___________ 。
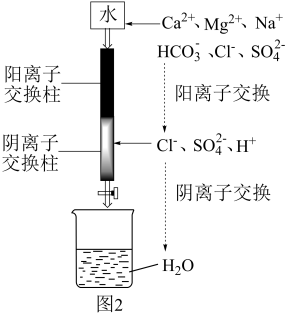
(6)利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为___________ 。
(7)某工厂用10吨该矿石合成介孔 ,已知整个流程中
,已知整个流程中 的损耗率为10%,
的损耗率为10%,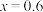 ,则最终可以得到
,则最终可以得到
___________ 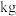 。
。
 纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%
纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2% 、32%
、32% ,其余为
,其余为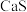 和
和 )为原料开发的一种合成介孔
)为原料开发的一种合成介孔 的路线如图所出示。回答下列问题:
的路线如图所出示。回答下列问题:
(1)基态
 原子价电子的轨道表示式为
原子价电子的轨道表示式为(2)“生物浸出”时,
 与铁盐溶液反应的离子方程式为
与铁盐溶液反应的离子方程式为(3)将“浸渣”溶于
 ,再过滤、蒸馏,可从“浸渣”中分离出
,再过滤、蒸馏,可从“浸渣”中分离出(4)实验室“萃取”时,用到的主要仪器是
(5)利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是

(6)利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为

(7)某工厂用10吨该矿石合成介孔
 ,已知整个流程中
,已知整个流程中 的损耗率为10%,
的损耗率为10%,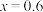 ,则最终可以得到
,则最终可以得到
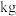 。
。
您最近一年使用:0次
22-23高三上·云南昆明·开学考试
名校
解题方法
7 . 碱式碳酸铜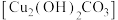 是孔雀石的主要成分,呈暗绿色或淡蓝绿色,难溶于水。某研究性学习小组制定了如下实验来探究制备碱式碳酸铜的最佳配比:将浓度均为
是孔雀石的主要成分,呈暗绿色或淡蓝绿色,难溶于水。某研究性学习小组制定了如下实验来探究制备碱式碳酸铜的最佳配比:将浓度均为 的
的 、
、 溶液混合,磁力搅拌30分钟后置于75℃恒温装置中反应75分钟,冷却至室温后抽滤、洗涤、干燥、称重。实验数据如下表所示。
溶液混合,磁力搅拌30分钟后置于75℃恒温装置中反应75分钟,冷却至室温后抽滤、洗涤、干燥、称重。实验数据如下表所示。
回答下列问题:
(1)本实验中,制备碱式碳酸铜的离子方程式为___________ 。
(2)实现恒温75℃加热可采取的方式为___________ 。
(3)实验过程中,需对碱式碳酸铜沉淀进行抽滤(减压过滤),装置如图甲,抽滤的主要优点是___________ ;检验滤渣是否洗涤干净的实验操作是___________ 。

(4)由以上实验数据判断,生成碱式碳酸铜的反应中, 的最佳比例为
的最佳比例为___________ ;在该比例下,碱式碳酸铜的产率为___________ (保留2位有效数字)。
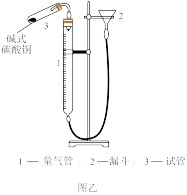
(5)取mg制得的碱式碳酸铜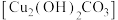 样品,在如图乙装置中加热分解(加热装置已省略),量气管及导管内盛装的试剂为
样品,在如图乙装置中加热分解(加热装置已省略),量气管及导管内盛装的试剂为___________ ,若收集到气体体积为VL(已折算成标准状况下),则样品中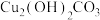 的纯度为
的纯度为___________ %(用含m、V的式子表示)。
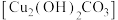 是孔雀石的主要成分,呈暗绿色或淡蓝绿色,难溶于水。某研究性学习小组制定了如下实验来探究制备碱式碳酸铜的最佳配比:将浓度均为
是孔雀石的主要成分,呈暗绿色或淡蓝绿色,难溶于水。某研究性学习小组制定了如下实验来探究制备碱式碳酸铜的最佳配比:将浓度均为 的
的 、
、 溶液混合,磁力搅拌30分钟后置于75℃恒温装置中反应75分钟,冷却至室温后抽滤、洗涤、干燥、称重。实验数据如下表所示。
溶液混合,磁力搅拌30分钟后置于75℃恒温装置中反应75分钟,冷却至室温后抽滤、洗涤、干燥、称重。实验数据如下表所示。| 实验编号 | I | II | III | IV | V |
 体积/mL 体积/mL | 30 | 30 | 30 | 30 | 30 |
 体积/mL 体积/mL | 24 | 30 | 36 | 42 | 48 |
| 产物成分 | 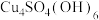 | 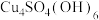 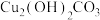 | 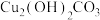 | 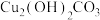 | 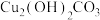 |
| 产物质量/g | 1.4725 | 1.5218 | 1.5473 | 1.5357 | 1.5315 |
(1)本实验中,制备碱式碳酸铜的离子方程式为
(2)实现恒温75℃加热可采取的方式为
(3)实验过程中,需对碱式碳酸铜沉淀进行抽滤(减压过滤),装置如图甲,抽滤的主要优点是

(4)由以上实验数据判断,生成碱式碳酸铜的反应中,
 的最佳比例为
的最佳比例为(5)取mg制得的碱式碳酸铜
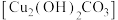 样品,在如图乙装置中加热分解(加热装置已省略),量气管及导管内盛装的试剂为
样品,在如图乙装置中加热分解(加热装置已省略),量气管及导管内盛装的试剂为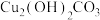 的纯度为
的纯度为
您最近一年使用:0次
2022-08-21更新
|
531次组卷
|
3卷引用:云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题
(已下线)云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题云南省昆明市第一中学2022-2023学年高三上学期第一次摸底测试化学试题