10-11高一上·浙江绍兴·期中
1 . 取一定量的CuO粉末与0.5 L稀硫酸充分反应后,将一根50 g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24 g, 并收集到224 mL气体(标准状况)。求此CuO粉末的质量____ 。
您最近一年使用:0次
名校
解题方法
2 . 向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。
(1)Cu和Cu2O的混合物中铜的物质的量为________ mol
(2)产生的NO在标准状况下的体积为______ L
(3)硝酸的物质的量浓度为_____________ mol/L
(4)Cu、Cu2O与硝酸反应后剩余HNO3为______ mol
(1)Cu和Cu2O的混合物中铜的物质的量为
(2)产生的NO在标准状况下的体积为
(3)硝酸的物质的量浓度为
(4)Cu、Cu2O与硝酸反应后剩余HNO3为
您最近一年使用:0次
2020-05-12更新
|
1025次组卷
|
3卷引用:上海市同济大学第一附属中学2023-2024学年高二上学期10月月考化学试题
10-11高三上·上海金山·期末
3 . 甲、乙两个研究小组,用以下两种方法由Cu粉制Cu(NO3)2溶液。
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗O2的物质的量是_________________ ,消耗HNO3的物质的量是_______ 。
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L (不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是________________ mol。
(i)为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,计算消耗O2的物质的量;____________ 。
(ii)若将生成的气体通入NaOH溶液中,气体被完全吸收,产物只有NaNO3、NaNO2和H2O,计算生成NaNO2的物质的量_____________ 。
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗O2的物质的量是
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L (不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是
(i)为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,计算消耗O2的物质的量;
(ii)若将生成的气体通入NaOH溶液中,气体被完全吸收,产物只有NaNO3、NaNO2和H2O,计算生成NaNO2的物质的量
您最近一年使用:0次
2011·上海虹口·一模
4 . 将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL9mol/L的硝酸中,充分反应后,固体全部溶解,硝酸只被还原成NO2和NO(假设生成气体全部逸出),反应后溶液中H+为0.16mol(不考虑Cu2+的水解)。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
(1)铜片中单质铜的质量分数___ (保留2位小数)。
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度___ (假设反应前溶液的体积不变)。
(3)生成NO2和NO气体的体积比___ 。
(4)已知2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O。现将反应后生成的气体用过量NaOH溶液吸收,为使氮氧化物充分吸收,还需通入一定量氧气。
①最少应通入氧气的体积___ (标准状况)。
②参加反应的NaOH的物质的量。___
(1)铜片中单质铜的质量分数
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度
(3)生成NO2和NO气体的体积比
(4)已知2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O。现将反应后生成的气体用过量NaOH溶液吸收,为使氮氧化物充分吸收,还需通入一定量氧气。
①最少应通入氧气的体积
②参加反应的NaOH的物质的量。
您最近一年使用:0次
10-11高三上·上海徐汇·期末
5 . 若氢气还原氧化铜的反应进行得不完全,便得到 Cu、Cu2O、CuO的固体混合物。某化学兴趣小组同学为测定上述固体的组成进行如下操作: 取一定质量的均匀固体混合物A,将其分成两等分,取其中一份用足量氢气还原,测得反应后的固体质量减少3.20g ,另一份加入500mL的稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L 。
请根据以上操作计算:
(1)A中,n(Cu)+n(Cu2O)=_______ ;
(2)A中,n(CuO)的取值范围是____________ ;
(3)试计算所用硝酸的物质的量浓度_______ 。
请根据以上操作计算:
(1)A中,n(Cu)+n(Cu2O)=
(2)A中,n(CuO)的取值范围是
(3)试计算所用硝酸的物质的量浓度
您最近一年使用:0次
10-11高三上·上海普陀·期末
6 . 氢气还原氧化铜得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生反应,生成Cu2+和单质铜。
(1)现有8g氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是________________ ;
(2)若将6.8g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体________ g;
(3)若将6.8g上述混合物与足量的浓硝酸充分反应,把得到的溶液小心蒸发浓缩,把析出的晶体过滤,低温干燥,得晶体19.36g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式__________ (要求:写出本小题的计算过程)。
(1)现有8g氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是
(2)若将6.8g上述混合物与足量的稀硫酸充分反应后过滤,可得到固体
(3)若将6.8g上述混合物与足量的浓硝酸充分反应,把得到的溶液小心蒸发浓缩,把析出的晶体过滤,低温干燥,得晶体19.36g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式
您最近一年使用:0次
2010·上海·二模
解题方法
7 . 将Cu与CuO的混合物22.4g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得c(Cu2+)=0.3mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积___ (不考虑气体在溶液中的溶解)。
(2)溶液稀释后,c(H+)是多少___ ?
(1)反应过程中放出的气体在标准状况下的体积
(2)溶液稀释后,c(H+)是多少
您最近一年使用:0次
12-13高三上·上海松江·期中
名校
解题方法
8 . 取一定质量的Fe、Cu混合物的粉末平均分成四等份,分别向其中逐渐加入不同体积但同浓度的稀硝酸,实验中收集到的NO气体的体积及剩余固体的质量均记录在下表中(气体体积均在标准状况下测定)。
(1)写出实验①中化学反应的方程式_______________________________________
(2)计算稀硝酸的物质的量浓度是___________ ;
(3)每份混合物中含铁的质量是__________ 克、铜的质量是__________ 克;
(4)计算上表中实验③所用稀硝酸的体积和实验③、④产生气体的体积___________ 。
实验序号 | ① | ② | ③ | ④ |
稀硝酸体积 | 100mL | 200mL | 400mL | |
剩余固体质量 | 15.72g | 6.72g | 固体刚好全部溶解 | 0 |
气体体积 | 2.24L | 4.48L |
(1)写出实验①中化学反应的方程式
(2)计算稀硝酸的物质的量浓度是
(3)每份混合物中含铁的质量是
(4)计算上表中实验③所用稀硝酸的体积和实验③、④产生气体的体积
您最近一年使用:0次
12-13高三上·上海·阶段练习
解题方法
9 . 硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等。硝酸盐多用于焰火、试剂、图象处理行业。
(1)某金属M的硝酸盐受热时按下式分解:2MNO3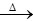 2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为__ 。
(2)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L,其中NO的体积为__ 。
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(S.T.P.)。则产物中硝酸铜的物质的量为___ 。如果原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为__ 。
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,HNO3被还原成NO,待反应结束后,标准状况下产生的气体___ 升。
(5)加热某一硝酸铜的结晶水合物和硝酸银的混合物110.2g,使之完全分解,得到固体残渣48.4g。将反应后产生的气体通过水充分吸收后,剩余气体1.68L(S.T.P.),判断剩余气体是__ (填化学式);原混合物中硝酸铜结晶水合物的化学式为__ 。
(1)某金属M的硝酸盐受热时按下式分解:2MNO3
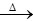 2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为(2)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L,其中NO的体积为
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(S.T.P.)。则产物中硝酸铜的物质的量为
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,HNO3被还原成NO,待反应结束后,标准状况下产生的气体
(5)加热某一硝酸铜的结晶水合物和硝酸银的混合物110.2g,使之完全分解,得到固体残渣48.4g。将反应后产生的气体通过水充分吸收后,剩余气体1.68L(S.T.P.),判断剩余气体是
您最近一年使用:0次
10 . 硝酸是重要的氧化剂,铁、铜是生活中常见的金属.
(1)Fe与Cu混合物与65%的硝酸反应会产生大量NO2,该反应使用的硝酸的物质的量浓度为______ mol/L(已知ρ=1.4g/cm3).
(2)各为0.1mol的Cu与Fe混合物与足量的某浓度的硝酸反应产生4.48L气体(标准状况下),则该反应消耗的硝酸为______ mol.
(3)4.4gFe与Cu混合物与过量的硝酸反应,放出的气体与标准状况下的1.12L的氧气混合后通入水中恰好被完全吸收,则其中铜的质量为______ g.
(4)Fe与Cu混合物共有a mol,其中铜的物质的量分数为X,将该混合物全部投入b mol的硝酸中使其充分反应,假定硝酸的还原产物仅有NO,
①若溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是______ (用a、x表示).
②若x=0.2时,溶液Fe2+与Fe3+的物质的量相等时,在标准状况下产生NO 6.72L,求a、b的值.(写出简要的计算过程)___________
(1)Fe与Cu混合物与65%的硝酸反应会产生大量NO2,该反应使用的硝酸的物质的量浓度为
(2)各为0.1mol的Cu与Fe混合物与足量的某浓度的硝酸反应产生4.48L气体(标准状况下),则该反应消耗的硝酸为
(3)4.4gFe与Cu混合物与过量的硝酸反应,放出的气体与标准状况下的1.12L的氧气混合后通入水中恰好被完全吸收,则其中铜的质量为
(4)Fe与Cu混合物共有a mol,其中铜的物质的量分数为X,将该混合物全部投入b mol的硝酸中使其充分反应,假定硝酸的还原产物仅有NO,
①若溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是
②若x=0.2时,溶液Fe2+与Fe3+的物质的量相等时,在标准状况下产生NO 6.72L,求a、b的值.(写出简要的计算过程)
您最近一年使用:0次



