1 . 水煤合成气的生产和应用在化学工业中有极为重要的地位。回答下列问题:
(1)利用合成气(主要成分CO、CO2和H2)在催化剂作用下合成甲醇,可能发生的反应有:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-63 kJ•mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
③CH3OH(g)=CO(g)+2H2(g) ΔH3
已知部分化学键键能数据如下表:
则ΔH3=_______ kJ•mol-1。
(2)CO2和CH4在一定条件下反应也可制得合成水煤气。在1.0 L密闭容器中充入1.0 mol CH4和1.0 mol CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
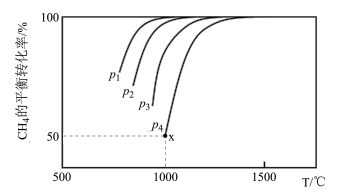
①比较压强大小:p1_______ p3(选填“>”、“<”或“=”)。
②若要提高CH4的平衡转化率,可采取的措施有_______ ,_______ 。(任写两条)
③若p4=2.0 MPa,则x点的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)化学家利用电化学原理回收CO2达到节能减排的目的,有一种实验设计的装置如下图所示。
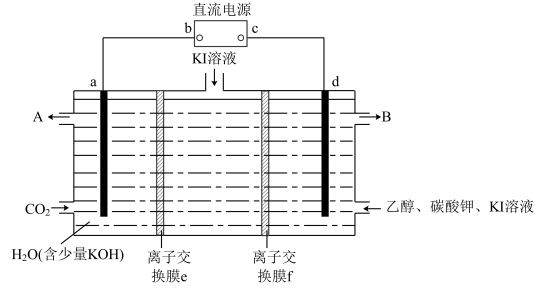
已知在碱性条件下,卤素单质可以将乙醇氧化为乙醛。实验一段时间后,测得a电极周围有甲酸根离子HCOO-生成。回答:
①电极b为_______ 极;
②电解时a电极附近溶液的pH_______ (选填“降低”、“升高”、“不变”);
③e为_______ 交换膜;
④d电极周围除了发生电极反应外,还有_______ (用离子方程式表示)。
(1)利用合成气(主要成分CO、CO2和H2)在催化剂作用下合成甲醇,可能发生的反应有:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-63 kJ•mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
③CH3OH(g)=CO(g)+2H2(g) ΔH3
已知部分化学键键能数据如下表:
| 化学键 | H-H | C=O | C≡O | O-H |
| 键能(kJ•mol-1) | 436 | 803 | 1076 | 465 |
(2)CO2和CH4在一定条件下反应也可制得合成水煤气。在1.0 L密闭容器中充入1.0 mol CH4和1.0 mol CO2,在一定条件下发生反应CH4(g)+CO2(g)
 2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
①比较压强大小:p1
②若要提高CH4的平衡转化率,可采取的措施有
③若p4=2.0 MPa,则x点的平衡常数Kp=
(3)化学家利用电化学原理回收CO2达到节能减排的目的,有一种实验设计的装置如下图所示。

已知在碱性条件下,卤素单质可以将乙醇氧化为乙醛。实验一段时间后,测得a电极周围有甲酸根离子HCOO-生成。回答:
①电极b为
②电解时a电极附近溶液的pH
③e为
④d电极周围除了发生电极反应外,还有
您最近一年使用:0次
2022-11-05更新
|
141次组卷
|
2卷引用:海南省海口中学2023-2024学年高二上学期12月月考化学试题
名校
2 . 氮肥厂的废水中氮元素以NH3∙H2O、NH3和 的形式存在,对氨氮废水无害化处理已成为全球科学研究热点,下面是电化学氧化法除氨氮的方法。研究表明,以碳材料为阴极,O2可在阴极生成H2O2,并进一步生成氧化性更强的·OH,·OH可以将水中氨氮氧化为N2.阴极区加入Fe2+可进一步提高氨氮的去除率,原理如下图所示结合如图解释。则下列说法不正确的是
的形式存在,对氨氮废水无害化处理已成为全球科学研究热点,下面是电化学氧化法除氨氮的方法。研究表明,以碳材料为阴极,O2可在阴极生成H2O2,并进一步生成氧化性更强的·OH,·OH可以将水中氨氮氧化为N2.阴极区加入Fe2+可进一步提高氨氮的去除率,原理如下图所示结合如图解释。则下列说法不正确的是
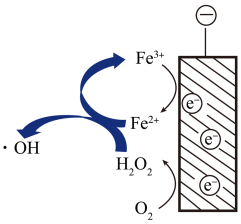
 的形式存在,对氨氮废水无害化处理已成为全球科学研究热点,下面是电化学氧化法除氨氮的方法。研究表明,以碳材料为阴极,O2可在阴极生成H2O2,并进一步生成氧化性更强的·OH,·OH可以将水中氨氮氧化为N2.阴极区加入Fe2+可进一步提高氨氮的去除率,原理如下图所示结合如图解释。则下列说法不正确的是
的形式存在,对氨氮废水无害化处理已成为全球科学研究热点,下面是电化学氧化法除氨氮的方法。研究表明,以碳材料为阴极,O2可在阴极生成H2O2,并进一步生成氧化性更强的·OH,·OH可以将水中氨氮氧化为N2.阴极区加入Fe2+可进一步提高氨氮的去除率,原理如下图所示结合如图解释。则下列说法不正确的是
A.·OH的电子式为: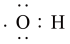 |
| B.写出·OH去除氨气的化学反应方程式为:6·OH+2NH3=N2+6H2O |
| C.O2在阴极生成H2O2的电极反应式为:O2+2e-+2H+=H2O2 |
| D.阴极区加入Fe2+可进一步提高氨氮的去除率的原因是生成的Fe3+起催化剂作用 |
您最近一年使用:0次
2021-06-04更新
|
639次组卷
|
4卷引用:海南省海南中学2023- 2024学年高三上学期第4次月考化学试题
名校
解题方法
3 . I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g) HCHO(g)+H2(g) △H1=+85.2kJ/mol
HCHO(g)+H2(g) △H1=+85.2kJ/mol
反应II:CH3OH(g)+ O2(g)⇌HCHO(g)+H2O(g) △H2
O2(g)⇌HCHO(g)+H2O(g) △H2
反应III:2H2(g)+O2(g)⇌2H2O(g) △H3=-483.6kJ/mol
(1)计算反应Ⅱ的反应热△H2=_____________________________ 。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)⇌HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________ (用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
II.CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定条件下,按不同的投料比X[X=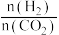 ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
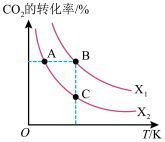
①X1_____ X2(填“>”或“<”,后同),Q_____ 0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____ 。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____ [常温下K1(H2CO3)=4.4×10﹣7、K2(H2CO3)=5×10﹣11]。
②欲用5L Na2CO3溶液将23.3g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________ 。[已知:常温下Ksp(BaSO4)=1×10﹣7、Ksp(BaCO3)=2.5×10﹣6]。(忽略溶液体积积的变化)
反应I:CH3OH(g)
 HCHO(g)+H2(g) △H1=+85.2kJ/mol
HCHO(g)+H2(g) △H1=+85.2kJ/mol反应II:CH3OH(g)+
 O2(g)⇌HCHO(g)+H2O(g) △H2
O2(g)⇌HCHO(g)+H2O(g) △H2反应III:2H2(g)+O2(g)⇌2H2O(g) △H3=-483.6kJ/mol
(1)计算反应Ⅱ的反应热△H2=
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)⇌HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=
II.CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定条件下,按不同的投料比X[X=
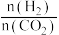 ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
①X1
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=
②欲用5L Na2CO3溶液将23.3g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
您最近一年使用:0次
2019-03-14更新
|
741次组卷
|
5卷引用:海南省琼海市嘉积第三中学2021-2022学年高三下学期第三次月考化学科试题
海南省琼海市嘉积第三中学2021-2022学年高三下学期第三次月考化学科试题 山东省济南市大学城实验高级中学2021届高三1月阶段性考试化学试题【校级联考】江西省重点中学盟校2019届高三上学期第一次联考化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(三)云南民族大学附属中学2019-2020学年高二下学期期中考试化学试题
名校
解题方法
4 . 碳及其化合物与人类的生活、生产紧密联系。
(1)已知2g甲烷完全燃烧生成稳定的氧化物时放出Q kJ的热量,写出表示甲烷燃烧热的热化学方程式:___________
(2)已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130 kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1。断开1 mol H—H键、O===O键分别需要吸收436 kJ、496 kJ的热量,则断开1 mol O—H键需要吸收的热量为___________
A.332 kJ B.462 kJ C.118 kJ D.360 kJ
(3)以CO2和H2O为原料制备HCOOH和O2的原电池原理如图.

电极a为_____ (填“正”或“负”)极,电极b发生的电极反应式是:___________________ .
(1)已知2g甲烷完全燃烧生成稳定的氧化物时放出Q kJ的热量,写出表示甲烷燃烧热的热化学方程式:
(2)已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130 kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1。断开1 mol H—H键、O===O键分别需要吸收436 kJ、496 kJ的热量,则断开1 mol O—H键需要吸收的热量为
A.332 kJ B.462 kJ C.118 kJ D.360 kJ
(3)以CO2和H2O为原料制备HCOOH和O2的原电池原理如图.

电极a为
您最近一年使用:0次
名校
解题方法
5 . 臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是____ 和____ (填分子式)。
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=_______________ kJ·mol–1
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是____ 。
②在30 ℃、pH=4.0条件下,O3的分解速率为_____ mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为_____ (填字母)。
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。

①图中阴极为____ (填“A”或“B”),其电极反应式为_________________________ 。
②若C处通入O2,则A极的电极反应式为_________ ,右室pH变化___________ (填升高、降低、不变)
(1)O3与KI溶液反应生成的两种单质是
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
| pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是
②在30 ℃、pH=4.0条件下,O3的分解速率为
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。

①图中阴极为
②若C处通入O2,则A极的电极反应式为
您最近一年使用:0次



