名校
解题方法
1 . 研究发现Pd2团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法的不正确的是
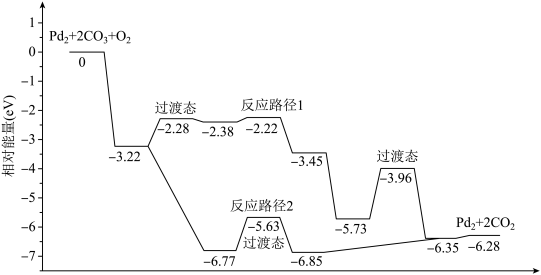

| A.该过程中有极性键和非极性键的断裂和生成 |
| B.反应路径2的催化效果更好 |
| C.催化剂不会改变整个反应的ΔH |
| D.路径1中最大能垒(活化能)E正=1.23eV |
您最近一年使用:0次
2020-12-08更新
|
1113次组卷
|
7卷引用:专题07 反应机理-备战2022年高考化学真题及地市好题专项集训【山东专用】
2 . 据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是


| A.OH-参与了该催化循环 | B.该反应可产生清洁燃料H2 |
| C.该反应可消耗温室气体CO2 | D.该催化循环中Fe的成键数目发生变化 |
您最近一年使用:0次
2020-07-08更新
|
13759次组卷
|
60卷引用:专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编
(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编(已下线)第八单元 化学反应与能量测试题-2021年高考化学一轮复习名师精讲练山东省泰安市宁阳一中2021届高三上学期模块考试化学试题(已下线)热点7 新信息反应机理分析-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)押山东卷第13题 陌生反应机理选择题-备战2021年高考化学临考题号押题(山东卷)2020年全国统一考试化学试题(新课标Ⅱ)黑龙江省大庆实验中学2021届高三8月开学考试化学试题北京二中2020-2021学年高二上学期10月月考化学试题北京首都师范大学附属中学2020-2021学年高二上学期期中考试化学试题广东省惠州市惠州中学2021届高三12月月考化学试题(已下线)热点10 新信息反应机理分析-2021年高考化学专练【热点·重点·难点】(已下线)专题10 化学平衡(速率、影响因素、图像、标志、平衡压强及常数)-2021年高考化学必做热点专题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)(已下线)课时27 微粒间作用力-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)2020年全国卷Ⅱ化学真题变式题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)秘籍08 反应历程探究与催化原理图象分析-备战2022年高考化学抢分秘籍(全国通用)(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏加德罗常数-备战2022年高考化学临考题号押题(全国卷)(已下线)查补易混易错点01 物质的组成、性质、分类及化学用语-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)回归教材重难点05 化学反应中的能量变化-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题07化学反应中的能量变化及反应机理-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题07化学反应中的能量变化及反应机理-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第18讲 化学反应速率(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻3 化学反应历程图像分析(已下线)专题10 物质的反应及转化北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题黑龙江省大庆市实验中学实验一部2020-2021学年高一下学期4月阶段性教学质量检测化学试题安徽省阜阳市2020-2021学年高二下学期段考化学试题山西省长治市第二中学校2020-2021学年高二下学期期中考试化学试题广西桂林市第十八中学2020-2021学年高一下学期期中考试化学试题江西省景德镇一中2020-2021学年高二下学期期末考试化学(2班)试题吉林省延边第二中学2020-2021学年高二下学期第二次考试月考化学试题甘肃省兰州市第二十七中学2020-2021学年高二下学期期末考试化学试题陕西省瑞泉中学2021-2022学年高三上学期第一次质量检测化学试题新疆生产建设兵团第九师龙珍高级中学2021-2022学年高三上学期第一次月考化学试题辽宁省大连市第一中学2021-2022学年高二上学期阶段性学情反馈(二)化学试题云南省峨山彝族自治县第一中学2021-2022学年高二上学期期中考试化学试题湖北省华中师范大学第一附属中学2020-2021学年高一下学期期末考试化学试题江苏省天一中学2021-2022学年高一上学期期末考试化学(强化班)试题福建省南安市侨光中学、昌财实验中学2021-2022学年高二下学期第4次联考(期中)化学试题浙江省宁波市2021-2022学年高二下学期九校联考化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三9月月考化学试题辽宁省锦州市锦州中学2023届高三上学期9月月考化学试题云南省临沧市民族中学2022-2023学年高二上学期第二次月考化学试题广东省广州天省实验学校2021-2022学年高二下学期6月月考化学试题黑龙江省双鸭山市饶河县高级中学2021-2022学年高二下学期期中考试化学试题新疆乌鲁木齐市第七十中学2022-2023学年高二上学期期中考试化学试题辽宁省兴城市高级中学2022-2023学年高二上学期期末线上质量检测化学试题江苏省南通市海安高级中学2022-2023学年高一下学期第一次月考化学试题广东省梅州市兴宁市齐昌中学2022-2023学年高三上学期第二次质检考试化学试题北京市中国人民大学附属中学2023-2024学年高三上学期11月统练三 化学试题河北省石家庄市第十七中学2023-2024高二上学期期末考试化学试题
3 . 铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
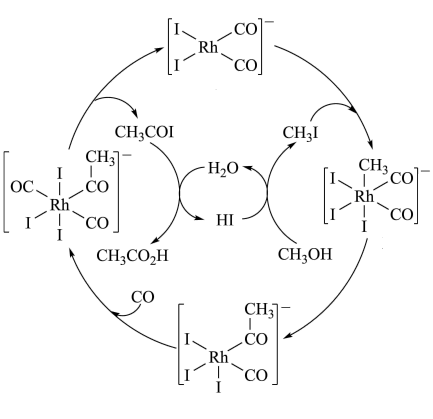
| A.CH3COI是反应中间体 |
| B.甲醇羰基化反应为CH3OH+CO=CH3CO2H |
| C.反应过程中Rh的成键数目保持不变 |
| D.存在反应CH3OH+HI=CH3I+H2O |
您最近一年使用:0次
2020-07-08更新
|
17481次组卷
|
48卷引用:专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编
(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编(已下线)第13讲 原子结构和化学键-2021年高考化学一轮复习名师精讲练(已下线)小题必刷21 原子结构与化学键——2021年高考化学一轮复习小题必刷(通用版)(已下线)热点7 新信息反应机理分析-2021年高考化学【热点·重点·难点】专练(山东专用)2020年全国统一考试化学试题(新课标Ⅰ)河南省郑州市巩义市第四高级中学2021届高三上学期期中考试化学试题(已下线)热点10 新信息反应机理分析-2021年高考化学专练【热点·重点·难点】(已下线)专题10 化学平衡(速率、影响因素、图像、标志、平衡压强及常数)-2021年高考化学必做热点专题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)(已下线)课时27 微粒间作用力-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点38 烃的含氧衍生物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点38 卤代烃 醇 酚-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点39 醛 羧酸 酯-备战2022年高考化学一轮复习考点帮(浙江专用)2020年全国卷Ⅰ理综化学高考真题变式题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)卷08 元素周期律-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)秘籍08 反应历程探究与催化原理图象分析-备战2022年高考化学抢分秘籍(全国通用)(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏加德罗常数-备战2022年高考化学临考题号押题(全国卷)(已下线)查补易混易错点01 物质的组成、性质、分类及化学用语-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题07化学反应中的能量变化及反应机理-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题07化学反应中的能量变化及反应机理-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第18讲 化学反应速率(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻3 化学反应历程图像分析(已下线)专题10 物质的反应及转化(已下线)热点题型训练 催化剂与反应历程(机理)(已下线)T12-物质反应及转化天津市和平区2020-2021学年高二下学期期末考试化学试题(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)安徽省合肥市普通高中六校联盟2021-2022学年高二下学期期中联考化学试题北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题专题1 揭示物质结构的奥秘 ★第一~三单元综合拔高练四川省内江市第六中学2021-2022学年高二下学期入学考试(创新班)化学试题新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题黑龙江省大庆市东风中学2022-2023学年高三上学期第一次月考化学试题河南省洛阳市新安县第一高级中学2022-2023学年高三上学期入学测试(实验小班)化学试题湖南省邵阳市洞口县第一中学2021-2022学年高三下学期第三次模拟考试化学试题北京市中国人民大学附属中学2022-2023学年高三上学期统练6化学试题(已下线)广东省深圳中学2023届高三年级上学期第二次阶段测试化学试题(A卷)黑龙江省哈尔滨市第一二二中学2021-2022学年高三假期检验性考试化学试题内蒙古赤峰二中2022-2023学年高二下学期第一次月考化学试题广东省2021届高三下学期模拟预热化学试题广东省汕头市金山中学2023-2024学年高二上学期10月阶段考试 化学 Word版含答案江苏省南京市人民中学 海安实验中学 句容三中2023-2024学年高二下学期3月月考化学试题
名校
4 . 我国著名有机化学家张绪穆于2000年在JACS杂志上公布了著名的“张烯炔异构化反应”及其机理。该反应丰富了人类进行天然有机分子全合成的手段,该反应原理如下:

其中:—R、—R’、—R’’可以为—H、—CH3、—CH2CH3或 ,—X—可以为—O—、—NH—或CH2—
,—X—可以为—O—、—NH—或CH2—
现拟合成 应选取的反应物是( )
应选取的反应物是( )

其中:—R、—R’、—R’’可以为—H、—CH3、—CH2CH3或
 ,—X—可以为—O—、—NH—或CH2—
,—X—可以为—O—、—NH—或CH2—现拟合成
 应选取的反应物是( )
应选取的反应物是( )A.CH3—C C—CH2—O—CH2—CH=CH—CH3 C—CH2—O—CH2—CH=CH—CH3 |
B.CH3—C C—CH2—O—CH2—CH2—CH=CH2 C—CH2—O—CH2—CH2—CH=CH2 |
C.CH3—C C—CH2—O—CH2—CH=CH—CH2—CH3 C—CH2—O—CH2—CH=CH—CH2—CH3 |
D.CH3—C C—CH2—O—CH2—CH2—CH=CH—CH3 C—CH2—O—CH2—CH2—CH=CH—CH3 |
您最近一年使用:0次
名校
5 . 已知X和Y能发生如下反应:X+Y=H2O+盐,下列有关物质X和Y所属种类的判断中一定不正确的是( )
| A.X为酸、Y为碱 | B.X为碱性氧化物、Y为酸 |
| C.X为盐、Y为碱 | D.X为碱性氧化物、Y为酸性氧化物 |
您最近一年使用:0次
2018-09-12更新
|
1837次组卷
|
31卷引用:专题2.1 物质的分类 胶体 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》
(已下线)专题2.1 物质的分类 胶体 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》【全国百强校】山东省枣庄市第八中学东校区2019届高三9月月考化学试题备战2020高考化学二轮专项训练:多角度考查物质变化云南省峨山彝族自治县峨山一中2018-2019学年高二入学考试化学试题贵州省毕节市织金县第一中学2018-2019学年高一上学期12月份考试化学试题鲁科版新教材(2019)化学同步2.1.1 元素与物质的关系 物质分类与物质性质福建省莆田市第六中学2019-2020学年高一上学期第一次月考化学试题(B)云南省福贡县第一中学2019-2020学年高一上学期期末考试化学试题人教版高一化学必修1第二章《化学物质及其变化》测试卷(已下线)2.1.1 元素与物质的关系 物质分类与物质性质练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)专题01 物质的分类及转化(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学广东省深圳市第七高级中学2020-2021学年高一上学期第一学段考试化学试题(已下线)练习2 物质的转化-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)(已下线)衔接点02 酸碱盐的分类和命名-2021年初升高化学无忧衔接(已下线)课时03 物质的组成、分类和性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第01练 物质的分类及转化-2023年高考化学一轮复习小题多维练(全国通用)山东省“学情空间”区域教研共同体2022-2023学年高一上学期10月联考(人教版)化学试题(已下线)第二章 化学物质及其变化 第1讲 物质的变化及分类福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题陕西省西安市长安区第一中学2021-2022学年高二下学期期中考试化学试题(已下线)衔接点03 酸碱盐的分类和命名-2022年初升高化学无忧衔接广东省揭阳华侨高级中学2021-2022学年高一上学期第一次阶段考试化学试题黑龙江省哈尔滨市第一中学2021-2022学年高一上学期期中考试化学试题 甘肃省兰州市西固区三校2021-2022学年高一上学期期中联考化学试题广西钦州市第四中学2021-2022学年高一上学期期中考试化学试题吉林省长春外国语学校2022-2023学年高一上学期第一次月考化学试题甘肃省天水市第一中学2022-2023学年高一上学期第一学段检测化学试题第2课时 物质的转化甘肃省部分学校2023-2024学年高一上学期10月期中考试化学试题湖北省荆州市沙市中学2023-2024学年高一上学期9月月考化学试题河北省石家庄北华中学2023-2024学年高一上学期10月月考考试化学试题
名校
6 . 下列物质间相互发生反应时:①Na+O2 ②Fe+Cl2 ③AgNO3溶液+氨水 ④KI溶液+AgNO3溶液 ⑤Na2CO3+C6H5COOH ⑥AlCl3+KOH ⑦P+Cl2 ⑧Cu+HNO3;在不同条件下得到不同产物的是( )
| A.除②④⑤ | B.除②④ | C.除④⑥ | D.除④⑤⑥ |
您最近一年使用:0次
2018-09-08更新
|
347次组卷
|
5卷引用:专题2.2 离子反应-巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》
(已下线)专题2.2 离子反应-巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》【全国百强校】山东省枣庄市第八中学东校区2019届高三9月月考化学试题山东省邹城市兖矿第一中学2021届高三上学期9月份月考化学试题【全国百强校】黑龙江省大庆实验中学2019届高三上学期第一次月考化学试题辽宁省大连市第二十四中学2020届高三上学期阶段联合考试化学试题
名校
7 . 硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI;Ⅱ.2HI H2+I2 ;Ⅲ.2H2SO4=2SO2+O2+2H2O。
H2+I2 ;Ⅲ.2H2SO4=2SO2+O2+2H2O。
(1)分析上述反应,下列判断正确的是________ 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=________ 。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=
2HI(g)的平衡常数K=________ 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________ 是原来的2倍。

a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________ 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________ ,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
Ⅰ.SO2+2H2O+I2=H2SO4+2HI;Ⅱ.2HI
 H2+I2 ;Ⅲ.2H2SO4=2SO2+O2+2H2O。
H2+I2 ;Ⅲ.2H2SO4=2SO2+O2+2H2O。(1)分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=
 2HI(g)的平衡常数K=
2HI(g)的平衡常数K=
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
您最近一年使用:0次
2018-08-28更新
|
137次组卷
|
3卷引用:2018-2019学年鲁科版高中化学选修四:模块综合检测题(二)
2014·江西·一模
8 . 归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变.
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变.
| A.①④ | B.②④ | C.④⑤ | D.②③ |
您最近一年使用:0次
2016-12-09更新
|
584次组卷
|
5卷引用:2018-2019学年鲁科版高中化学选修四:模块综合检测题(二)
2018-2019学年鲁科版高中化学选修四:模块综合检测题(二)(已下线)2014届江西省重点中学协作体高三第一次联考理综化学试卷(已下线)2014届河南省商丘市高三第二次模拟考试理综化学试卷2014-2015辽宁省沈阳二中高二上学期期末化学试卷2016-2017学年湖北省鄂东南省级示范高中高二下学期期中联考化学试卷



