解题方法
1 . 乙二酸(H2C2O4)俗称草酸,为无色晶体,是二元弱酸,广泛分布于植物、动物和真菌体中,在实验研究和化学工业中应用广泛。回答下列问题:
(1)工业上可由以下反应制取草酸:
I.4CO(g)+4C4H9OH(l)+O2(g)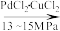 2(COOC4H9)2(l)+2H2O(l)
2(COOC4H9)2(l)+2H2O(l)
II.(COOC4H9)2(l)+2H2O(l) H2C2O4(l)+2C4H9OH(l)
H2C2O4(l)+2C4H9OH(l)
①反应I选择13~15 MPa的高压条件下进行,最主要的原因是为了___________ ,若5min内c(O2)减少了0.15 mol·L-1,则用CO表示的反应速率为___________ mol·L-1·min-1
②对于反应II,下列能够说明其已经达到平衡状态的是___________ (填序号)。
a.溶液的pH保持不变
b.平衡常数K保持不变
c.丁醇的浓度保持不变
d.反应液的总质量保持不变
(2)草酸溶液中微粒的物质的量分数随溶液pH变化如图所示:

①某温度下,测得0.1 mol·L-1 H2C2O4溶液的pH=1.3,此时草酸的电离方程式为___________ 。
②向10 mL 0.1 mol·L-1 H2C2O4溶液中逐滴加入0.1 mol·L-1 NaOH溶液,当溶液中c(Na+)=2c( )+c(
)+c( )时,加入V(NaOH)
)时,加入V(NaOH)___________ 10 mL(填“>”“=”或“<”),若加入NaOH溶液体积为20 mL,此时溶液中阴离子浓度的大小顺序为___________ ;当pH=2.7时,溶液中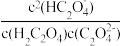 =
=___________ 。
(1)工业上可由以下反应制取草酸:
I.4CO(g)+4C4H9OH(l)+O2(g)
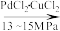 2(COOC4H9)2(l)+2H2O(l)
2(COOC4H9)2(l)+2H2O(l)II.(COOC4H9)2(l)+2H2O(l)
 H2C2O4(l)+2C4H9OH(l)
H2C2O4(l)+2C4H9OH(l)①反应I选择13~15 MPa的高压条件下进行,最主要的原因是为了
②对于反应II,下列能够说明其已经达到平衡状态的是
a.溶液的pH保持不变
b.平衡常数K保持不变
c.丁醇的浓度保持不变
d.反应液的总质量保持不变
(2)草酸溶液中微粒的物质的量分数随溶液pH变化如图所示:

①某温度下,测得0.1 mol·L-1 H2C2O4溶液的pH=1.3,此时草酸的电离方程式为
②向10 mL 0.1 mol·L-1 H2C2O4溶液中逐滴加入0.1 mol·L-1 NaOH溶液,当溶液中c(Na+)=2c(
 )+c(
)+c( )时,加入V(NaOH)
)时,加入V(NaOH)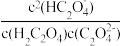 =
=
您最近一年使用:0次
2 . 下列图示与对应的叙述不相符的是( )
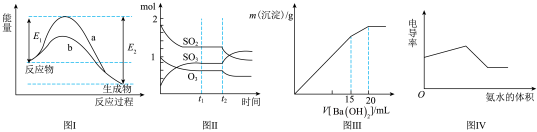

| A.图Ⅰ表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化 |
B.图Ⅱ表示一定条件下进行的反应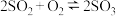 各成分的物质的量变化, 各成分的物质的量变化, 时刻改变的条件可能是缩小容器体积 时刻改变的条件可能是缩小容器体积 |
C.图Ⅲ表示某明矾溶液中加入 溶液,沉淀的质量与加入 溶液,沉淀的质量与加入 溶液体积的关系,在加入 溶液体积的关系,在加入 溶液时铝离子恰好沉淀完全 溶液时铝离子恰好沉淀完全 |
| D.电导率可表示溶液导电性的强弱,电导率越大导电性越强,图Ⅳ可表示向盐酸和醋酸混合溶液中滴入氨水过程中电导率的变化关系 |
您最近一年使用:0次
3 . 习近平总书记十分重视生态环境保护,多次对生态文明建设作出重要指示。试回答下列与环境有关的问题:
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH3催化还原NOx可消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H=-112 kJ·mol-1;
③适量的N2和O2完全反应,每生成5.6 L(标准状况下)NO时,吸收22.5 kJ的热量。则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=____________ kJ·mol-1。
(2)在汽车排气系统中安装三元催化转化器,可发生下列反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示:
2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示:
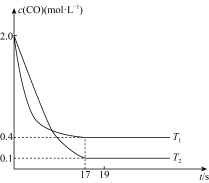
①该反应的逆反应为___________ (填“放热”或“吸热”)反应。
②温度为T1时,反应达到平衡时NO的转化率为___________ 。
③温度为T2时,该反应的平衡常数K=___________ 。
(3)目前烟气脱硝采用的技术有选择性非催化还原法(SNCR)脱硝技术和选择性催化还原法(SCR)脱硝技术。若用NH3作还原剂,则主要反应可表示为4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O △H<0,其中体系温度对SNCR技术脱硝效率的影响如图所示:
4N2(g)+6H2O △H<0,其中体系温度对SNCR技术脱硝效率的影响如图所示:
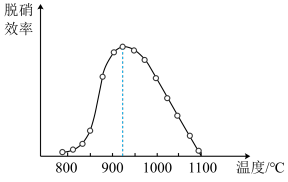
①SNCR技术脱硝的最佳温度为________ ,SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是_____________ 。
②由题给信息分析,当体系温度过高时,SNCR技术脱硝效率降低,其可能的原因是_____ 。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH3催化还原NOx可消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H=-112 kJ·mol-1;
③适量的N2和O2完全反应,每生成5.6 L(标准状况下)NO时,吸收22.5 kJ的热量。则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=
(2)在汽车排气系统中安装三元催化转化器,可发生下列反应:2NO(g)+2CO(g)
 2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示:
2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图所示:
①该反应的逆反应为
②温度为T1时,反应达到平衡时NO的转化率为
③温度为T2时,该反应的平衡常数K=
(3)目前烟气脱硝采用的技术有选择性非催化还原法(SNCR)脱硝技术和选择性催化还原法(SCR)脱硝技术。若用NH3作还原剂,则主要反应可表示为4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O △H<0,其中体系温度对SNCR技术脱硝效率的影响如图所示:
4N2(g)+6H2O △H<0,其中体系温度对SNCR技术脱硝效率的影响如图所示:
①SNCR技术脱硝的最佳温度为
②由题给信息分析,当体系温度过高时,SNCR技术脱硝效率降低,其可能的原因是
您最近一年使用:0次
解题方法
4 . 以废旧磷酸亚铁锂电池正极片( 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。

回答下列问题:
(1) 中Fe元素的化合价为
中Fe元素的化合价为_________ ;“放电处理”有利于锂在正极的回收,其原因是__________ 。
(2)“碱浸”中发生反应的离子方程式为________________________________ 。
(3)“浸取”中加入 的作用为
的作用为________________ ;“沉铁”过程所得滤渣为白色固体,其主要成分是________________ 。
(4)已知碳酸锂的分解温度为 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是________________ ; 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为_____ 。
(5)写出“焙烧”过程中生成锰酸锂的化学方程式_________________________________ 。
 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。
回答下列问题:
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)“碱浸”中发生反应的离子方程式为
(3)“浸取”中加入
 的作用为
的作用为(4)已知碳酸锂的分解温度为
 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为(5)写出“焙烧”过程中生成锰酸锂的化学方程式
您最近一年使用:0次
2020-11-24更新
|
567次组卷
|
2卷引用:山东省临沂市2021届高三上学期期中考试化学试题
解题方法
5 . 十九大报告中关于生态环境保护的论述全面而深刻,对研究NOx、SO2等大气污染物的妥善处理具有重要指导意义。
(1)已知:2NO(g)+O2(g) 2NO2(g)△H=-113.0kJ·mol-1
2NO2(g)△H=-113.0kJ·mol-1
2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ·mol-1
2SO3(g)△H=-196.6kJ·mol-1
写出SO2与NO2反应生成SO3和NO的热化学反应方程式___ 。
(2)汽车尾气的净化装置中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g)△H<0。在密闭容器中充入10molCO和8molNO,发生上述反应,如图为平衡时NO的体积分数与温度,压强的关系。
N2(g)+2CO2(g)△H<0。在密闭容器中充入10molCO和8molNO,发生上述反应,如图为平衡时NO的体积分数与温度,压强的关系。

①该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有___ (填字母序号)。
a.升高温度 b.增加CO的浓度 c.缩小容器的体积 d.改用高效催化剂
②压强为10MPa、温度为T1下,若反应进行到10min达到平衡状态,容器的体积为2L;用CO2的浓度变化表示的平均反应速率v(CO2)=___ ;若在D点对反应容器升温的同时增大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的___ 点。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图所示,则N极应连接电源的___ (填“正极”或“负极”),M极的电极反应式为___ 。

(1)已知:2NO(g)+O2(g)
 2NO2(g)△H=-113.0kJ·mol-1
2NO2(g)△H=-113.0kJ·mol-12SO2(g)+O2(g)
 2SO3(g)△H=-196.6kJ·mol-1
2SO3(g)△H=-196.6kJ·mol-1写出SO2与NO2反应生成SO3和NO的热化学反应方程式
(2)汽车尾气的净化装置中发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g)△H<0。在密闭容器中充入10molCO和8molNO,发生上述反应,如图为平衡时NO的体积分数与温度,压强的关系。
N2(g)+2CO2(g)△H<0。在密闭容器中充入10molCO和8molNO,发生上述反应,如图为平衡时NO的体积分数与温度,压强的关系。
①该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有
a.升高温度 b.增加CO的浓度 c.缩小容器的体积 d.改用高效催化剂
②压强为10MPa、温度为T1下,若反应进行到10min达到平衡状态,容器的体积为2L;用CO2的浓度变化表示的平均反应速率v(CO2)=
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图所示,则N极应连接电源的

您最近一年使用:0次
名校
6 . 二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如图所示。

下列叙述正确的是

下列叙述正确的是
A.海水酸化能引起HCO 浓度减小、CO 浓度减小、CO 浓度增大 浓度增大 |
| B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少 |
C.CO2能引起海水酸化,其原理为HCO ⇌H++ CO ⇌H++ CO |
| D.珊瑚周围藻类植物的生长不利于珊瑚的形成 |
您最近一年使用:0次
2020-11-17更新
|
247次组卷
|
2卷引用:山东省日照市莒县2020-2021学年高二11月模块考试化学试题
7 . 铂(78Pt)被誉为“第一重要的高技术金属”,因独特的物理化学性质,被广泛应用于汽车、石油化工、电气电子等现代工业中。水合肼还原精炼法是铂精炼的方法之一,流程如下:

已知:①氯铂酸铵[(NH4)2PtCl6],黄色,难溶于水,易溶于盐酸并生成H2PtCl6;
②氯亚铂酸铵[(NH4)2PtCl4],红色,易溶于水。
回答下列问题:
(1)铂位于周期表中第______ 周期,试写出一种金属铂在中学化学中的应用____________
(2)工业原料粗氯铂酸铵中含有大量氯化铵等可溶性的盐,在实验室中预处理时,需将样品溶解过滤后洗涤,洗涤沉淀方法是____________
(3)在还原溶解中观察到的现象:__________
(4)氧化沉淀过程的反应方程式为:___________
(5)有研究表明,氯铂酸铵制取金属铂,除了煅烧外,也可将其溶解于盐酸中,加入Zn,得到产品,反应过程有Zn+2HCl = ZnCl2+H2↑;_________
(6)水合肼还原精炼法在溶解时的固液比、溶液的酸度(盐酸浓度)、反应时间等对于精炼铂的产率,均有较大的影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示,由此可得最佳的反应条件是_________


已知:①氯铂酸铵[(NH4)2PtCl6],黄色,难溶于水,易溶于盐酸并生成H2PtCl6;
②氯亚铂酸铵[(NH4)2PtCl4],红色,易溶于水。
回答下列问题:
(1)铂位于周期表中第
(2)工业原料粗氯铂酸铵中含有大量氯化铵等可溶性的盐,在实验室中预处理时,需将样品溶解过滤后洗涤,洗涤沉淀方法是
(3)在还原溶解中观察到的现象:
(4)氧化沉淀过程的反应方程式为:
(5)有研究表明,氯铂酸铵制取金属铂,除了煅烧外,也可将其溶解于盐酸中,加入Zn,得到产品,反应过程有Zn+2HCl = ZnCl2+H2↑;
(6)水合肼还原精炼法在溶解时的固液比、溶液的酸度(盐酸浓度)、反应时间等对于精炼铂的产率,均有较大的影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示,由此可得最佳的反应条件是

您最近一年使用:0次
8 . 一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,其是重要的水的消毒剂。
(1)写出NH2Cl的电子式____________________ 。
(2)写出NH2Cl与水反应的化学方程式___________________________ 。
(3)一定条件下(T ℃、1 atm),可以用Cl2(g)和NH3(g)制得NH2Cl(g)同时得到HCl(g)。
已知部分化学键的键能如表所示:
写出该反应的热化学方程式____________________________________ 。
(1)写出NH2Cl的电子式
(2)写出NH2Cl与水反应的化学方程式
(3)一定条件下(T ℃、1 atm),可以用Cl2(g)和NH3(g)制得NH2Cl(g)同时得到HCl(g)。
已知部分化学键的键能如表所示:
| 化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
| 键能/(kJ·mol-1) | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式
您最近一年使用:0次
9 . 氢气是一种清洁能源,请根据实验室和工业上制氢及氢气性质回答相关问题。
I.实验室用稀硫酸与锌粒(黄豆粒大小)制取氢气时加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)少量硫酸铜溶液可以加快氢气生成速率的原因是______________ ;
(2)要加快上述实验中产生氢气的速率,还可采取的措施有______ 、_______ (列举两种措施)。
(3)当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因____________ 。
II.工业上海水制氢气的新技术:2H2O 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题:
(1)分解海水的反应属于_____ 反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极是2H2+2O2-―4e-=2H2O,B极是O2+4e-=2O2-,则A极是电池的____ 极。
(3)氢气的储存比较困难,最近科学家研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2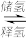 HCOONa+H2O。下列有关说法正确的是
HCOONa+H2O。下列有关说法正确的是____ 。
A 储氢释氢过程均无能量变化 B 该反应属于可逆反应
C 储氢过程中,NaHCO3被还原 D 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
I.实验室用稀硫酸与锌粒(黄豆粒大小)制取氢气时加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)少量硫酸铜溶液可以加快氢气生成速率的原因是
(2)要加快上述实验中产生氢气的速率,还可采取的措施有
(3)当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因
II.工业上海水制氢气的新技术:2H2O
 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题:(1)分解海水的反应属于
(2)某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极是2H2+2O2-―4e-=2H2O,B极是O2+4e-=2O2-,则A极是电池的
(3)氢气的储存比较困难,最近科学家研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2
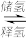 HCOONa+H2O。下列有关说法正确的是
HCOONa+H2O。下列有关说法正确的是A 储氢释氢过程均无能量变化 B 该反应属于可逆反应
C 储氢过程中,NaHCO3被还原 D 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
您最近一年使用:0次
名校
解题方法
10 . 以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。回答下列问题:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g) ΔH1=3351kJ·molˉ1
2C(s)+O2(g)=2CO(g) ΔH2=-221kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是___ 。
(2)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体。
如图是电解槽的示意图。

①写出电解时阳极的电极反应式:___ 。
②电解过程中生成的氧气全部与石墨电极反应生成CO和CO2气体。因此,需要不断补充石墨电极。工业生产中,每生产9吨铝阳极损失5.4吨石墨。每生产9吨铝转移电子的物质的量为___ mol,生成的二氧化碳的物质的量为___ mol。
(3)可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,以铝合金为负极。
①以NaCl溶液为电解质溶液时,正极反应式为___ 。
②以NaOH溶液为电解质溶液时,负极反应式为___ 。
(1)已知:2Al2O3(s)=4Al(g)+3O2(g) ΔH1=3351kJ·molˉ1
2C(s)+O2(g)=2CO(g) ΔH2=-221kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是
(2)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体。
如图是电解槽的示意图。

①写出电解时阳极的电极反应式:
②电解过程中生成的氧气全部与石墨电极反应生成CO和CO2气体。因此,需要不断补充石墨电极。工业生产中,每生产9吨铝阳极损失5.4吨石墨。每生产9吨铝转移电子的物质的量为
(3)可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,以铝合金为负极。
①以NaCl溶液为电解质溶液时,正极反应式为
②以NaOH溶液为电解质溶液时,负极反应式为
您最近一年使用:0次
2020-05-13更新
|
124次组卷
|
2卷引用:山东省潍坊市五县市2019-2020学年高一下学期期中考试化学试题



