山东省烟台市2019-2020学年高一下学期期中考试化学(等级考)试题
山东
高一
期中
2020-07-18
421次
整体难度:
适中
考查范围:
认识化学科学、物质结构与性质、化学反应原理、常见无机物及其应用、化学与STSE
一、单选题 添加题型下试题
A.含有173个中子的113号元素符号 Nh Nh | B.H2O与D2O互称为同素异形体 |
C.NaOH的电子式: | D.F的原子结构示意图: |
| A.打开汽水瓶有气泡从溶液中冒出 |
| B.黄绿色的氯水光照后颜色变浅 |
C.FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅 Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅 |
D.2NO2(g) N2O4(g)平衡体系中,加压缩小体积后颜色加深 N2O4(g)平衡体系中,加压缩小体积后颜色加深 |
| A.0.4 mol·L-1 | B.0.6 mol·L-1 | C.0.9 mol·L-1 | D.1.2 mol·L-1 |
【知识点】 化学反应的速率

| A.相同条件下,催化剂b的效果更好 |
| B.使用催化剂,合成氨反应放出的热量减少 |
| C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量 |
| D.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键 |
【知识点】 化学反应中能量变化的原因 化学键与化学反应中的能量关系解读
 3Z(g)+W(s) △H>0的叙述正确的是( )
3Z(g)+W(s) △H>0的叙述正确的是( )| A.加入少量W,逆反应速率增大,平衡向左移动 |
| B.升高温度,混合气体的平均相对分子质量减小 |
| C.温度、体积不变,充入He,反应速率会加快 |
| D.增大压强,正反应速率增大,逆反应速率减小 |
【知识点】 压强对化学反应速率的影响解读 化学平衡的移动及其影响因素

| A.简单离子半径大小关系:Y>Z>X>W | B.图示反应中有离子键的形成 |
| C.简单阴离子的还原性:Y>Z | D.D的水溶液中含有阴、阳离子及共价键形成的分子 |
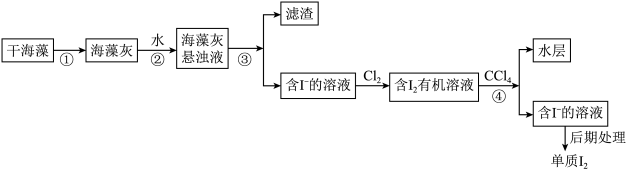
下列关于该流程中各步的装置和仪器的说法中错误的是
| 选项 | 步骤 | 采用装置 | 主要仪器 |
| A | ① | 灼烧装置 | 蒸发皿 |
| B | ② | 溶解装置 | 烧杯 |
| C | ③ | 过滤装置 | 漏斗 |
| D | ④ | 分液装置 | 分液漏斗 |
| A.A | B.B | C.C | D.D |
【知识点】 海带中碘的提取及检验解读
| A.分子中一定含有共价键 |
| B.两种非金属元素形成的化合物中可能含有离子键 |
| C.需要加热的反应不一定是吸热反应 |
| D.化学键的断裂和形成是化学反应中能量变化的本质 |
【知识点】 化学键与化学反应中的能量关系解读 化学键基本概念

| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.步骤③、④、⑤均有利于提高原料平衡的转化率 |
| D.产品液氨除可生产化肥外,还可用作制冷剂 |
| A.SrSO4是难溶于水的白色固体 |
| B.H2Se比H2S易分解 |
| C.At单质为有色固体,AgAt不溶于水也不溶于稀HNO3 |
| D.Li在氧气中燃烧,产物是Li2O2,其溶液是一种强碱 |
【知识点】 预测元素的性质解读 同主族元素性质递变规律
二、多选题 添加题型下试题
| A.Na3N是由离子键形成的离子化合物 |
| B.Na3N与盐酸反应生成两种盐 |
| C.Na3N与水的反应属于氧化还原反应 |
| D.Na3N中两种粒子的半径:r(Na+)>r(N3-) |
【知识点】 氧化还原反应基本概念 微粒半径大小的比较方法解读 离子键
三、单选题 添加题型下试题

以下推断不合理的是
| A.流程中循环利用的物质有SO2、Br2、Cl2,等多种 |
| B.SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr |
| C.空气能吹出溴是利用溴易挥发的性质 |
| D.没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能 |

| A.Q的氧化物一定含有离子键和共价键 | B.最高价含氧酸的酸性:Z<Y |
| C.P的最低价氢化物常温常压下为液体 | D.Y形成的化合物种类最多 |
【知识点】 元素周期律、元素周期表的推断
四、多选题 添加题型下试题
| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| I | 恒温恒容 | 放热Q1kJ |
| II | 恒温恒压 | 放热Q2kJ |
| A.放出热量:Q1<Q2 | B.N2的转化率:II>I |
| C.平衡常数:II>I | D.平衡时氨气的体积分数:I>II |
| A.X的最高价氧化物对应的水化物一定为强酸 | B.气态氢化物的沸点:Y>M |
| C.Z是地壳中含量最多的元素 | D.原子半径:Z>M>X>Y |
五、解答题 添加题型下试题

实验I:验证碳、氮、硅元素非金属性强弱。(供选择的试剂:稀HNO3、浓H2SO4、CaCO3固体、Na2CO3固体、Na2SiO3溶液、澄清石灰水、饱和NaHCO3溶液)
(1)仪器a的名称:
(2)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是
实验II:验证同周期元素和同主族元素的金属性递变规律。(方案与现象不对应)
实验方案:①将一小块金属钠放入滴有酚酞试液的冷水中
②将一小块金属钾放入滴有酚酞试液的冷水中
③镁带与2 mol·L-1的盐酸反应
④铝条与2 mol·L-1的盐酸反应
⑤用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞
实验现象: A.浮在水面上,熔成小球,四处游动,随后消失,溶液变成红色
B.浮在水面上,熔成小球,四处游动,并伴有轻微的爆炸声,很快消失,溶液变成红色
C.产生气体,可在空气中燃烧,溶液变成浅红色
D.反应不十分剧烈,产生气体可以在空气中燃烧
E.剧烈反应,产生的气体可以在空气中燃烧
请回答:
(1)该实验中用到的玻璃仪器有
(2)请完成下列表格
| 实验方案 | 实验现象 | 化学方程式 |
| ① | A | 2Na +2H2O=2NaOH +H2↑ |
| ② | ||
| ③ | E | Mg +2HCl=MgCl2 +H2↑ |
| ④ | D | 2Al +6HCl=2AlCl3 +H2↑ |
| ⑤ |
(3)由实验得出有关元素周期律结论:
【知识点】 元素金属性、非金属性强弱探究实验解读
 )是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)
)是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。(1)已知反应中的相关化学键键能数据如下:
| 化学键 | O-H | C-O | C=O |
E/(kJ mol-1) mol-1) | 465 | 343 | 750 |
(2)在1 L恒容密闭容器中充入CO2和H2,所得实验数据如下表
| 实验编号 | 温度/。C | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(CO2) | n(H2) | n(CH3OH) | ||
| ① | 150 | 0.23 | 0.19 | 0.03 |
| ② | 200 | 0.10 | 0.26 | 0.02 |
| ③ | 200 | 0.17 | a | 0.01 |
实验②达到平衡时H2转化率为
实验③a=
(3)甲醇、空气和稀硫酸可以形成燃料电池,其正极电极反应式为
(1)若常温下Y的单质能与水发生反应,X原子序数大于Y,则X位于周期表的
(2)若甲灼烧时,火焰呈现砖红色,且与盐酸反应时产生有刺激性气味气体。则甲为
(3)若X、Y是不同周期的短周期元素,甲与盐酸反应逸出无色无味气体乙。
则:①乙中所含化学键类型为
②该反应的离子方程式为
【知识点】 无机综合推断 根据物质性质进行元素种类推断解读
I.实验室用稀硫酸与锌粒(黄豆粒大小)制取氢气时加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)少量硫酸铜溶液可以加快氢气生成速率的原因是
(2)要加快上述实验中产生氢气的速率,还可采取的措施有
(3)当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因
II.工业上海水制氢气的新技术:2H2O
 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题:(1)分解海水的反应属于
(2)某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极是2H2+2O2-―4e-=2H2O,B极是O2+4e-=2O2-,则A极是电池的
(3)氢气的储存比较困难,最近科学家研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2
 HCOONa+H2O。下列有关说法正确的是
HCOONa+H2O。下列有关说法正确的是A 储氢释氢过程均无能量变化 B 该反应属于可逆反应
C 储氢过程中,NaHCO3被还原 D 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
(1)用活性炭还原NO的有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:浓度mol/L 时间min | NO | N2 | CO2 |
| 0 | 10 | 0 | 0 |
| 10 | 5 | 2.5 | 2.5 |
| 20 | 2 | 4 | 0.25 |
②在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正
(2)工业上由N2、H2来制备NH3。不同温度下,向三个相同的容器中投入相同的反应物进行反应,测得不同温度时平衡混合物中NH3的物质的量分数随压强增大而变化如图所示。

①M点的v正
②图中三条曲线对应的温度分别为T1、T2、T3,其中温度最高的是
③恒温恒容条件下,能说明反应N2(g)+3H2(g)
 2NH3(g)达到平衡状态的是
2NH3(g)达到平衡状态的是A. 2v(N2)=v(NH3) B.c2(NH3)/[c(N2)c3(H2)]保持不变
C.反应器中的压强不再发生变化 D.3 molH-H键断裂的同时,有2molN-H键断裂
(3)NO2存在如下平衡:2NO2(g)
 N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系: v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系: v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=
试卷分析
试卷题型(共 20题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 原子结构示意图、离子结构示意图 共价型分子结构式、电子式 原子中相关数值及其之间的相互关系 几组常见同素异形体 | |
| 2 | 0.65 | 化学平衡的移动 浓度对化学平衡移动的影响 压强对化学平衡移动的影响 勒夏特列原理的应用 | |
| 3 | 0.85 | 化学反应的速率 | |
| 4 | 0.85 | 化学反应中能量变化的原因 化学键与化学反应中的能量关系 | |
| 5 | 0.65 | 压强对化学反应速率的影响 化学平衡的移动及其影响因素 | |
| 6 | 0.65 | 无机综合推断 氯气 | |
| 7 | 0.85 | 海带中碘的提取及检验 | |
| 8 | 0.85 | 化学键与化学反应中的能量关系 化学键基本概念 | |
| 9 | 0.85 | 催化剂对化学反应速率的影响 化学平衡的移动及其影响因素 合成氨条件的选择 | |
| 10 | 0.65 | 预测元素的性质 同主族元素性质递变规律 | |
| 12 | 0.65 | 海水提取溴 | |
| 13 | 0.65 | 元素周期律、元素周期表的推断 | |
| 二、多选题 | |||
| 11 | 0.65 | 氧化还原反应基本概念 微粒半径大小的比较方法 离子键 | |
| 14 | 0.65 | 化学平衡常数 压强对化学平衡移动的影响 转化率的相关计算及判断 | |
| 15 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 | |
| 三、解答题 | |||
| 16 | 0.65 | 元素金属性、非金属性强弱探究实验 | 实验探究题 |
| 17 | 0.4 | 根据△H=反应物的键能之和-生成物的键能之和进行计算 化学平衡常数 化学平衡常数的有关计算 原电池电极反应式书写 | 原理综合题 |
| 18 | 0.4 | 无机综合推断 根据物质性质进行元素种类推断 | 无机推断题 |
| 19 | 0.65 | 化学反应原理综合考查 影响化学反应速率的因素 原电池原理 原电池原理对化学反应速率的影响 | 原理综合题 |
| 20 | 0.4 | 化学平衡的移动及其影响因素 化学平衡常数 化学平衡状态的判断方法 化学平衡题中基于图表数据的相关计算 | 原理综合题 |



