辽宁省铁岭市清河第二中学2019-2020学年高三12月月考化学试题
辽宁
高三
阶段练习
2020-02-06
199次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、化学实验基础、认识化学科学、物质结构与性质、常见无机物及其应用、化学与STSE
一、单选题 添加题型下试题

| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.步骤③、④、⑤均有利于提高原料平衡的转化率 |
| D.产品液氨除可生产化肥外,还可用作制冷剂 |
| A.氢氧燃料电池放电时化学能全部转化为电能 |
| B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应ΔH>0 |
| C.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快 |
| D.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023 |
【知识点】 可逆反应及反应限度解读 化学反应进行方向的判据 氢氧燃料电池解读
| 容器 | 起始物质的量/mol | CO2平衡转化率(α) | |||||
| 编号 | 容积/L | 条件 | CH4(g) | CO2(g) | CO(g) | H2(g) | |
| Ⅰ | 2 | 恒温恒容 | 2 | 1 | 0 | 0 | 50% |
| Ⅱ | 1 | 0.5 | 1 | 0 | 0 | ||
| Ⅲ | 1 | 绝热恒容 | 1 | 0.5 | 0 | 0 | - |
| A.T K时,反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的平衡常数为1/3 |
| B.容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50% |
| C.容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内 |
| D.容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)<v(逆) |
A.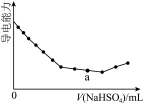 是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性 是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性 |
B. 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化 |
C. 是I2+I-⇌I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2) 是I2+I-⇌I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2) |
D.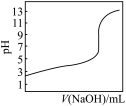 是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点 是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点 |
【知识点】 化学反应速率的图像解读 酸碱中和滴定 溶液稀释时pH的变化图像解读
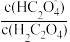 或
或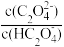 ]与pH的变化关系如图所示。下列说法一定正确的是
]与pH的变化关系如图所示。下列说法一定正确的是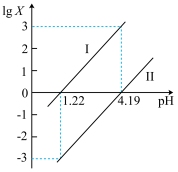
A.Ⅰ表示lg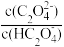 与pH的变化关系 与pH的变化关系 |
| B.pH=1.22的溶液中:2c(C2O42—)+c(HC2O4—)>c(Na+) |
| C.1.22<pH<4.19的溶液中:c(HC2O4—)>c(C2O42—)>c(H2C2O4) |
| D.pH=4.19的溶液中:c(Na+)=3c(HC2O4—) |
A.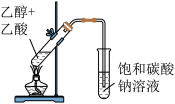 所示装置制取少量乙酸乙酯 所示装置制取少量乙酸乙酯 |
B.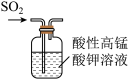 所示装置验证SO2的漂白性 所示装置验证SO2的漂白性 |
C.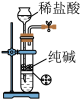 所示装置制取少量纯净的CO2气体 所示装置制取少量纯净的CO2气体 |
D.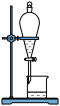 所示装置分离水和苯 所示装置分离水和苯 |
【知识点】 乙酸乙酯制备实验 常见气体的制备与收集解读 化学实验方案的设计与评价
| A.向氨水中通入过量SO2:NH3·H2O+SO2===NH4++HSO3- |
| B.Si与NaOH溶液反应:Si+2OH-+H2O===SiO32-+H2↑ |
C.电解MgCl2溶液:2H2O+2Cl-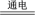 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| D.Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
【知识点】 离子反应的发生及书写 离子方程式的书写解读 离子方程式的正误判断解读
| A.原子半径:r(W)>r(Z)>r(Y)>r(X) |
| B.元素Y的简单气态氢化物的热稳定性比Z的强 |
| C.仅由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性也可能呈酸性 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |
A.0.1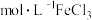 溶液: 溶液: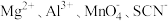 |
B.能使紫色石蕊试液变蓝的溶液: |
C.0.1 溶液: 溶液: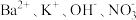 |
D. 的溶液: 的溶液: |
| 选项 | 实验操作和现象 | 结论 |
| A | 将适量苯加入溴水中,充分振荡后,水层接近无色 | 苯能与溴水发生加成反应 |
| B | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加2滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| C | 室温下,向10 mL 0.2 mol·L-1 NaOH溶液中滴入2滴0.1 mol·L-1 MgCl2溶液,产生白色沉淀,再滴加2滴0.1 mol·L-1 FeCl3溶液,有红褐色沉淀生成 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 常温下,分别测定浓度均为0.1 mol·L-1 NaF和NaClO溶液的pH,后者的pH大 | 酸性:HF<HClO |
| A.A | B.B | C.C | D.D |
| A.改进汽车尾气净化技术,减少大气污染物的排放 |
| B.加快化石燃料的开采与使用,促进社会可持续发展 |
| C.用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
| D.对工业废水、生活污水进行净化处理,减少污染物的排放 |
【知识点】 大气污染 水污染 能源开发利用新理念 绿色化学与可持续发展解读
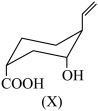
①可以使酸性KMnO4溶液褪色②可以和NaHCO3溶液反应③一定条件下能与H2发生加成反应④在浓硫酸、加热条件下,能与冰醋酸发生酯化反应
| A.①② | B.②③ | C.①②③ | D.①②③④ |
【知识点】 含碳碳双键物质的性质的推断解读 羧酸化学性质
| A.与乙酸互为同系物 | B.能与NaHCO3溶液反应 |
| C.能与乙醇发生酯化反应 | D.能使酸性高锰酸钾溶液褪色 |
| A.糖类、油脂、蛋白质都是仅由碳、氢、氧元素组成的物质 |
| B.甲烷光照条件下能与Cl2发生加成反应 |
C.分枝酸的结构简式为 ,则其分子式为C10H10O6 ,则其分子式为C10H10O6 |
| D.甲基环己烷的一氯代物有4种(不考虑立体异构) |
| A.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA |
B.反应5NH4NO3 2HNO3+4N2↑ +9H2O中,生成28 g N2时,转移的电子数目为3.75 NA 2HNO3+4N2↑ +9H2O中,生成28 g N2时,转移的电子数目为3.75 NA |
| C.0.1 mol·L-1MgCl2溶液中含Cl-数为0.2NA |
| D.3.9 g Na2O2晶体中含有的离子总数为0.2NA |

| A.电子流向是从吸附层M通过导线到吸附层N |
| B.电池工作时,负极区pH减小 |
| C.离子交换膜可用质子交换膜 |
| D.负极的电极反应是:H2-2e-+2OH-=2H2O |
【知识点】 原电池电极反应式书写解读 燃料电池
二、解答题 添加题型下试题
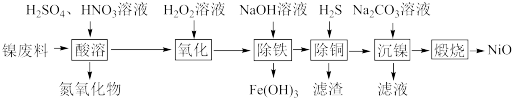
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是
(2) “氧化”时,Fe2+参加反应的离子方程式为
(3) “除铁”时需控制溶液的pH范围为
(4) “滤渣”的主要成分为
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是
三、填空题 添加题型下试题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是
【知识点】 盐类水解规律理解及应用解读 影响盐类水解的内因解读

根据图像回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是
(2)NH3·H2O的电离常数为
(3)当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=
四、解答题 添加题型下试题
(1)称取2.000g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有
(2)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
则常温常压下,NH3与NO2反应生成无污染物质的热化学方程式
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示:
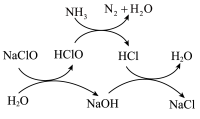
写出该图示的总反应化学方程式:
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图所示:

当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图所示:
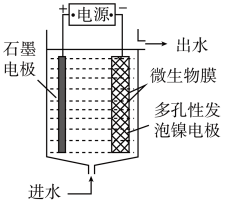
①写出该活性原子与NO3-反应的离子方程式:
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为
实验1:
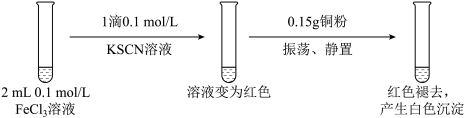
资料:ⅰ. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42—、Cu2+与Cl—。
ⅱ. SCN—被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与溴单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为
(2)下列由实验1得到的推论中,合理的是
a.Cu能还原Fe3+
b.Fe3+与SCN—的反应是可逆反应
c.白色沉淀中的Cu(Ⅰ)(Ⅰ表示+1 价铜元素)可能是由 Fe3+氧化Cu 得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
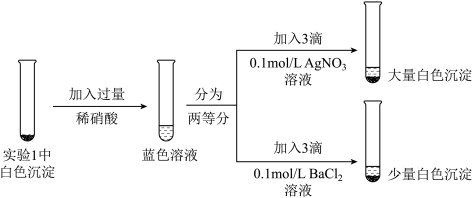
由实验2可知,实验1中白色沉淀的成分是
(4)该小组欲进一步探究实验 1中白色沉淀产生的原因,实施了实验3:
| 步骤 | 实验操作 | 实验现象 |
| Ⅰ | 向2mL 0.1mol/L的FeCl3溶液中加入0.15g Cu粉 | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 |
| Ⅱ | 取Ⅰ中上层清液于试管中,滴加 1滴 0.1mol/L KSCN溶液 | 有白色沉淀生成,且溶液出现红色 |
| Ⅲ | 振荡Ⅱ中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
②根据实验 3 的现象,小组同学认为 Fe3+与Cu 反应的氧化产物不含Cu(Ⅰ),他们的判断依据是
③步骤Ⅱ中加入KSCN溶液后出现红色的可能原因是
④解释步骤Ⅲ中实验现象产生的可能原因:
【知识点】 铁盐 铁盐与亚铁盐鉴别试剂的选择解读 化学实验探究 物质性质实验方案的设计解读
试卷分析
导出试卷题型(共 22题)
试卷难度
知识点分析
细目表分析
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 催化剂对化学反应速率的影响 影响化学平衡的因素 合成氨条件的选择 | |
| 2 | 0.85 | 可逆反应及反应限度 化学反应进行方向的判据 氢氧燃料电池 | |
| 3 | 0.65 | 化学平衡的有关计算 化学平衡常数的有关计算 化学平衡题中基于图表数据的相关计算 | |
| 4 | 0.65 | 化学反应速率的图像 酸碱中和滴定 溶液稀释时pH的变化图像 | |
| 5 | 0.65 | 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 6 | 0.65 | 乙酸乙酯制备实验 常见气体的制备与收集 化学实验方案的设计与评价 | |
| 7 | 0.65 | 离子反应的发生及书写 离子方程式的书写 离子方程式的正误判断 | |
| 8 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 “位构性”关系理解及应用 | |
| 9 | 0.65 | 限定条件下的离子共存 铵盐与碱反应 铁盐 溶液的酸碱性与pH | |
| 10 | 0.65 | 盐类水解规律理解及应用 溶度积常数与溶解度的关系 化学实验方案的设计与评价 | |
| 11 | 0.85 | 大气污染 水污染 能源开发利用新理念 绿色化学与可持续发展 | |
| 12 | 0.65 | 含碳碳双键物质的性质的推断 羧酸化学性质 | |
| 13 | 0.65 | 有机官能团的性质及结构 含碳碳双键物质的性质的推断 多官能团有机物的结构与性质 | |
| 14 | 0.85 | 有机物分子式的确定 有机官能团的性质及结构 同分异构体的数目的确定 | |
| 15 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 16 | 0.65 | 原电池电极反应式书写 燃料电池 | |
| 二、解答题 | |||
| 17 | 0.65 | 氧化还原反应在生活、生产中的应用 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 20 | 0.65 | 酸碱中和滴定原理的应用 一定物质的量浓度的溶液的配制 物质含量的测定 探究物质组成或测量物质的含量 | 实验探究题 |
| 21 | 0.65 | 化学反应原理综合考查 化学平衡的移动及其影响因素 化学反应条件的控制及优化 电解原理的理解及判断 | 原理综合题 |
| 22 | 0.65 | 铁盐 铁盐与亚铁盐鉴别试剂的选择 化学实验探究 物质性质实验方案的设计 | 实验探究题 |
| 三、填空题 | |||
| 18 | 0.85 | 盐类水解规律理解及应用 影响盐类水解的内因 | |
| 19 | 0.65 | 酸碱中和滴定的综合考查 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |



