名校
解题方法
1 . 回答下列问题:
(1)室温下,2 mol H2完全燃烧生成液态水放出a kJ的能量,写出氢气燃烧热的热化学方程式:_______ 。
(2)甲醇是重要的化工原料,利用合成气(主要成分为CO和H2)在催化剂作用下合成甲醇。其常见合成方法为:CO(g)+2H2(g)=CH3OH(g) ΔH,已知反应①中相关的化学键键能数据如下:
由此计算ΔH =_______ kJ/mol;
(3)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol。
现有H2与CH4的混合气体112 L (标准状况下),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3845.8 kJ,则原混合气体中H2与CH4的物质的量之比是_______ 。
(4)一定条件下,在水溶液中所含离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
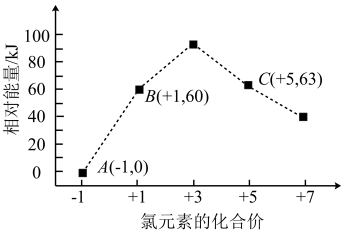
则反应3ClO-(aq) =ClO (aq)+2Cl-(aq)的ΔH=
(aq)+2Cl-(aq)的ΔH=_______ kJ/mol。
(5)乙烷在一定条件可发生反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如表所示:
ΔH=_______ kJ/mol。
(6)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ/mol
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ/mol
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为_______ 。
(7)在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+ O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+ O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3
2S(g)=S2(g) ΔH4,则ΔH4的正确表达式为_______ 。
(1)室温下,2 mol H2完全燃烧生成液态水放出a kJ的能量,写出氢气燃烧热的热化学方程式:
(2)甲醇是重要的化工原料,利用合成气(主要成分为CO和H2)在催化剂作用下合成甲醇。其常见合成方法为:CO(g)+2H2(g)=CH3OH(g) ΔH,已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E /(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
(3)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol。
现有H2与CH4的混合气体112 L (标准状况下),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3845.8 kJ,则原混合气体中H2与CH4的物质的量之比是
(4)一定条件下,在水溶液中所含离子Cl-、ClO-、ClO
 、ClO
、ClO 、ClO
、ClO 各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
则反应3ClO-(aq) =ClO
 (aq)+2Cl-(aq)的ΔH=
(aq)+2Cl-(aq)的ΔH=(5)乙烷在一定条件可发生反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如表所示:
| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热ΔH/(kJ/mol ) | -1560 | -1411 | -286 |
(6)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ/mol
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ/mol
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
(7)在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+
 O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1②2H2S(g)+SO2(g)=
 S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2③H2S(g)+
 O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH32S(g)=S2(g) ΔH4,则ΔH4的正确表达式为
您最近一年使用:0次
解题方法
2 . 完成下列各题
(1)一氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,反应原理为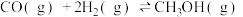
 。若已知CO、
。若已知CO、 、
、 的燃烧热分别为
的燃烧热分别为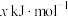 、
、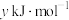 、
、 ,则
,则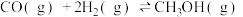

______ 。
(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,其常用单位为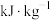 。已知下列物质的燃烧热(25℃、101Kpa):
。已知下列物质的燃烧热(25℃、101Kpa):
据上表数据计算:
①试写出表示辛烷燃烧热的热化学方程式:_______________________________________ 。
② 的热值为
的热值为______ 。(保留3位有效数字)
③上表所列燃料的热值最大的是______________________ (填化学式)。
(3)中和热是反应热的一种。
①取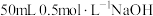 溶液和
溶液和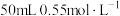 盐酸溶液进行实验,若实验测得的反应前后温度差平均值
盐酸溶液进行实验,若实验测得的反应前后温度差平均值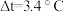 。若近似认为
。若近似认为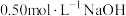 溶液和
溶液和 盐酸溶液的密度都是
盐酸溶液的密度都是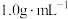 ,中和后生成溶液的比热容
,中和后生成溶液的比热容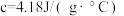 ,则生成
,则生成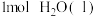 时的反应热
时的反应热
______ (取小数点后一位)。
②强酸与强碱的稀溶液发生中和反应生成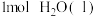 时的反应热
时的反应热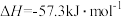 。若用一定浓度的稀硫酸与含10g NaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10g NaOH的稀碱溶液完全反应,反应放出的热量为______ (取小数点后一位)。
(1)一氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,反应原理为
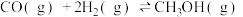
 。若已知CO、
。若已知CO、 、
、 的燃烧热分别为
的燃烧热分别为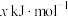 、
、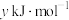 、
、 ,则
,则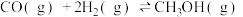

(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,其常用单位为
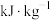 。已知下列物质的燃烧热(25℃、101Kpa):
。已知下列物质的燃烧热(25℃、101Kpa):| 燃料 |  | CO |  | 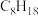 (辛烷) (辛烷) |
燃烧热/ | 285.8 | 283.0 | 890.3 | 5518 |
据上表数据计算:
①试写出表示辛烷燃烧热的热化学方程式:
②
 的热值为
的热值为③上表所列燃料的热值最大的是
(3)中和热是反应热的一种。
①取
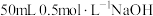 溶液和
溶液和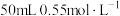 盐酸溶液进行实验,若实验测得的反应前后温度差平均值
盐酸溶液进行实验,若实验测得的反应前后温度差平均值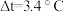 。若近似认为
。若近似认为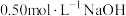 溶液和
溶液和 盐酸溶液的密度都是
盐酸溶液的密度都是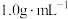 ,中和后生成溶液的比热容
,中和后生成溶液的比热容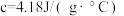 ,则生成
,则生成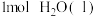 时的反应热
时的反应热
②强酸与强碱的稀溶液发生中和反应生成
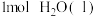 时的反应热
时的反应热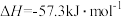 。若用一定浓度的稀硫酸与含10g NaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10g NaOH的稀碱溶液完全反应,反应放出的热量为
您最近一年使用:0次
名校
解题方法
3 . 填空
(1)已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石___ (填“>”或“<”)石墨。
(2)已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1____ (填“>”或“<”)ΔH2。
(3)“嫦娥五号”发射时,用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:________ 。
(4)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热ΔH=____ 。
(5)0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=______ 。
(6)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是________ 。
(1)已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石
(2)已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2;则ΔH1
(3)“嫦娥五号”发射时,用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:
(4)25 ℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热ΔH=
(5)0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=
(6)已知断开1 mol H-H键、1 mol N-H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是
您最近一年使用:0次
2020-12-15更新
|
319次组卷
|
6卷引用:重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题
重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题2015届四川省成都郫县高三第二次阶诊断性考试理综化学试卷河北省安平中学2017-2018学年高一下学期期末考试化学试题1贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题(已下线)第六章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)专题18 化学反应与能量(限时精练)-2022年高三毕业班化学常考点归纳与变式演练
名校
解题方法
4 . 依据事实,写出下列反应的热化学方程式。
(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为________________________________ 。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为________________________________ 。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量, 则表示该反应的热化学方程式为________________________________ 。
(4)H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ·mol-1、282.5 kJ·mol-1、726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇请写出CO与H2反应合成甲醇的热化学方程式_______________________________________________ 。
(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量, 则表示该反应的热化学方程式为
(4)H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ·mol-1、282.5 kJ·mol-1、726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇请写出CO与H2反应合成甲醇的热化学方程式
您最近一年使用:0次
2020-11-24更新
|
145次组卷
|
2卷引用:重庆市复旦中学2020-2021学度高二上学期第一次段考化学试题
名校
解题方法
5 . 能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式:
①H2(g)+ O2(g)= H2O( g) ΔH = - 242kJ/mol;
O2(g)= H2O( g) ΔH = - 242kJ/mol;
②2H2(g)+ O2(g)= 2H2O( l) ΔH= - 572kJ/mol;
③C(s)+ O2(g)=CO (g) ΔH =-110.5 kJ/mol;
O2(g)=CO (g) ΔH =-110.5 kJ/mol;
④C(s)+O2(g)= CO2(g) ΔH=- 393.5 kJ/mol;
⑤CO2(g)+2H2O(g)= CH4(g)+ 2O2( g) ΔH = + 802kJ/mol:
回答下列问题
(1)写出能表示H2燃烧热的热化学方程式___________ ;
(2)已知C(s)+ H2O(g) H2(g)+ CO(g) ΔH =
H2(g)+ CO(g) ΔH =_______ kJ/mol;
(3)估算出C=O键能为____ kJ/mol:
(4)CH4的燃烧热ΔH =_______ kJ/mol:
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开 1L 水所需要的CH4的物质的量为_____ mol[保留到小数点后2位:已知:c(H2O)=4.2J/(g•℃)]。
①H2(g)+
 O2(g)= H2O( g) ΔH = - 242kJ/mol;
O2(g)= H2O( g) ΔH = - 242kJ/mol;②2H2(g)+ O2(g)= 2H2O( l) ΔH= - 572kJ/mol;
③C(s)+
 O2(g)=CO (g) ΔH =-110.5 kJ/mol;
O2(g)=CO (g) ΔH =-110.5 kJ/mol; ④C(s)+O2(g)= CO2(g) ΔH=- 393.5 kJ/mol;
⑤CO2(g)+2H2O(g)= CH4(g)+ 2O2( g) ΔH = + 802kJ/mol:
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| 键能 kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
(1)写出能表示H2燃烧热的热化学方程式
(2)已知C(s)+ H2O(g)
 H2(g)+ CO(g) ΔH =
H2(g)+ CO(g) ΔH =(3)估算出C=O键能为
(4)CH4的燃烧热ΔH =
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开 1L 水所需要的CH4的物质的量为
您最近一年使用:0次
解题方法
6 . 完成下列各题。
(1)在25℃101kPa时,CO在1molO2中恰好完全燃烧,放出851.6kJ的热量。则CO燃烧的热化学方程式为___ 。
(2)同素异形体在一定条件下可以相互转化。已知:
白磷燃烧:P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
红磷燃烧:P(s)+ O2(g)=
O2(g)=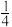 P4O10(s) △H=-738.5kJ/mol
P4O10(s) △H=-738.5kJ/mol
则相同状况下,能量状态较低的是___ ;白磷的稳定性比红磷___ (填“高”或“低”),写出白磷转化为红磷的热化学方程式为___ 。
(3)已知CH4的燃烧热为akJ/mol,断裂1molO=O键时吸收热量bkJ,形成1molH—O键时放出热量ckJ,形成1molC=O键时放出热量dkJ,则C—H键断裂时吸收热量为___ (用abcd表示)。
(1)在25℃101kPa时,CO在1molO2中恰好完全燃烧,放出851.6kJ的热量。则CO燃烧的热化学方程式为
(2)同素异形体在一定条件下可以相互转化。已知:
白磷燃烧:P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
红磷燃烧:P(s)+
 O2(g)=
O2(g)=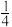 P4O10(s) △H=-738.5kJ/mol
P4O10(s) △H=-738.5kJ/mol则相同状况下,能量状态较低的是
(3)已知CH4的燃烧热为akJ/mol,断裂1molO=O键时吸收热量bkJ,形成1molH—O键时放出热量ckJ,形成1molC=O键时放出热量dkJ,则C—H键断裂时吸收热量为
您最近一年使用:0次
名校
解题方法
7 . 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为_____ mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式______________________________________ 。
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式_______________________________ 。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式
您最近一年使用:0次



