名校
1 . 完成下列填空
(1)已知下列两个热化学方程式: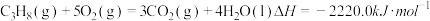 ,
,
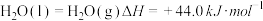 ,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为
,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为___________ kJ
(2)已知:8g的CH4与足量的O2反应,生成CO2和液态水,放出445.15kJ的热量写出表示甲烷燃烧热的热化学方程式:___________ 。
(3)足量H2在1molO2中完全燃烧生成 液态水,放出571.6kJ的热量,
液态水,放出571.6kJ的热量, 的燃烧热ΔH=
的燃烧热ΔH=___________ 。
(4)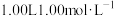 硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出
硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出 的热量,表示其中和热的热化学方程式为
的热量,表示其中和热的热化学方程式为___________ 。
(5)已知: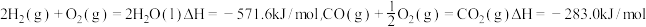 。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为___________ 。
(1)已知下列两个热化学方程式:
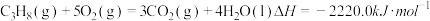 ,
,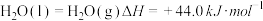 ,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为
,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为(2)已知:8g的CH4与足量的O2反应,生成CO2和液态水,放出445.15kJ的热量写出表示甲烷燃烧热的热化学方程式:
(3)足量H2在1molO2中完全燃烧生成
 液态水,放出571.6kJ的热量,
液态水,放出571.6kJ的热量, 的燃烧热ΔH=
的燃烧热ΔH=(4)
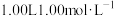 硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出
硫酸与2.00L1.00mol/LNaOH溶液完全反应,放出 的热量,表示其中和热的热化学方程式为
的热量,表示其中和热的热化学方程式为(5)已知:
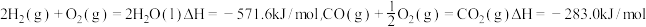 。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
。某H2和CO的混合气体完全燃烧时放出113.84热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
您最近一年使用:0次
2021-12-18更新
|
400次组卷
|
2卷引用:安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题
2 . 以下两个热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220 kJ·mol-1
试回答下列问题:
(1)H2的燃烧热为______ ,C3H8的燃烧热为________ 。
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧所释放的热量为________ 。
(3)现有H2和C3H8的混合气体共1 mol,完全燃烧时放出的热量为769.4 kJ,则在混合气体中H2和C3H8的体积比为________ 。
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220 kJ·mol-1
试回答下列问题:
(1)H2的燃烧热为
(2)1 mol H2和2 mol C3H8组成的混合气体完全燃烧所释放的热量为
(3)现有H2和C3H8的混合气体共1 mol,完全燃烧时放出的热量为769.4 kJ,则在混合气体中H2和C3H8的体积比为
您最近一年使用:0次
3 . 甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
(1)甲醇蒸汽完全燃烧的热化学方程式为_____________ 。
(2)反应②中的能量变化如下图所示,则△H2=______ (用E1和E2表示)。

(3)H2(g)的燃烧热为__________ kJ· mol-1。
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:__________________ (写出一点)
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1(1)甲醇蒸汽完全燃烧的热化学方程式为
(2)反应②中的能量变化如下图所示,则△H2=

(3)H2(g)的燃烧热为
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:
您最近一年使用:0次
2020-01-12更新
|
182次组卷
|
8卷引用:2015-2016学年安徽省阜阳市太和八中高二上学期期末理化学试卷
解题方法
4 . 能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是___ (填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能 e.天然气 f.氢能
(2)甲烷裂解法制取乙炔反应的化学方程式为2CH4(g) C2H2(g)+3H2(g)。
C2H2(g)+3H2(g)。
①已知下列化学键的键能数据:
则反应2CH4(g) C2H2(g)+3H2(g)的△H=
C2H2(g)+3H2(g)的△H=___ kJ·mol-1。
②燃烧agCH4生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的CO2与足量澄清石灰水反应得到5g沉淀,则CH4(g)+2O2(g) CO2(g)+2H2O(l)△H1=
CO2(g)+2H2O(l)△H1=___ kJ·mol-1,a=___ 。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨的稳定性较大的是___ (填“金刚石”或“石墨”);石墨的燃烧热为___ kJ·mol-1。
②12g石墨在-定量空气中燃烧,生成36g气体,该过程放出的热量为___ kJ。
(1)下列不属于新能源的是
a.煤炭 b.太阳能 c.风能 d.地热能 e.天然气 f.氢能
(2)甲烷裂解法制取乙炔反应的化学方程式为2CH4(g)
 C2H2(g)+3H2(g)。
C2H2(g)+3H2(g)。①已知下列化学键的键能数据:
| 共价键 | C H | H H | C C |
| 键能/(kJ·mol-1) | 413.4 | 436 | 812 |
 C2H2(g)+3H2(g)的△H=
C2H2(g)+3H2(g)的△H=②燃烧agCH4生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的CO2与足量澄清石灰水反应得到5g沉淀,则CH4(g)+2O2(g)
 CO2(g)+2H2O(l)△H1=
CO2(g)+2H2O(l)△H1=(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨的稳定性较大的是
②12g石墨在-定量空气中燃烧,生成36g气体,该过程放出的热量为
您最近一年使用:0次
5 . 已知下列反应:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1,Na2O2(s)+CO2(g)=Na2CO3(s)+  O2(g) ΔH=-266kJ·mol-1,试回答:
O2(g) ΔH=-266kJ·mol-1,试回答:
(1)CO的燃烧热ΔH=_______________ 。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:________ 。
(3)工业废气中的CO2可用碱液吸收,所发生的反应如下:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1,CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-bkJ·mol-1,则:
①CO2(g)+H2O(l)+Na2CO3(aq)=2NaHCO3(aq)的ΔH=________ kJ·mol-1(用含a、b的代数式表示)。
②标况下,11.2LCO2与足量的NaOH溶液充分反应后,放出的热量为_______ kJ(用含a或b的代数式表示)。
(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)= 2SO2 (g) +2H2O (l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= 2S (s) +2H2O (l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)=2 S (s) +2H2O (g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是____ 。
 O2(g) ΔH=-266kJ·mol-1,试回答:
O2(g) ΔH=-266kJ·mol-1,试回答:(1)CO的燃烧热ΔH=
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:
(3)工业废气中的CO2可用碱液吸收,所发生的反应如下:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1,CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-bkJ·mol-1,则:
①CO2(g)+H2O(l)+Na2CO3(aq)=2NaHCO3(aq)的ΔH=
②标况下,11.2LCO2与足量的NaOH溶液充分反应后,放出的热量为
(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)= 2SO2 (g) +2H2O (l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= 2S (s) +2H2O (l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)=2 S (s) +2H2O (g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是
您最近一年使用:0次
2019-09-21更新
|
480次组卷
|
5卷引用:安徽省桐城市天城中学2019-2020学年高二上学期段考化学试题
安徽省桐城市天城中学2019-2020学年高二上学期段考化学试题辽宁省阜新市第二高级中学2019-2020学年高二上学期第一次月考化学试题(已下线)1.3.2 反应热的计算(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)【南昌新东方】9.湾里一中 梁莎(已下线)第1章 化学反应与能量(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)
6 . 氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为________________
②该反应的热化学方程式为_____________________
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2=____________ kJ·mol-1。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为
②该反应的热化学方程式为
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2=
您最近一年使用:0次
2018-10-02更新
|
274次组卷
|
4卷引用:安徽省池州市江南中学2021届高三12月月考(三调)化学试题
名校
7 . 已知:①2H2(g)+O2(g)=2H2O(l) △H=-572kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
③CH4(g)+2O2(g)=2H2O(l)+CO2(g) △H=-890kJ/mol
(1)已知H-H的键能436kJ/molO=O的键能496kJ/molH-O的键能463kJ/mol,根据上述数据计算①②哪一个反应可以通过键能直接计算得出_____________ 。并计算写出反应 H2O ( l ) = H2O ( g )的焓变△H=__________ 。
(2)请根据题干计算CO2(g)+4H2(g) =CH4(g) +2H2O(g)的焓变△H=__________ 。
(3)在①②③三个方程式中哪一个是燃烧热的热化学方程式________ 。(填反应方程式的序号)标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为263.8kJ,试求混合气体中甲烷和氢气体积比_______________ 。
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
③CH4(g)+2O2(g)=2H2O(l)+CO2(g) △H=-890kJ/mol
(1)已知H-H的键能436kJ/molO=O的键能496kJ/molH-O的键能463kJ/mol,根据上述数据计算①②哪一个反应可以通过键能直接计算得出
(2)请根据题干计算CO2(g)+4H2(g) =CH4(g) +2H2O(g)的焓变△H=
(3)在①②③三个方程式中哪一个是燃烧热的热化学方程式
您最近一年使用:0次
2016-12-09更新
|
524次组卷
|
4卷引用:安徽省宿州市十三所重点中学2022-2023学年高二上学期期中质量检测化学试题
11-12高二下·安徽·阶段练习
解题方法
8 . 已知下列热化学方程式:
①2H2(g) +O2(g)=2H2O(l) ΔH=-570 kJ·mol-1
②2H2(g) +O2(g)=2H2O(g) ΔH=-483.68 kJ·mol-1
③2C(s) +O2(g)=2CO(g) ΔH=-221 kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
回答下列问题:
(1)H2的燃烧热为_______ ;C的燃烧热为_______ 。
(2)燃烧10gH2生成液态水,放出的热量为_______ 。
(3)写出CO燃烧的热化学方程式_______ 。
①2H2(g) +O2(g)=2H2O(l) ΔH=-570 kJ·mol-1
②2H2(g) +O2(g)=2H2O(g) ΔH=-483.68 kJ·mol-1
③2C(s) +O2(g)=2CO(g) ΔH=-221 kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
回答下列问题:
(1)H2的燃烧热为
(2)燃烧10gH2生成液态水,放出的热量为
(3)写出CO燃烧的热化学方程式
您最近一年使用:0次



