1 . 乙醇是一种清洁替代能源,催化加氢制备乙醇技术是当前的研究热点。
(1) 催化加氢制备乙醇的反应为
催化加氢制备乙醇的反应为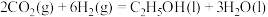
①若要计算上述反应的 ,须查阅的两个数据是
,须查阅的两个数据是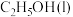 的燃烧热和
的燃烧热和__________ ,该反应的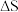
__________ (填“>”“<”或“=”)0;
②某金属有机骨架负载的铜基催化剂上, 加氢生成
加氢生成 的部分反应机理如图所示;
的部分反应机理如图所示; 过程中两个
过程中两个 均参与反应,X的结构式为
均参与反应,X的结构式为__________ (填标号)。
反应I:
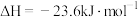
反应Ⅱ:
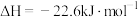
在其他条件不变时,将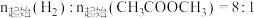 的混合气体以一定流速通入装有铜基催化剂的反应管,测得
的混合气体以一定流速通入装有铜基催化剂的反应管,测得 转化率、
转化率、 选择性
选择性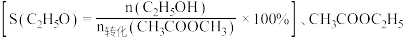 选择性
选择性
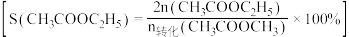 随温度的变化如图所示.
随温度的变化如图所示. 与
与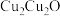 的晶胞如图所示(立方体),
的晶胞如图所示(立方体), 晶体的密度可表示为
晶体的密度可表示为__________  (用含
(用含 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。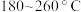 下均有
下均有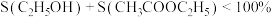 ,其原因是
,其原因是__________ ;
③ 范围内,
范围内, 转化率随温度升高而迅速增大的主要原因是
转化率随温度升高而迅速增大的主要原因是__________ ;
④温度高于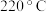 时,催化剂的催化活性下降,其原因可能是
时,催化剂的催化活性下降,其原因可能是__________ 。
(3)一定条件下,在 密闭容器内通入
密闭容器内通入 和
和 发生反应I和Ⅱ,测得
发生反应I和Ⅱ,测得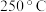 下达到平衡时
下达到平衡时 转化率为
转化率为 ,乙醇选择性为
,乙醇选择性为 .
.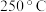 时,反应1的平衡常数
时,反应1的平衡常数
__________ 。
(1)
 催化加氢制备乙醇的反应为
催化加氢制备乙醇的反应为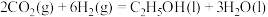
①若要计算上述反应的
 ,须查阅的两个数据是
,须查阅的两个数据是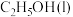 的燃烧热和
的燃烧热和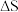
②某金属有机骨架负载的铜基催化剂上,
 加氢生成
加氢生成 的部分反应机理如图所示;
的部分反应机理如图所示;
 过程中两个
过程中两个 均参与反应,X的结构式为
均参与反应,X的结构式为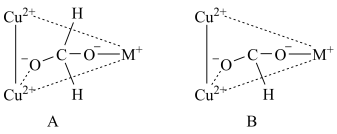
反应I:

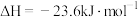
反应Ⅱ:

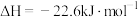
在其他条件不变时,将
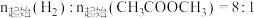 的混合气体以一定流速通入装有铜基催化剂的反应管,测得
的混合气体以一定流速通入装有铜基催化剂的反应管,测得 转化率、
转化率、 选择性
选择性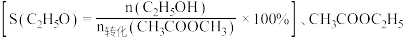 选择性
选择性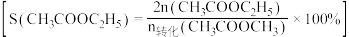 随温度的变化如图所示.
随温度的变化如图所示.
 与
与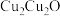 的晶胞如图所示(立方体),
的晶胞如图所示(立方体), 晶体的密度可表示为
晶体的密度可表示为 (用含
(用含 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。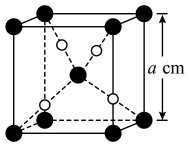
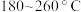 下均有
下均有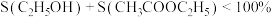 ,其原因是
,其原因是③
 范围内,
范围内, 转化率随温度升高而迅速增大的主要原因是
转化率随温度升高而迅速增大的主要原因是④温度高于
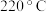 时,催化剂的催化活性下降,其原因可能是
时,催化剂的催化活性下降,其原因可能是(3)一定条件下,在
 密闭容器内通入
密闭容器内通入 和
和 发生反应I和Ⅱ,测得
发生反应I和Ⅱ,测得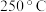 下达到平衡时
下达到平衡时 转化率为
转化率为 ,乙醇选择性为
,乙醇选择性为 .
.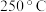 时,反应1的平衡常数
时,反应1的平衡常数
您最近一年使用:0次
2 . 生产、生活中的化学反应都伴随着能量的变化。回答下列问题:
(1) 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下:
 ,则常温下,
,则常温下, (单斜)与
(单斜)与 (斜方)中较稳定的是
(斜方)中较稳定的是______ [填“ (单斜)”或“
(单斜)”或“ (斜方)”]
(斜方)”]
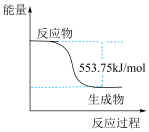
(2)丙烷( )常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成
)常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成 和
和 过程中的能量变化图。写出丙烷燃烧的热化学方程式:
过程中的能量变化图。写出丙烷燃烧的热化学方程式:______ ,丙烷的燃烧热( )为
)为_____ 。
(3)水煤气是由 和
和 组成的混合气体,在工业上常用作燃料。已知:
组成的混合气体,在工业上常用作燃料。已知: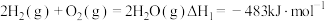 ;
; 。现取
。现取 (标准状况)水煤气,使其完全燃烧生成
(标准状况)水煤气,使其完全燃烧生成 和
和 ,测得反应共放热
,测得反应共放热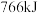 ,则水煤气中
,则水煤气中 与
与 的物质的量之比是
的物质的量之比是___ 。
(4)盖斯定律:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。
①反应 分两步进行:
分两步进行:
(ⅰ)
(ⅱ)
下列示意图中,能正确表示总反应过程中能量变化的是___ (填字母)。
A.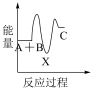 B.
B. 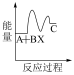 C.
C. 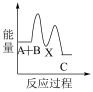 D.
D.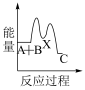
②已知:
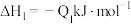

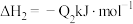


若将 液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为___  (用含
(用含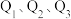 的代数式表示)。
的代数式表示)。
(5)下表中的数据表示断裂 化学键需消耗的能量(即键能,单位为
化学键需消耗的能量(即键能,单位为 ):
):
热化学方程式: ,则
,则 键的键能为
键的键能为______  。
。
(1)
 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下:
 ,则常温下,
,则常温下, (单斜)与
(单斜)与 (斜方)中较稳定的是
(斜方)中较稳定的是 (单斜)”或“
(单斜)”或“ (斜方)”]
(斜方)”](2)丙烷(
 )常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成
)常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成 和
和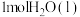 过程中的能量变化图。写出丙烷燃烧的热化学方程式:
过程中的能量变化图。写出丙烷燃烧的热化学方程式: )为
)为
(3)水煤气是由
 和
和 组成的混合气体,在工业上常用作燃料。已知:
组成的混合气体,在工业上常用作燃料。已知: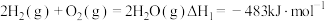 ;
; 。现取
。现取 (标准状况)水煤气,使其完全燃烧生成
(标准状况)水煤气,使其完全燃烧生成 和
和 ,测得反应共放热
,测得反应共放热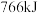 ,则水煤气中
,则水煤气中 与
与 的物质的量之比是
的物质的量之比是(4)盖斯定律:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。
①反应
 分两步进行:
分两步进行:(ⅰ)

(ⅱ)

下列示意图中,能正确表示总反应过程中能量变化的是
A.
 B.
B.  C.
C.  D.
D.
②已知:

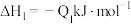

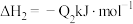


若将
 液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 (用含
(用含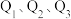 的代数式表示)。
的代数式表示)。(5)下表中的数据表示断裂
 化学键需消耗的能量(即键能,单位为
化学键需消耗的能量(即键能,单位为 ):
):| 化学键 |  |  |
| 键能 | 436 | 431 |
 ,则
,则 键的键能为
键的键能为 。
。
您最近一年使用:0次
名校
3 . 我国向世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳捕捉和碳利用技术则是关键,其中 催化加氢合成甲酸(反应为:
催化加氢合成甲酸(反应为: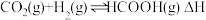 )是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
)是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
(1)已知: 时,部分物质的相对能量如表所示。
时,部分物质的相对能量如表所示。
则
_________  ,此条件下
,此条件下 的燃烧热
的燃烧热
________ (填“大于”、“小于”或“等于”) 的燃烧热
的燃烧热 。
。
(2) 催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
(3)恒容密闭容器中充入一定量的 和
和 去合成
去合成 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填选项字母)。
时刻达到平衡状态的是___________(填选项字母)。
(4)恒温、恒容的密闭容器中充入 ,
,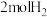 和
和 (不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
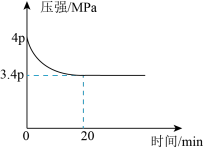
① ,用
,用 表示的化学反应速率为
表示的化学反应速率为___________ 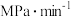 ;
;
②此反应的分压平衡常数
___________ ( 为以分压表示的平衡常数,
为以分压表示的平衡常数,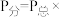 物质的量分数;用含P的式子表示)。
物质的量分数;用含P的式子表示)。
 催化加氢合成甲酸(反应为:
催化加氢合成甲酸(反应为: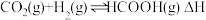 )是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
)是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:(1)已知:
 时,部分物质的相对能量如表所示。
时,部分物质的相对能量如表所示。| 物质 |  |  |  |
相对能量/( ) ) |  | 0 |  |

 ,此条件下
,此条件下 的燃烧热
的燃烧热
 的燃烧热
的燃烧热 。
。(2)
 催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。A.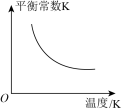 | B.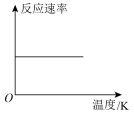 | C.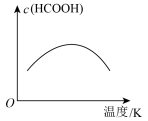 | D. |
(3)恒容密闭容器中充入一定量的
 和
和 去合成
去合成 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填选项字母)。
时刻达到平衡状态的是___________(填选项字母)。A.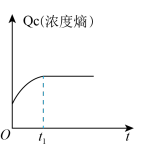 | B. | C. | D. |
(4)恒温、恒容的密闭容器中充入
 ,
, 和
和 (不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
①
 ,用
,用 表示的化学反应速率为
表示的化学反应速率为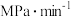 ;
;②此反应的分压平衡常数

 为以分压表示的平衡常数,
为以分压表示的平衡常数,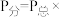 物质的量分数;用含P的式子表示)。
物质的量分数;用含P的式子表示)。
您最近一年使用:0次
名校
4 . 已知X、Y、Z、W、R、M为原子序数依次增大的元素,其中X、Y、Z、W、R为短周期主族元素,且位于三个不同周期,Y的某种核素可用于测定文物的年代,W的最外层电子数是最内层的3倍,W与R同主族,元素M是地壳中含量排名第二的金属元素。回答下列问题:
(1)写出 的电子式:
的电子式:_____ 。
(2)W的简单氢化物的熔沸点比R的高,原因是_____ 。
(3)Y、Z、R的最高价氧化物对应水化物的酸性最弱的是_____ (填化学式)。
X、Y、Z、R组成的某种酸的水溶液可用于检测溶液中的 ,该酸的化学式为
,该酸的化学式为_____ 。
(4)X、Y、W组成的某种常见物质常用于制作消毒剂,该物质的燃烧热为1366.8 ,写出该物质燃烧的热化学方程式:
,写出该物质燃烧的热化学方程式:_____ 。
(5) 与
与 的反应是可逆反应,该反应的平衡常数的表达式为
的反应是可逆反应,该反应的平衡常数的表达式为_____ ;增加 的量,
的量, 的平衡转化率如何变化?
的平衡转化率如何变化?_____ 。
(1)写出
 的电子式:
的电子式:(2)W的简单氢化物的熔沸点比R的高,原因是
(3)Y、Z、R的最高价氧化物对应水化物的酸性最弱的是
X、Y、Z、R组成的某种酸的水溶液可用于检测溶液中的
 ,该酸的化学式为
,该酸的化学式为(4)X、Y、W组成的某种常见物质常用于制作消毒剂,该物质的燃烧热为1366.8
 ,写出该物质燃烧的热化学方程式:
,写出该物质燃烧的热化学方程式:(5)
 与
与 的反应是可逆反应,该反应的平衡常数的表达式为
的反应是可逆反应,该反应的平衡常数的表达式为 的量,
的量, 的平衡转化率如何变化?
的平衡转化率如何变化?
您最近一年使用:0次
5 . 含碳化合物是环境、能源科学研究的热点。
已知:①
②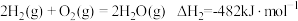
键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。几种共价键的键能如下:
回答下列问题:
(1)CO(g)的燃烧热
___________  。
。
(2)a=___________ ,b=___________ 。
(3)已知 ,下图中
,下图中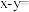
___________ 。
(4)2.24L(标准状况)CO和H2的混合气体在氧气中完全反应生成CO2(g)、H2O(g),放出的热量可能是___________(填字母)。
(5)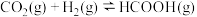 的速率方程
的速率方程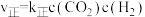 ,
, ,其中k为速率常数,与温度、催化剂有关,k的经验公式为
,其中k为速率常数,与温度、催化剂有关,k的经验公式为 (R和C为常数,
(R和C为常数, 为活化能,T为温度)。在催化剂作用下,
为活化能,T为温度)。在催化剂作用下, 与
与 的关系如图所示:
的关系如图所示:
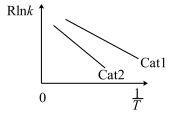
①催化效率较高的是___________ (填“Cat1”或“Cat2”),判断依据是___________ 。
②该反应的平衡常数表达式为___________ 。某温度下,平衡常数K为2, 为5,则
为5,则 为
为___________ 。
已知:①

②
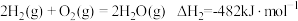
键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。几种共价键的键能如下:
| 共价键 | C—C | O=O | C—H | C=O | H—H | H—O |  |
键能/( ) ) | 343 | a | 413 | b | 436 | 465 | 1076 |
(1)CO(g)的燃烧热

 。
。(2)a=
(3)已知
 ,下图中
,下图中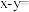

(4)2.24L(标准状况)CO和H2的混合气体在氧气中完全反应生成CO2(g)、H2O(g),放出的热量可能是___________(填字母)。
| A.28.8kJ | B.24.1kJ | C.26.6kJ | D.24.2kJ |
(5)
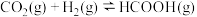 的速率方程
的速率方程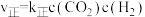 ,
, ,其中k为速率常数,与温度、催化剂有关,k的经验公式为
,其中k为速率常数,与温度、催化剂有关,k的经验公式为 (R和C为常数,
(R和C为常数, 为活化能,T为温度)。在催化剂作用下,
为活化能,T为温度)。在催化剂作用下, 与
与 的关系如图所示:
的关系如图所示:
①催化效率较高的是
②该反应的平衡常数表达式为
 为5,则
为5,则 为
为
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D、E为原子序数依次增大的短周期主族元素,其中A原子的最外层电子数是电子层数的2倍,各元素在周期表中的相对位置如图所示:
请回答下列问题:
(1)B在元素周期表中的位置为___________ 。
(2)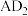 属于火车严禁携带的易燃易爆液体,已知
属于火车严禁携带的易燃易爆液体,已知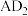 的燃烧热
的燃烧热 为
为 ,写出表示
,写出表示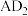 燃烧热的热化学方程式:
燃烧热的热化学方程式:___________ 。
(3)D、E的最高价氧化物对应水化物的酸性由强到弱的顺序为___________ (用化学式表示),结合元素周期律解释其原因:___________ 。
(4)最新合成的 分子结构完美对称(只含单键),具有极强的热稳定性和化学惰性,试画出
分子结构完美对称(只含单键),具有极强的热稳定性和化学惰性,试画出 的结构式:
的结构式:___________ 。
| A | B | C | |
| D | E |
(1)B在元素周期表中的位置为
(2)
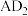 属于火车严禁携带的易燃易爆液体,已知
属于火车严禁携带的易燃易爆液体,已知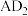 的燃烧热
的燃烧热 为
为 ,写出表示
,写出表示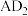 燃烧热的热化学方程式:
燃烧热的热化学方程式:(3)D、E的最高价氧化物对应水化物的酸性由强到弱的顺序为
(4)最新合成的
 分子结构完美对称(只含单键),具有极强的热稳定性和化学惰性,试画出
分子结构完美对称(只含单键),具有极强的热稳定性和化学惰性,试画出 的结构式:
的结构式:
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(l) △H=-285.8 kJ/mol
O2(g)=H2O(l) △H=-285.8 kJ/mol
②H2(g)+ O2(g)=H2O(l) △H=-241.8 kJ/mol
O2(g)=H2O(l) △H=-241.8 kJ/mol
③C(s)+ O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
回答下列问题:
(1)碳的燃烧热的热化学方程式为_______ (填序号)。
(2)燃烧1 g H2 (g)生成液态水,放出的热量为_______ 。
Ⅱ.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol。
(3)下列各组试剂混合发生反应的离子方程式为H++OH-=H2O的是_______ (填序号)。
A.盐酸与氢氧化钠溶液
B.稀硫酸与氢氧化钡溶液
C.醋酸与氢氧化钠固体
D.硫酸氢钠溶液与氢氧化钠溶液
E.氢氧化镁溶于稀盐酸
(4)若稀硫酸与氢氧化钠固体反应生成1 mol H2O(l),则反应放出的热量_______ (填“大于”“等于”或“小于”)57.3 kJ,原因是_______ 。
Ⅲ.已知:
①H2(g)+ O2(g)=H2O(l) △H1=-285.8 kJ/mol
O2(g)=H2O(l) △H1=-285.8 kJ/mol
②C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H2=-2219.9 kJ/mol
(5)在25℃和101 kPa下,H2和C3H8的混合气体5 mol完全燃烧生成CO2和液态水,放出6264.25kJ的热量。该混合气体中H2和C3H8的体积之比为_______ 。
(6)已知 H2O(l)=H2O(g) △H3=+44.0kJ/mol。写出C3H8燃烧生成CO2和水蒸气的热化学方程式:_______ 。
①H2(g)+
 O2(g)=H2O(l) △H=-285.8 kJ/mol
O2(g)=H2O(l) △H=-285.8 kJ/mol ②H2(g)+
 O2(g)=H2O(l) △H=-241.8 kJ/mol
O2(g)=H2O(l) △H=-241.8 kJ/mol ③C(s)+
 O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol ④C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
回答下列问题:
(1)碳的燃烧热的热化学方程式为
(2)燃烧1 g H2 (g)生成液态水,放出的热量为
Ⅱ.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol。
(3)下列各组试剂混合发生反应的离子方程式为H++OH-=H2O的是
A.盐酸与氢氧化钠溶液
B.稀硫酸与氢氧化钡溶液
C.醋酸与氢氧化钠固体
D.硫酸氢钠溶液与氢氧化钠溶液
E.氢氧化镁溶于稀盐酸
(4)若稀硫酸与氢氧化钠固体反应生成1 mol H2O(l),则反应放出的热量
Ⅲ.已知:
①H2(g)+
 O2(g)=H2O(l) △H1=-285.8 kJ/mol
O2(g)=H2O(l) △H1=-285.8 kJ/mol②C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H2=-2219.9 kJ/mol
(5)在25℃和101 kPa下,H2和C3H8的混合气体5 mol完全燃烧生成CO2和液态水,放出6264.25kJ的热量。该混合气体中H2和C3H8的体积之比为
(6)已知 H2O(l)=H2O(g) △H3=+44.0kJ/mol。写出C3H8燃烧生成CO2和水蒸气的热化学方程式:
您最近一年使用:0次
2022-10-16更新
|
198次组卷
|
5卷引用:安徽省名校联盟2022-2023学年高二上学期阶段测试(一)化学试题
安徽省名校联盟2022-2023学年高二上学期阶段测试(一)化学试题安徽省合肥市肥西县2022-2023学年高二上学期10月月考化学试题河南省名校联盟2022-2023学年高二上学期阶段测试(一)化学试题(已下线)河南省实验中学2023-2024学年高二上学期开学考试化学试题河南省实验中学2023-2024学年高二上学期开学考试化学试题
8 . (Ⅰ)请回答下列问题:
(1)在101kPa时,一定量的CO在1.00mol O2中完全燃烧,生成2.00mol CO2,放出566.0kJ热量,CO的燃烧热为ΔH=_______ ,表示CO燃烧热的热化学方程式_______ 。
(Ⅱ)试分别从能量变化和化学键变化角度研究反应2H2(g)+O2(g)=2H2O(l)的焓变。
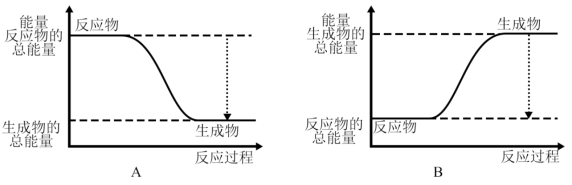
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是_______ 。
(3)从断键和成键的角度分析上述反应中能量的变化。已知化学键的键能:
由此计算2mol H2在氧气中完全燃烧生成气态水放出的热量_______ 。
(Ⅲ)依据盖斯定律回答下列问题:
已知火箭发射时可用肼(N2H4)作燃料,二氧化氮作氧化剂,这两者反应生成氮气和水蒸气。
且N2(g)+2O2(g)=2NO2(g);ΔH1=+67.7kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH2=-534kJ/mol ②
(4)写出肼与NO2反应的热应化学方程式_______ 。
(1)在101kPa时,一定量的CO在1.00mol O2中完全燃烧,生成2.00mol CO2,放出566.0kJ热量,CO的燃烧热为ΔH=
(Ⅱ)试分别从能量变化和化学键变化角度研究反应2H2(g)+O2(g)=2H2O(l)的焓变。
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是

(3)从断键和成键的角度分析上述反应中能量的变化。已知化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能/kJ·mol-1 | 436 | 496 | 463 |
(Ⅲ)依据盖斯定律回答下列问题:
已知火箭发射时可用肼(N2H4)作燃料,二氧化氮作氧化剂,这两者反应生成氮气和水蒸气。
且N2(g)+2O2(g)=2NO2(g);ΔH1=+67.7kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH2=-534kJ/mol ②
(4)写出肼与NO2反应的热应化学方程式
您最近一年使用:0次
解题方法
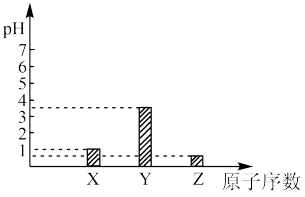
9 . W、X、Y、Z、M是五种原子序数依次增大的短周期主族元素,位于三个不同周期,其中Y、Z、M位于同周期,X、Y位于同主族,常温下,0.1mol/L X、Y、Z的最高价氧化物对应的水化物的pH如图所示:
回答下列问题:
(1)写出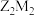 的电子式:
的电子式:_______ 。通过置换反应可证明非金属性: ,该置换反应的离子方程式为
,该置换反应的离子方程式为_______ (写一种即可)。
(2)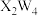 常用作火箭高能燃料,
常用作火箭高能燃料,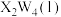 的燃烧热
的燃烧热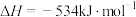 ,则
,则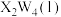 燃烧的热化学方程式为
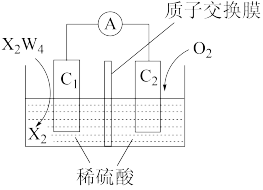
燃烧的热化学方程式为_______ 。若以如图所示燃料电池为电源进行粗铜精炼,粗铜应该与_______ (填“ ”或“
”或“ ”)极相连,
”)极相连, 极的电极反应式为
极的电极反应式为_______ 。
(3)M的单质是重要的化工原料,通常可以利用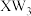 检验盛有M单质的仪器是否漏气,若漏气可产生白烟,该反应中
检验盛有M单质的仪器是否漏气,若漏气可产生白烟,该反应中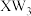 体现的化学性质是
体现的化学性质是_______ 。
(4)常温下,向Y的最高价氧化物对应的水化物溶液中滴加NaOH溶液,含Y微粒的分布分数δ与溶液pH的关系如图所示。
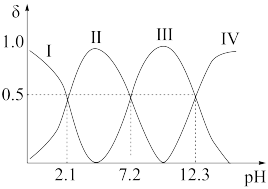
①Ⅲ代表的微粒符号为_______ 。
② 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与 按物质的量之比
按物质的量之比 混合时,溶液中含
混合时,溶液中含 的两种最主要离子的浓度大小关系为
的两种最主要离子的浓度大小关系为_______ (只考虑这两种主要离子的电离和水解)。

回答下列问题:
(1)写出
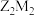 的电子式:
的电子式: ,该置换反应的离子方程式为
,该置换反应的离子方程式为(2)
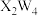 常用作火箭高能燃料,
常用作火箭高能燃料,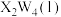 的燃烧热
的燃烧热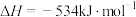 ,则
,则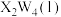 燃烧的热化学方程式为
燃烧的热化学方程式为 ”或“
”或“ ”)极相连,
”)极相连, 极的电极反应式为
极的电极反应式为
(3)M的单质是重要的化工原料,通常可以利用
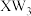 检验盛有M单质的仪器是否漏气,若漏气可产生白烟,该反应中
检验盛有M单质的仪器是否漏气,若漏气可产生白烟,该反应中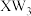 体现的化学性质是
体现的化学性质是(4)常温下,向Y的最高价氧化物对应的水化物溶液中滴加NaOH溶液,含Y微粒的分布分数δ与溶液pH的关系如图所示。

①Ⅲ代表的微粒符号为
②
 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与 按物质的量之比
按物质的量之比 混合时,溶液中含
混合时,溶液中含 的两种最主要离子的浓度大小关系为
的两种最主要离子的浓度大小关系为
您最近一年使用:0次
10 . 2020年9月在第75届联合国大会上,我国首次明确给出碳中和时间表,碳氧化物的综合利用是实现碳中和目标的重要手段。合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇的主要反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(1) ΔH1=a kJ·mol-1
CH3OH(g)+H2O(1) ΔH1=a kJ·mol-1
②CO2(g)+2H2(g) CH3OH(g)+
CH3OH(g)+ O2(g) ΔH2=b kJ·mol-1
O2(g) ΔH2=b kJ·mol-1
③CH3OH(g) CH3OH(l) ΔH3=c kJ·mol-1
CH3OH(l) ΔH3=c kJ·mol-1
回答下列问题:
(1)写出甲醇燃烧热的热化学方程式_______ (反应热用含a、b、c的代数式表示)。
(2)已知在一定温度下2H2(g)+CO(g) CH3OH(g),在3个体积相同的恒容密闭容器中反应并达到平衡,下列说法正确的是_______。
CH3OH(g),在3个体积相同的恒容密闭容器中反应并达到平衡,下列说法正确的是_______。
(3)已知图1为CO2(g)+3H2(g) CH3OH(g)+H2O(g)反应过程与能量曲线,该反应为
CH3OH(g)+H2O(g)反应过程与能量曲线,该反应为_______ 反应(填“吸热”或“放热”)。已知Cat.1与Cat.2为该反应的两种不同的催化剂,则从图象看,在相同温度下_______ (填“Cat.1”或“Cat.2”)的催化效率更高,其原因是_______ 。
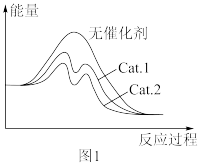
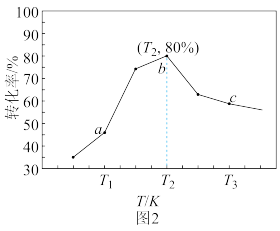
(4)若合成气中初始浓度c0(H2)=1 mol·L-1,c0(CO2)=n mol·L-1时,CO2(g)+3H2(g) CH3OH(g)+H2O(g)反应中CO2的转化率(α)与温度(T)的关系如图2所示。当温度为T2时该反应达到平衡,则平衡常数K=
CH3OH(g)+H2O(g)反应中CO2的转化率(α)与温度(T)的关系如图2所示。当温度为T2时该反应达到平衡,则平衡常数K=_______ (用含n的代数式表示),随着温度进一步升高,CO2转化率下降的可能原因是_______ 。
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(1) ΔH1=a kJ·mol-1
CH3OH(g)+H2O(1) ΔH1=a kJ·mol-1②CO2(g)+2H2(g)
 CH3OH(g)+
CH3OH(g)+ O2(g) ΔH2=b kJ·mol-1
O2(g) ΔH2=b kJ·mol-1③CH3OH(g)
 CH3OH(l) ΔH3=c kJ·mol-1
CH3OH(l) ΔH3=c kJ·mol-1回答下列问题:
(1)写出甲醇燃烧热的热化学方程式
(2)已知在一定温度下2H2(g)+CO(g)
 CH3OH(g),在3个体积相同的恒容密闭容器中反应并达到平衡,下列说法正确的是_______。
CH3OH(g),在3个体积相同的恒容密闭容器中反应并达到平衡,下列说法正确的是_______。| 容器 | 温度/K | 物质的起始浓度mol·L-1 | 物质的平衡浓度mol·L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| I | 400 | 0.20 | 0.10 | 0 | 0.080 |
| II | 400 | 0.40 | 0.20 | 0 | |
| III | 500 | 0 | 0 | 0.10 | 0.025 |
| A.该反应的正反应为吸热反应 |
| B.达到平衡时,容器I中压强是容器II中的一半 |
| C.达到平衡时,容器II中c(CH3OH)大于容器I中c(CH3OH)的两倍 |
| D.达到平衡时,容器II中的正反应速率比容器I中的大 |
 CH3OH(g)+H2O(g)反应过程与能量曲线,该反应为
CH3OH(g)+H2O(g)反应过程与能量曲线,该反应为
(4)若合成气中初始浓度c0(H2)=1 mol·L-1,c0(CO2)=n mol·L-1时,CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)反应中CO2的转化率(α)与温度(T)的关系如图2所示。当温度为T2时该反应达到平衡,则平衡常数K=
CH3OH(g)+H2O(g)反应中CO2的转化率(α)与温度(T)的关系如图2所示。当温度为T2时该反应达到平衡,则平衡常数K=
您最近一年使用:0次



