名校
解题方法
1 . 写出或完成下列热化学方程式。
(1)下列变化过程,属于放热反应的是_______ 。
①浓 稀释;②酸碱中和反应:③
稀释;②酸碱中和反应:③ 在
在 中燃烧;④
中燃烧;④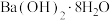 与
与 ;⑤铝热反应:⑧碳高温条件下还原
;⑤铝热反应:⑧碳高温条件下还原 ;⑦碳酸钙分解
;⑦碳酸钙分解
(2)已知:①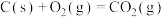
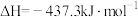
②
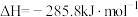
③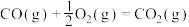
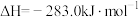
则固态碳和水蒸气反应生成CO和 的热化学方程式为
的热化学方程式为_______ 。
(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
根据键能数据估算下列反应: 的反应热
的反应热 为
为_______ 。
(4)已知稀溶液中,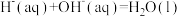
 。
。
①则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量比57.3kJ_______ (填“大”“小”)。若选用硫酸和氢氧化钡的稀溶液做中和热测定实验(操作无误),测定结果
_______ 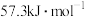 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②某化学兴趣小组用50mL 盐酸、50mL
盐酸、50mL  NaOH溶液进行中和热测定,计算结果
NaOH溶液进行中和热测定,计算结果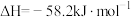 ,其原因可能是:
,其原因可能是:_______ 。
A.盐酸与NaOH溶液混合后立即记录温度
B.分三次将盐酸溶液缓慢倒入NaOH溶液中
C.用量筒量取NaOH溶液时仰视读数
D.使用环形玻璃棒搅拌
③标准状况下,3.36L 仅由C、H两种元素组成的某气体质量为4.5g,在25℃和101kPa下完全燃烧生成 和
和 时,放出233.97kJ的热量。该气体的分子式为
时,放出233.97kJ的热量。该气体的分子式为_______ ,表示该气体摩尔燃烧焓的热化学方程式为_______ 。
④2022年北京冬奥会将用绿氢( )作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
)作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
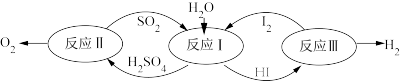
反应Ⅰ: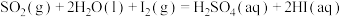

反应Ⅱ: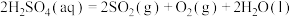
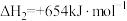
反应Ⅲ: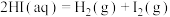
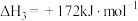
则反应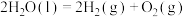

_______ 。
(1)下列变化过程,属于放热反应的是
①浓
 稀释;②酸碱中和反应:③
稀释;②酸碱中和反应:③ 在
在 中燃烧;④
中燃烧;④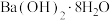 与
与 ;⑤铝热反应:⑧碳高温条件下还原
;⑤铝热反应:⑧碳高温条件下还原 ;⑦碳酸钙分解
;⑦碳酸钙分解(2)已知:①
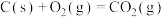
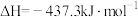
②

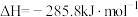
③
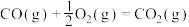
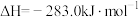
则固态碳和水蒸气反应生成CO和
 的热化学方程式为
的热化学方程式为(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
| 化学键 | C-H | C-F | H-F | F-F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
 的反应热
的反应热 为
为(4)已知稀溶液中,
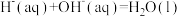
 。
。①则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量比57.3kJ

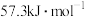 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②某化学兴趣小组用50mL
 盐酸、50mL
盐酸、50mL  NaOH溶液进行中和热测定,计算结果
NaOH溶液进行中和热测定,计算结果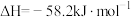 ,其原因可能是:
,其原因可能是:A.盐酸与NaOH溶液混合后立即记录温度
B.分三次将盐酸溶液缓慢倒入NaOH溶液中
C.用量筒量取NaOH溶液时仰视读数
D.使用环形玻璃棒搅拌
③标准状况下,3.36L 仅由C、H两种元素组成的某气体质量为4.5g,在25℃和101kPa下完全燃烧生成
 和
和 时,放出233.97kJ的热量。该气体的分子式为
时,放出233.97kJ的热量。该气体的分子式为④2022年北京冬奥会将用绿氢(
 )作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
)作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
反应Ⅰ:
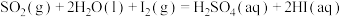

反应Ⅱ:
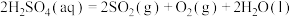
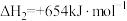
反应Ⅲ:
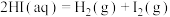
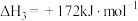
则反应
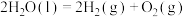

您最近一年使用:0次
2 . 我国在第75届联合国大会上正式提出了2030年实现碳达峰、2060年实现碳中和的目标,所以研发利用二氧化碳技术,降低空气中二氧化碳含量成为重要的任务。
Ⅰ.化石燃料的燃烧产生大量的二氧化碳。已知25℃时,相关物质的燃烧热数据如表:
(1)则25℃时H2(g)和C(石墨,s)生成C2H2(l)的热化学方程式为___________ 。
Ⅱ.二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1
CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1
副反应:ⅰ.CO(g)+3H2(g) CH4(g)+H2O(g) ΔH1 =___________;
CH4(g)+H2O(g) ΔH1 =___________;
ⅱ.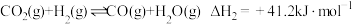 ;
;
ⅲ. =-90kJ∙mol-1;
=-90kJ∙mol-1;
ⅳ. C(s)+H2O(g) CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。
CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。
(2)反应ⅰ的ΔH1=___________ 。
(3)在恒温恒容的密闭容器中,关于反应ⅲ叙述正确的是___________。
(4)某容器中加入一定量的CO2和H2,保持温度和压强不变的情况下,达平衡后再向该容器中注入Ar稀释,反应ⅲ的化学平衡将___________ (填“正向移动”“逆向移动”或“不移动”),平衡时,CO2的分压P(CO2)___________ (填“增大”、“减小”或“不变”,下同)。
(5)以4molH2和1molCO2为初始原料,在催化剂(Ni/xMg)作用下保持总压为P0时,若只发生反应 ,不同温度下在相同时间测得CO2的转化率如图所示。
,不同温度下在相同时间测得CO2的转化率如图所示。
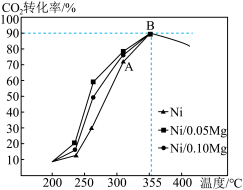
①B点的平衡常数KP___________ 。
②由图像可知,影响该催化剂活性的因素有___________ 。
Ⅰ.化石燃料的燃烧产生大量的二氧化碳。已知25℃时,相关物质的燃烧热数据如表:
| 物质 | H2(g) | C(石墨,s) | C2H2(l) |
| 燃烧热ΔH(kJ∙mol-1) | -285.8 | -393.5 | -1299.5 |
Ⅱ.二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1
CH4(g)+2H2O(g) ΔH =-165 kJ∙mol-1副反应:ⅰ.CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH1 =___________;
CH4(g)+H2O(g) ΔH1 =___________;ⅱ.
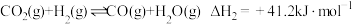 ;
;ⅲ.
 =-90kJ∙mol-1;
=-90kJ∙mol-1;ⅳ. C(s)+H2O(g)
 CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。
CO(g)+H2(g) ΔH4 = +131.3kJ∙mol-1。(2)反应ⅰ的ΔH1=
(3)在恒温恒容的密闭容器中,关于反应ⅲ叙述正确的是___________。
| A.用CO2、H2、H2O表示的速率之比为1:2:2,可以作为判断化学平衡的依据。 |
| B.容器中气体的压强不变,不能作为平衡的判断依据。 |
| C.容器内的气体密度不变时,可以作为平衡的判断依据。 |
| D.使用催化剂不能改变平衡转化率。 |
(5)以4molH2和1molCO2为初始原料,在催化剂(Ni/xMg)作用下保持总压为P0时,若只发生反应
 ,不同温度下在相同时间测得CO2的转化率如图所示。
,不同温度下在相同时间测得CO2的转化率如图所示。
①B点的平衡常数KP
②由图像可知,影响该催化剂活性的因素有
您最近一年使用:0次
名校
解题方法
3 . 甲醇是一种可再生能源,用途广泛。请回答下列问题:
(1)一种用CO2生产甲醇燃料的反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ•mol-1。
已知:CH3OH(g)=CH3OH(l) ΔH=-bkJ•mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ•mol-1;
H2O(g)=H2O(l) ΔH=-dkJ•mol-1。
则表示CH3OH(l)摩尔燃烧焓的热化学方程式为________ 。
(2)用如图所示装置研究有关电化学问题,当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
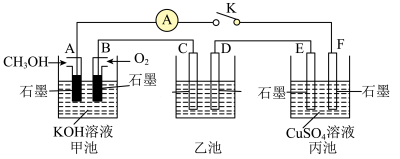
①A电极的电极反应式为________ ,C电极的电势________ (填“低于”或“高于”)D电极的电势。
②若在乙池中实现铁表面镀银,则D电极材料为________ ,乙池中的溶液为________ 。
③丙池中装有200mL1mol•L-1硫酸铜溶液,若B电极消耗3.36L(标准状况)气体,若要使电解质溶液恢复到电解前的状态,应加入________ (填字母)。
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图像分析,与汽油相比,甲醇作为燃料的优点是________ 。
(1)一种用CO2生产甲醇燃料的反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ•mol-1。
已知:CH3OH(g)=CH3OH(l) ΔH=-bkJ•mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ•mol-1;
H2O(g)=H2O(l) ΔH=-dkJ•mol-1。
则表示CH3OH(l)摩尔燃烧焓的热化学方程式为
(2)用如图所示装置研究有关电化学问题,当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

①A电极的电极反应式为
②若在乙池中实现铁表面镀银,则D电极材料为
③丙池中装有200mL1mol•L-1硫酸铜溶液,若B电极消耗3.36L(标准状况)气体,若要使电解质溶液恢复到电解前的状态,应加入
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图像分析,与汽油相比,甲醇作为燃料的优点是
您最近一年使用:0次
名校
解题方法
4 . 在第75届联合国大会我国提出要实现2030年前碳达峰、2060年前碳中和的目标, 的捕集、利用与封存成为科学家研究的重要课题。回答下列问题:
的捕集、利用与封存成为科学家研究的重要课题。回答下列问题:
(1)化石燃料的燃烧是 的主要来源。1g
的主要来源。1g 完全燃烧生成
完全燃烧生成 和液态
和液态 放出热量为55.64kJ,表示
放出热量为55.64kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为________________ 。
(2)在载人航天器中,利用反应
 可将航天员呼出的
可将航天员呼出的 转化为
转化为 和
和 ,然后用惰性电极电解
,然后用惰性电极电解 再生氧气。则
再生氧气。则
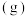 的
的
_____  ;电解水时,阳极的电极反应式为
;电解水时,阳极的电极反应式为____________________________ 。
(3)用如图装置电解 制取
制取 ,温度控制在10℃左右,持续通入
,温度控制在10℃左右,持续通入 ,电解前后
,电解前后 物质的量基本不变。
物质的量基本不变。

①铂电极为_____________ 极,电解过程中 的移动方向是
的移动方向是_____________ 。
②阴极电极反应为____________________ 。
③当阳极产生的气体体积为112L时(标准状况下),外电路转移电子数为_____________ 。
 的捕集、利用与封存成为科学家研究的重要课题。回答下列问题:
的捕集、利用与封存成为科学家研究的重要课题。回答下列问题:(1)化石燃料的燃烧是
 的主要来源。1g
的主要来源。1g 完全燃烧生成
完全燃烧生成 和液态
和液态 放出热量为55.64kJ,表示
放出热量为55.64kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)在载人航天器中,利用反应

 可将航天员呼出的
可将航天员呼出的 转化为
转化为 和
和 ,然后用惰性电极电解
,然后用惰性电极电解 再生氧气。则
再生氧气。则
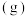 的
的
 ;电解水时,阳极的电极反应式为
;电解水时,阳极的电极反应式为(3)用如图装置电解
 制取
制取 ,温度控制在10℃左右,持续通入
,温度控制在10℃左右,持续通入 ,电解前后
,电解前后 物质的量基本不变。
物质的量基本不变。
①铂电极为
 的移动方向是
的移动方向是②阴极电极反应为
③当阳极产生的气体体积为112L时(标准状况下),外电路转移电子数为
您最近一年使用:0次
5 . 请回答以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是___________
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
(2)打火机使用的燃料一般是丙烷(C3H8)。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式___________ ;
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) ΔH2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的ΔH=___________
(3)已知:H—H键的键能为436kJ·mol-1,H—N键的键能为391kJ·mol-1,根据化学方程式:N2+3H2⇌2NH3 ΔH=-92.4kJ·mol-1
①请计算出N≡N键的键能为___________ 。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量___________ 92.4kJ(填大于或小于或等于)。
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是___________
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) ΔH2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的ΔH=
(3)已知:H—H键的键能为436kJ·mol-1,H—N键的键能为391kJ·mol-1,根据化学方程式:N2+3H2⇌2NH3 ΔH=-92.4kJ·mol-1
①请计算出N≡N键的键能为
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量
您最近一年使用:0次
2022-07-22更新
|
1489次组卷
|
9卷引用:山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题
山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题山东省邹城市第一中学2020-2021学年高二上学期期中质量检测化学试题辽宁省辽阳市辽阳县集美中学2020-2021学年高二上学期第一次月考化学试题河北省唐山市遵化市2020-2021学年高二上学期期中考试化学试题(已下线)第1章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)福建省福安市第一中学2022-2023学年高二上学期第一次月考化学试题山西省大同市第一中学校2023-2024学年高二上学期10月月考化学试题福建省宁德第一中学2020-2021学年高二上学期第一次月考化学试题上海市东华大学附属奉贤致远中学2023-2024学年高二上学期期中考试化学(等级)试题
解题方法
6 . 近日,我国科研人员在二氧化碳(CO2)催化加氢制甲醇研究中取得重要进展。二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH,回答下列问题
CH3OH(g)+H2O(g) ΔH,回答下列问题
(1)已知:I.CO(g)+2H2(g) CH3OH(g) ΔH1=-90.2kJ·mol-1
CH3OH(g) ΔH1=-90.2kJ·mol-1
Ⅱ.H2O(l)=H2O(g) ΔH2=+44.0kJ·mol-1
Ⅲ.CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1 ΔH=_______ kJ·mol-1,该反应在_______ (填“高温”或“低温”)下有利于自发进行。
(2)在一定温度和催化剂条件下,将1mol CO2和3mol H2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),H2的分压随时间的变化曲线如下图所示。

①若保持容器体积不变,t1时反应达到平衡。0~t1时间内,用CH3OH的浓度变化表示的平均反应速率v(CH3OH)=_______ mol/(L·min)(用含t1的代数式表示);此时的反应平衡常数Kp=_______ kPa-2(Kp为以分压表示的平衡常数,列出计算式即可)。
②t2时将容器体积迅速扩大至4L并保持不变,图中能正确表示扩大体积后H2分压变化趋势的曲线是_______ (用图中a、b、c、d表示),理由是_______ 。
 CH3OH(g)+H2O(g) ΔH,回答下列问题
CH3OH(g)+H2O(g) ΔH,回答下列问题(1)已知:I.CO(g)+2H2(g)
 CH3OH(g) ΔH1=-90.2kJ·mol-1
CH3OH(g) ΔH1=-90.2kJ·mol-1Ⅱ.H2O(l)=H2O(g) ΔH2=+44.0kJ·mol-1
Ⅲ.CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1 ΔH=
(2)在一定温度和催化剂条件下,将1mol CO2和3mol H2通入2L密闭容器中进行反应(此时容器内总压强为200kPa),H2的分压随时间的变化曲线如下图所示。

①若保持容器体积不变,t1时反应达到平衡。0~t1时间内,用CH3OH的浓度变化表示的平均反应速率v(CH3OH)=
②t2时将容器体积迅速扩大至4L并保持不变,图中能正确表示扩大体积后H2分压变化趋势的曲线是
您最近一年使用:0次
解题方法
7 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发CO2和CH4等利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热(焓)数据如下表:
则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为___________ 。
(2)CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a.CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1 b.H2(g)+CO2(g)
2CO(g)+2H2(g) ∆H1 b.H2(g)+CO2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
c.CH4(g) C(s)+2H2(g) ∆H3 d.2CO(g)
C(s)+2H2(g) ∆H3 d.2CO(g) CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4
e.H2(g)+CO(g) C(s)+H2O(g) ∆H5
C(s)+H2O(g) ∆H5
①上述反应体系在一定条件下建立平衡后,下列说法错误的有___________ (填标号)。
A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B.移去部分C(s),反应c、d、e的平衡均向右移动
C.加入反应a的催化剂,可提高CH4的平衡转化率
D.降低反应温度,反应a~e的正、逆反应速率都减小
②一定条件下,CH4分解形成碳的反应历程如下图所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。

③设K 为相对压力平衡常数,其表达式写法:在浓度的平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度的平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随1/T(温度的倒数)的变化如下图所示。则反应a、c、e中,属于放热反应的有
随1/T(温度的倒数)的变化如下图所示。则反应a、c、e中,属于放热反应的有___________ (填字母):反应d的相对压力平衡常数表达式为K =
=___________ 。

(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热(焓)数据如下表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃烧焓∆H/kJ·mol-1 | -285.8 | -393.5 | -3267.5 |
(2)CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1 b.H2(g)+CO2(g)
2CO(g)+2H2(g) ∆H1 b.H2(g)+CO2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2c.CH4(g)
 C(s)+2H2(g) ∆H3 d.2CO(g)
C(s)+2H2(g) ∆H3 d.2CO(g) CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4e.H2(g)+CO(g)
 C(s)+H2O(g) ∆H5
C(s)+H2O(g) ∆H5①上述反应体系在一定条件下建立平衡后,下列说法错误的有
A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B.移去部分C(s),反应c、d、e的平衡均向右移动
C.加入反应a的催化剂,可提高CH4的平衡转化率
D.降低反应温度,反应a~e的正、逆反应速率都减小
②一定条件下,CH4分解形成碳的反应历程如下图所示。该历程分

③设K
 为相对压力平衡常数,其表达式写法:在浓度的平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度的平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随1/T(温度的倒数)的变化如下图所示。则反应a、c、e中,属于放热反应的有
随1/T(温度的倒数)的变化如下图所示。则反应a、c、e中,属于放热反应的有 =
=
您最近一年使用:0次
名校
8 . 化学反应伴随能量变化,获取反应能量变化有多条途径。回答下列问题:
(1)理论研究表明,在101kPa和298K下,HCN(g)=HNC(g)异构化反应过程的能量变化如图所示,计算可得:HCN(g)=HNC(g) ∆H=_____ kJ•mol-1。HCN与HNC稳定性较强的是_____ 。
(2)已知:
计算可得:HCN(g)=HNC(g) ∆H=______ kJ•mol-1(用含a、b的式子表示)。
(3)已知:4gCH4完全燃烧生成CO2(g)、H2O(l)时放出热量222.5kJ,则表示甲烷燃烧热的热化学方程式为_____ 。
(4)实验室用50mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液和如图所示装置,进行测定中和热的实验。
①实验装置中尚缺少的一种实验用品是_____ 。
②若测得中和热的数值偏低,请你分析可能的原因是_____ 。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视读数
(1)理论研究表明,在101kPa和298K下,HCN(g)=HNC(g)异构化反应过程的能量变化如图所示,计算可得:HCN(g)=HNC(g) ∆H=

(2)已知:
| 化学键种类 | C—H | N—H |
| 键能(kJ/mol) | a | b |
(3)已知:4gCH4完全燃烧生成CO2(g)、H2O(l)时放出热量222.5kJ,则表示甲烷燃烧热的热化学方程式为
(4)实验室用50mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液和如图所示装置,进行测定中和热的实验。

①实验装置中尚缺少的一种实验用品是
②若测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视读数
您最近一年使用:0次
2021-11-01更新
|
125次组卷
|
2卷引用:山东省济钢高级中学2021-2022学年高二上学期第二次教学检测化学试题
9 . I.运动会中的火炬一般采用丙烷为燃料。丙烷燃烧放出的热量大,污染较小,是一种优良的燃料。试回答下列问题:

(1)一定量的丙烷完全燃烧生成 和
和 过程中的能量变化曲线如上图所示,图中的括号内应填
过程中的能量变化曲线如上图所示,图中的括号内应填___________ (“ ”或“
”或“ ”)。
”)。
(2)写出表示丙烷燃烧热的热化学方程式:___________ 。
(3)已知氢气燃烧的热化学方程式为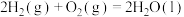
 。试比较同质量的氢气和丙烷燃烧,产生的热量比值约为
。试比较同质量的氢气和丙烷燃烧,产生的热量比值约为___________ 。
(4)氢气是未来的理想能源,除产生的热量多之外,还具有的优点是___________ 。
II.运用盖斯定律回答下列问题:
(5)碳(s)在氧气供应不充足时,生成CO的同时还部分生成CO2,因此无法通过实验直接测得反应 的
的 。但可设计实验,并利用盖斯定律计算出该反应的
。但可设计实验,并利用盖斯定律计算出该反应的 ,计算时需要测得的实验数据有
,计算时需要测得的实验数据有___________ 。

(1)一定量的丙烷完全燃烧生成
 和
和 过程中的能量变化曲线如上图所示,图中的括号内应填
过程中的能量变化曲线如上图所示,图中的括号内应填 ”或“
”或“ ”)。
”)。(2)写出表示丙烷燃烧热的热化学方程式:
(3)已知氢气燃烧的热化学方程式为
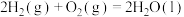
 。试比较同质量的氢气和丙烷燃烧,产生的热量比值约为
。试比较同质量的氢气和丙烷燃烧,产生的热量比值约为(4)氢气是未来的理想能源,除产生的热量多之外,还具有的优点是
II.运用盖斯定律回答下列问题:
(5)碳(s)在氧气供应不充足时,生成CO的同时还部分生成CO2,因此无法通过实验直接测得反应
 的
的 。但可设计实验,并利用盖斯定律计算出该反应的
。但可设计实验,并利用盖斯定律计算出该反应的 ,计算时需要测得的实验数据有
,计算时需要测得的实验数据有
您最近一年使用:0次
解题方法
10 . 化学物质在汽车的动力、安全等方面有着极为重要的作用。
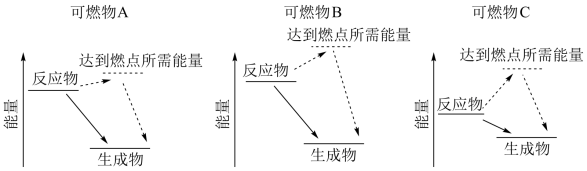
(1)某同学根据所查阅的资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图,你认为可燃物_______ (填“A”、“B”或“C”)更适合用作车用燃料。(已知:燃点是指在规定的条件下,应用外部热源使物质表面起火并持续燃烧一定时间所需的最低温度,燃点较低时存在安全隐患。)
(2)汽车尾气中含有 、
、 等污染物。其中
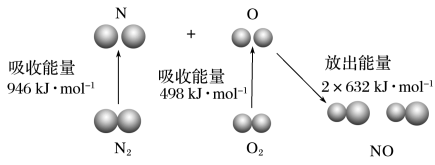
等污染物。其中 生成过程的能量变化如图,由该图数据计算可得,该反应为
生成过程的能量变化如图,由该图数据计算可得,该反应为_______ (填“吸热”或“放热”)反应。
(3)通过 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
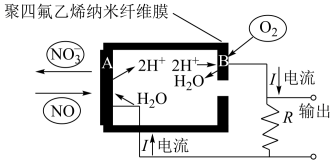
①A电极发生的是_______ 反应(填“氧化”或“还原”)。
②B电极反应为_______ 。
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应为 。
。
①当有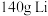 消耗时,电路中转移电子数目为
消耗时,电路中转移电子数目为_______ 。
②根据①的计算思路,分析 做电极优于
做电极优于 的原因是
的原因是_______ 。
(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有 、
、 、
、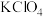 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。
①药剂中 做冷却剂原因是
做冷却剂原因是_______ 。
②根据产气药剂的组成,在设计气囊中所运用的化学反应时,需要考虑的角度有_______ (填标号)。
A.固体反应物的颜色 B.气体产物的毒性 C.反应的快慢 D.反应的能量变化
(1)某同学根据所查阅的资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图,你认为可燃物

(2)汽车尾气中含有
 、
、 等污染物。其中
等污染物。其中 生成过程的能量变化如图,由该图数据计算可得,该反应为
生成过程的能量变化如图,由该图数据计算可得,该反应为
(3)通过
 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
①A电极发生的是
②B电极反应为
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应为
 。
。①当有
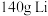 消耗时,电路中转移电子数目为
消耗时,电路中转移电子数目为②根据①的计算思路,分析
 做电极优于
做电极优于 的原因是
的原因是(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有
 、
、 、
、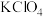 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。①药剂中
 做冷却剂原因是
做冷却剂原因是②根据产气药剂的组成,在设计气囊中所运用的化学反应时,需要考虑的角度有
A.固体反应物的颜色 B.气体产物的毒性 C.反应的快慢 D.反应的能量变化
您最近一年使用:0次



