解题方法
1 . 积极发展清洁能源,推动经济社会绿色低碳转型,已经成为国际社会应对全球气候变化的普遍共识。已知:
①某些常见化学键的键能(指常温常压下,气态分子中 化学键解离成气态原子所吸收的能量)数据如下:
化学键解离成气态原子所吸收的能量)数据如下:
②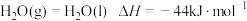 ;
;
③在 和
和 下,
下, 的燃烧热
的燃烧热 。
。
(1)氢能是理想的绿色能源。已知 。
。
①断开1molH—〇需要吸收___________  能量。
能量。
②与天然气相比,氢能的优点是___________ (任写1点)。
(2)CH3OH是一种重要的清洁燃料, 在
在 和
和 下完全燃烧生成
下完全燃烧生成 和
和 时,放出
时,放出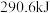 热量。
热量。
①表示 (1)燃烧热的热化学方程式为
(1)燃烧热的热化学方程式为___________ ,该反应中反应物的总键能___________ (填“大于”“小于”或“等于”)生成物的总键能。
②由 催化加氢可制备
催化加氢可制备 ,则
,则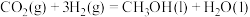

___________  ,若生成气态水,则
,若生成气态水,则
___________ (填“大于”“小于”或“等于”)该计算值。
(3)在 和
和 下,
下, 和
和 的混合气体
的混合气体 完全燃烧生成
完全燃烧生成 和
和 时,放出
时,放出 热量,则该混合气体中
热量,则该混合气体中 的物质的量分数为
的物质的量分数为___________  。
。
①某些常见化学键的键能(指常温常压下,气态分子中
 化学键解离成气态原子所吸收的能量)数据如下:
化学键解离成气态原子所吸收的能量)数据如下:| 化学键 |  |  |
键能 | 436 | 496 |
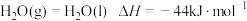 ;
;③在
 和
和 下,
下, 的燃烧热
的燃烧热 。
。(1)氢能是理想的绿色能源。已知
 。
。①断开1molH—〇需要吸收
 能量。
能量。②与天然气相比,氢能的优点是
(2)CH3OH是一种重要的清洁燃料,
 在
在 和
和 下完全燃烧生成
下完全燃烧生成 和
和 时,放出
时,放出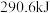 热量。
热量。①表示
 (1)燃烧热的热化学方程式为
(1)燃烧热的热化学方程式为②由
 催化加氢可制备
催化加氢可制备 ,则
,则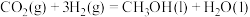

 ,若生成气态水,则
,若生成气态水,则
(3)在
 和
和 下,
下, 和
和 的混合气体
的混合气体 完全燃烧生成
完全燃烧生成 和
和 时,放出
时,放出 热量,则该混合气体中
热量,则该混合气体中 的物质的量分数为
的物质的量分数为 。
。
您最近一年使用:0次
名校
解题方法
2 . 甲烷是最简单的烃,可用来作为燃料,也是一种重要的化工原料。
(1) A.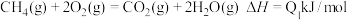
B.
C.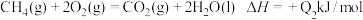
D.
上述热化学方程式中的反应热能正确表示甲烷燃烧热的是___________ 。
(2)以甲烷为原料通过以下反应可以合成甲醇: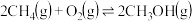
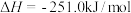
现将 和
和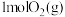 充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
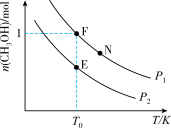
① 时升高温度,
时升高温度,
___________ (填“增大”、“减小”或“不变”);
___________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
②E、F、N点对应的化学反应速率由大到小的顺序为___________ (用 表示);
表示);
③下列能提高 平衡转化率的措施是
平衡转化率的措施是___________ (填序号);
a.选择高效催化剂 b.增大 投料比 c.及时分离产物
投料比 c.及时分离产物
④若 点,
点, ,总压强为
,总压强为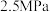 ,则
,则 时
时 点用分压强代替浓度表示的平衡常数
点用分压强代替浓度表示的平衡常数
___________ 。
(1) A.
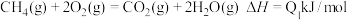
B.

C.
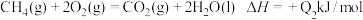
D.

上述热化学方程式中的反应热能正确表示甲烷燃烧热的是
(2)以甲烷为原料通过以下反应可以合成甲醇:
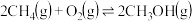
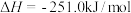
现将
 和
和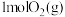 充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
充入密闭容器中,在不同温度和压强下进行上述反应。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
①
 时升高温度,
时升高温度,

 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);②E、F、N点对应的化学反应速率由大到小的顺序为
 表示);
表示);③下列能提高
 平衡转化率的措施是
平衡转化率的措施是a.选择高效催化剂 b.增大
 投料比 c.及时分离产物
投料比 c.及时分离产物④若
 点,
点, ,总压强为
,总压强为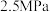 ,则
,则 时
时 点用分压强代替浓度表示的平衡常数
点用分压强代替浓度表示的平衡常数
您最近一年使用:0次
2023-12-15更新
|
222次组卷
|
3卷引用:辽宁省辽东南协作校2023-2024学年高三上学期12月月考化学(A卷)试题
名校
3 . 完成下列问题
(1)已知:①

 ②
②

则

___________ 。
(2)已知:①

 ②
②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

 ,则a=
,则a=___________ 。
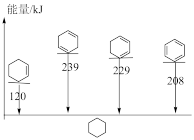
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
___________ ;反应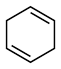 (l)=
(l)= 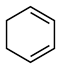 (l)的
(l)的

___________ 。
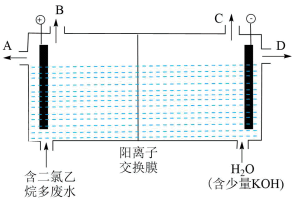
(5)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基(
 ),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
___________ ;羟基自由基与二氯乙烷反应的化学方程式为
___________ 。
(1)已知:①

 ②
②

则


(2)已知:①

 ②
②

则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)=  (l)的
(l)的

(5)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基(
 ),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
您最近一年使用:0次
2023-10-26更新
|
541次组卷
|
6卷引用:辽宁省部分学校2023-2024学年高三上学期一轮复习联考(二)化学试题
解题方法
4 .  在化学化工领域有诸多用途。回答下列问题:
在化学化工领域有诸多用途。回答下列问题:
(1) 、
、 条件下,
条件下, 的燃烧过程中,每消耗
的燃烧过程中,每消耗 放出
放出 热量,表示
热量,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(2)在 催化作用下合成
催化作用下合成 的反应为
的反应为 。
。
①下列有利于提高 的平衡转化率的是
的平衡转化率的是_______ (填字母,下同)。
A.低温高压 B.高温低压 C.高温高压 D.低温低压
②下列有关合成 的说法中正确的是
的说法中正确的是_______ 。

A.存在非极性共价键的断裂与形成
B.所有分子均为极性分子
C.如图为 的晶胞结构,图中
的晶胞结构,图中 表示
表示
D.催化剂可降低该反应的焓变
(3)工业上可利用 和
和 反应制备光气
反应制备光气 :
: 。在
。在 恒温恒容密闭容器中充入
恒温恒容密闭容器中充入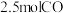 和
和 ,在催化剂作用下发生反应,测得
,在催化剂作用下发生反应,测得 及
及 的物质的量随时间变化如图所示:
的物质的量随时间变化如图所示:

①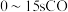 的平均反应速率为
的平均反应速率为_______  。
。
②第一次平衡时, 的平衡转化率为
的平衡转化率为_______ ;该温度下反应的平衡常数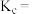
_______ (保留三位有效数字)。
③在第 时,改变的条件是
时,改变的条件是_______ 。
(4)一定条件下, 与
与 反应生成
反应生成 和
和 :
: 。已知
。已知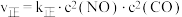 ,
,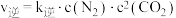 (
( 、
、 为速率常数,只与温度有关)。若在
为速率常数,只与温度有关)。若在 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为
的转化率为 ,则
,则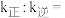
_______ 。
 在化学化工领域有诸多用途。回答下列问题:
在化学化工领域有诸多用途。回答下列问题:(1)
 、
、 条件下,
条件下, 的燃烧过程中,每消耗
的燃烧过程中,每消耗 放出
放出 热量,表示
热量,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)在
 催化作用下合成
催化作用下合成 的反应为
的反应为 。
。①下列有利于提高
 的平衡转化率的是
的平衡转化率的是A.低温高压 B.高温低压 C.高温高压 D.低温低压
②下列有关合成
 的说法中正确的是
的说法中正确的是
A.存在非极性共价键的断裂与形成
B.所有分子均为极性分子
C.如图为
 的晶胞结构,图中
的晶胞结构,图中 表示
表示
D.催化剂可降低该反应的焓变

(3)工业上可利用
 和
和 反应制备光气
反应制备光气 :
: 。在
。在 恒温恒容密闭容器中充入
恒温恒容密闭容器中充入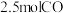 和
和 ,在催化剂作用下发生反应,测得
,在催化剂作用下发生反应,测得 及
及 的物质的量随时间变化如图所示:
的物质的量随时间变化如图所示:
①
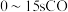 的平均反应速率为
的平均反应速率为 。
。②第一次平衡时,
 的平衡转化率为
的平衡转化率为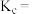
③在第
 时,改变的条件是
时,改变的条件是(4)一定条件下,
 与
与 反应生成
反应生成 和
和 :
: 。已知
。已知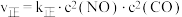 ,
,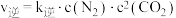 (
( 、
、 为速率常数,只与温度有关)。若在
为速率常数,只与温度有关)。若在 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为
的转化率为 ,则
,则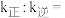
您最近一年使用:0次
2023-07-12更新
|
62次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
名校
5 . 煤和石油通常都含有硫的化合物,燃烧生成的二氧化硫为大气主要污染物之一、二氧化硫的治理已成为当前研究的课题。硫与硫的氧化物在转化过程中的能量变化如图所示。

已知: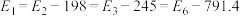 。
。
回答下列问题:
(1)图中的I、II、III、IV中属于放热反应的是_______ 。
(2)写出表示 的燃烧热的热化学方程式:
的燃烧热的热化学方程式:_______ 。
(3)从图中可看出将 氧化成
氧化成 有两条途径:①
有两条途径:① 经过程III、过程IV转化成
经过程III、过程IV转化成 ;②
;② 经过程II转化成
经过程II转化成 。这两种途径相比,①改变的条件是
。这两种途径相比,①改变的条件是_______ ,改变该条件主要是降低了_______ 。已知过程IV的化学方程式为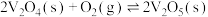 ,则过程III的热化学方程式为
,则过程III的热化学方程式为_______ 。
(4)9.6gS和16g 在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为109.8kJ。则反应后的体系中各组分的物质的量分别为
在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为109.8kJ。则反应后的体系中各组分的物质的量分别为_______ (保留两位有效数字)。
(5)工业上常用NaOH溶液吸收 ,若将0.4mol
,若将0.4mol 通入500mL
通入500mL NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1mol
NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1mol 通入足量的NaOH溶液中充分反应放出y kJ热量。则
通入足量的NaOH溶液中充分反应放出y kJ热量。则 和NaOH溶液反应生成
和NaOH溶液反应生成 的热化学反应方程式为
的热化学反应方程式为_______ 。

已知:
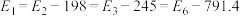 。
。回答下列问题:
(1)图中的I、II、III、IV中属于放热反应的是
(2)写出表示
 的燃烧热的热化学方程式:
的燃烧热的热化学方程式:(3)从图中可看出将
 氧化成
氧化成 有两条途径:①
有两条途径:① 经过程III、过程IV转化成
经过程III、过程IV转化成 ;②
;② 经过程II转化成
经过程II转化成 。这两种途径相比,①改变的条件是
。这两种途径相比,①改变的条件是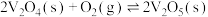 ,则过程III的热化学方程式为
,则过程III的热化学方程式为(4)9.6gS和16g
 在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为109.8kJ。则反应后的体系中各组分的物质的量分别为
在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为109.8kJ。则反应后的体系中各组分的物质的量分别为(5)工业上常用NaOH溶液吸收
 ,若将0.4mol
,若将0.4mol 通入500mL
通入500mL NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1mol
NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1mol 通入足量的NaOH溶液中充分反应放出y kJ热量。则
通入足量的NaOH溶液中充分反应放出y kJ热量。则 和NaOH溶液反应生成
和NaOH溶液反应生成 的热化学反应方程式为
的热化学反应方程式为
您最近一年使用:0次
2022-09-22更新
|
318次组卷
|
5卷引用:辽宁省协作校2022-2023学年高二上学期第一次考试化学试题
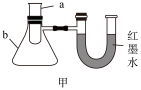
6 . 实验小组设计了如图实验装置探究化学能与热能的转化。
回答下列问题:
(1)A同学向装置甲的a仪器中加入镁和稀硫酸,能证明该反应是放热反应的现象是_______ ,若标准状况下生成5.6LH2时放热QkJ,该反应的热化学方程式为_______ 。
(2)B同学向装置甲的a仪器中加入适量硝酸铵固体和水,并用玻璃棒搅拌,可观察到的现象是_______ ,说明硝酸铵固体溶于水时要_______ (填“吸收”或“放出”)热量。
(3)装置乙不能证明“镁和稀硫酸反应是吸热反应还是放热反应”的理由是_______ 。
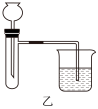
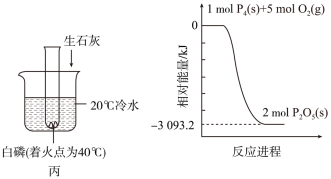
(4)C同学利用装置丙证明生石灰与水反应是放热反应,试管中的现象是_______ 。P4和O2反应的能量变化如图丁所示。该反应的热化学方程式为_______ 。

回答下列问题:
(1)A同学向装置甲的a仪器中加入镁和稀硫酸,能证明该反应是放热反应的现象是
(2)B同学向装置甲的a仪器中加入适量硝酸铵固体和水,并用玻璃棒搅拌,可观察到的现象是
(3)装置乙不能证明“镁和稀硫酸反应是吸热反应还是放热反应”的理由是

(4)C同学利用装置丙证明生石灰与水反应是放热反应,试管中的现象是

您最近一年使用:0次
2022-09-02更新
|
177次组卷
|
2卷引用:辽宁省朝阳市凌源市2022-2023学年高二上学期第一次月考化学试题
7 . 请回答以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是___________
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
(2)打火机使用的燃料一般是丙烷(C3H8)。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式___________ ;
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) ΔH2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的ΔH=___________
(3)已知:H—H键的键能为436kJ·mol-1,H—N键的键能为391kJ·mol-1,根据化学方程式:N2+3H2⇌2NH3 ΔH=-92.4kJ·mol-1
①请计算出N≡N键的键能为___________ 。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量___________ 92.4kJ(填大于或小于或等于)。
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是___________
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) ΔH2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的ΔH=
(3)已知:H—H键的键能为436kJ·mol-1,H—N键的键能为391kJ·mol-1,根据化学方程式:N2+3H2⇌2NH3 ΔH=-92.4kJ·mol-1
①请计算出N≡N键的键能为
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量
您最近一年使用:0次
2022-07-22更新
|
1489次组卷
|
9卷引用:辽宁省辽阳市辽阳县集美中学2020-2021学年高二上学期第一次月考化学试题
辽宁省辽阳市辽阳县集美中学2020-2021学年高二上学期第一次月考化学试题山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题山东省邹城市第一中学2020-2021学年高二上学期期中质量检测化学试题河北省唐山市遵化市2020-2021学年高二上学期期中考试化学试题(已下线)第1章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)福建省福安市第一中学2022-2023学年高二上学期第一次月考化学试题山西省大同市第一中学校2023-2024学年高二上学期10月月考化学试题福建省宁德第一中学2020-2021学年高二上学期第一次月考化学试题上海市东华大学附属奉贤致远中学2023-2024学年高二上学期期中考试化学(等级)试题
解题方法
8 . 现代社会的一切都离不开能量,化学反应在发生物质变化的同时伴随有能量变化。
(1)“长征八号”火箭已于2018年首飞,其液态燃料为偏二甲基肼(C2H8N2)。25℃、101kPa时,3g偏二甲基肼完全燃烧生成氮气、CO2和液态水时放热为100kJ。则偏二甲基肼燃烧热的热化学方程式为___ 。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g) +4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为____ 。
(1)“长征八号”火箭已于2018年首飞,其液态燃料为偏二甲基肼(C2H8N2)。25℃、101kPa时,3g偏二甲基肼完全燃烧生成氮气、CO2和液态水时放热为100kJ。则偏二甲基肼燃烧热的热化学方程式为
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g) +4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
您最近一年使用:0次
名校
9 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
I.已知25℃和101kPa下:
①

②

③

(1)则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
II. 和
和 在一定条件下反应可制得合成气,在1L密闭容器中分别通入1mol
在一定条件下反应可制得合成气,在1L密闭容器中分别通入1mol 和
和 ,发生反应:
,发生反应:
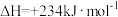
(2)该反应在___________ (填“高温”或“低温”)条件下能自发进行。
(3)下列能判断 达到平衡状态的是______(填序号)。
达到平衡状态的是______(填序号)。
III.已知 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为: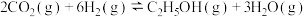
 设m为起始时的投料比,即
设m为起始时的投料比,即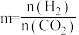 。
。
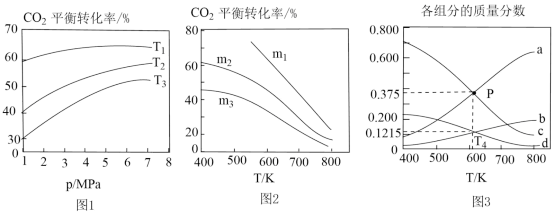
(4)图1中投料比相同,温度从高到低的顺序为___________ 。
(5)图2中 、
、 、
、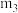 从大到小的顺序为
从大到小的顺序为___________ 。
(6)图3表示在总压为5MPa的恒压条件下,且 时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质的化学名称为
时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质的化学名称为___________ 。
IV.工业上可用丙烯加成法制备1,2-二氯丙烷( ),主要副产物为3-氯丙烯(
),主要副产物为3-氯丙烯( ),反应原理为:
),反应原理为:
①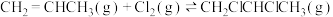
②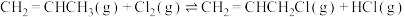
一定温度下,向恒容密闭容器中充入等物质的量的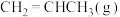 和
和 发生反应,容器内气体的压强随时间的变化如表所示。
发生反应,容器内气体的压强随时间的变化如表所示。
(7)用单位时间内气体分压的变化表示反应①的反应速率,即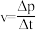 ,则前120min内平均反应速率
,则前120min内平均反应速率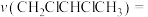
___________ 。
(8)该温度下,若平衡时HCl的体积分数为12.5%,反应①的平衡常数
___________  (
( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
I.已知25℃和101kPa下:
①
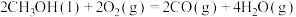

②


③


(1)则表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为II.
 和
和 在一定条件下反应可制得合成气,在1L密闭容器中分别通入1mol
在一定条件下反应可制得合成气,在1L密闭容器中分别通入1mol 和
和 ,发生反应:
,发生反应:
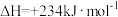
(2)该反应在
(3)下列能判断
 达到平衡状态的是______(填序号)。
达到平衡状态的是______(填序号)。| A.一定温度下,容积固定的容器中,密度保持不变 |
| B.容积固定的绝热容器中,温度保持不变 |
| C.一定温度和容积固定的容器中,平均相对分子质量不变 |
D. 和 和 的物质的量之比不再改变 的物质的量之比不再改变 |
III.已知
 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为: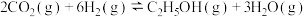
 设m为起始时的投料比,即
设m为起始时的投料比,即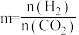 。
。
(4)图1中投料比相同,温度从高到低的顺序为
(5)图2中
 、
、 、
、 从大到小的顺序为
从大到小的顺序为(6)图3表示在总压为5MPa的恒压条件下,且
 时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质的化学名称为
时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质的化学名称为IV.工业上可用丙烯加成法制备1,2-二氯丙烷(
 ),主要副产物为3-氯丙烯(
),主要副产物为3-氯丙烯( ),反应原理为:
),反应原理为:①
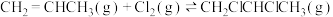
②
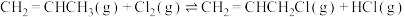
一定温度下,向恒容密闭容器中充入等物质的量的
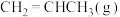 和
和 发生反应,容器内气体的压强随时间的变化如表所示。
发生反应,容器内气体的压强随时间的变化如表所示。| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
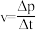 ,则前120min内平均反应速率
,则前120min内平均反应速率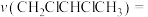
(8)该温度下,若平衡时HCl的体积分数为12.5%,反应①的平衡常数

 (
( 为以分压表示的平衡常数,保留小数点后2位)。
为以分压表示的平衡常数,保留小数点后2位)。
您最近一年使用:0次
2021-12-18更新
|
410次组卷
|
4卷引用:辽宁省大连市第一中学 2021-2022学年高三上学期期中联考化学试题
10 .
(1)能源是影响全球经济和生活的首要因素。已知下列热化学方程式:
①H2(g)+ O2(g)= H2O(l) △H =-285 kJ / mol
O2(g)= H2O(l) △H =-285 kJ / mol
②H2O(g)=H2(g) + O2(g) △H =+241.8 kJ/mol
O2(g) △H =+241.8 kJ/mol
③C(s)+ O2(g)=CO(g) △H =-110.4 kJ / mol
O2(g)=CO(g) △H =-110.4 kJ / mol
④C(s)+ O2(g)=CO2(g) △H =-393.5 kJ / mol
如果完全燃烧2 g H2生成液态水,那么放出的热量为________ kJ。
(2)一定条件下,反应N2(g)+3H2(g) 2NH3(g ) 在10 L的密闭容器中进行,测得2 min内,N2的物质的量由20 mol减小到8 mol,达到化学平衡时,则其平衡常数表达式为
2NH3(g ) 在10 L的密闭容器中进行,测得2 min内,N2的物质的量由20 mol减小到8 mol,达到化学平衡时,则其平衡常数表达式为___ 。
(3)25℃时,有浓度均为0.10 mol/L的乙酸、乙酸钠两种溶液。请回答:两种溶液中,c(H+) <c(OH-)的是________ (填“乙酸”或“乙酸钠”),其原因是__________ (用离子方程式表示)。两种溶液等体积混合后溶液显酸性,混合后溶液中各种离子的浓度由大到小依次为_______ 。
(1)能源是影响全球经济和生活的首要因素。已知下列热化学方程式:
①H2(g)+
 O2(g)= H2O(l) △H =-285 kJ / mol
O2(g)= H2O(l) △H =-285 kJ / mol②H2O(g)=H2(g) +
 O2(g) △H =+241.8 kJ/mol
O2(g) △H =+241.8 kJ/mol③C(s)+
 O2(g)=CO(g) △H =-110.4 kJ / mol
O2(g)=CO(g) △H =-110.4 kJ / mol ④C(s)+ O2(g)=CO2(g) △H =-393.5 kJ / mol
如果完全燃烧2 g H2生成液态水,那么放出的热量为
(2)一定条件下,反应N2(g)+3H2(g)
 2NH3(g ) 在10 L的密闭容器中进行,测得2 min内,N2的物质的量由20 mol减小到8 mol,达到化学平衡时,则其平衡常数表达式为
2NH3(g ) 在10 L的密闭容器中进行,测得2 min内,N2的物质的量由20 mol减小到8 mol,达到化学平衡时,则其平衡常数表达式为(3)25℃时,有浓度均为0.10 mol/L的乙酸、乙酸钠两种溶液。请回答:两种溶液中,c(H+) <c(OH-)的是
您最近一年使用:0次



