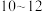(1)能源是影响全球经济和生活的首要因素。已知下列热化学方程式:
①H2(g)+
 O2(g)= H2O(l) △H =-285 kJ / mol
O2(g)= H2O(l) △H =-285 kJ / mol②H2O(g)=H2(g) +
 O2(g) △H =+241.8 kJ/mol
O2(g) △H =+241.8 kJ/mol③C(s)+
 O2(g)=CO(g) △H =-110.4 kJ / mol
O2(g)=CO(g) △H =-110.4 kJ / mol ④C(s)+ O2(g)=CO2(g) △H =-393.5 kJ / mol
如果完全燃烧2 g H2生成液态水,那么放出的热量为
(2)一定条件下,反应N2(g)+3H2(g)
 2NH3(g ) 在10 L的密闭容器中进行,测得2 min内,N2的物质的量由20 mol减小到8 mol,达到化学平衡时,则其平衡常数表达式为
2NH3(g ) 在10 L的密闭容器中进行,测得2 min内,N2的物质的量由20 mol减小到8 mol,达到化学平衡时,则其平衡常数表达式为(3)25℃时,有浓度均为0.10 mol/L的乙酸、乙酸钠两种溶液。请回答:两种溶液中,c(H+) <c(OH-)的是
更新时间:2021-11-08 07:21:59
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】甲醇和乙醇都是重要的化工原料,将 转化为甲醇和乙醇是实现“碳达峰、碳中和”目标的方法之一。
转化为甲醇和乙醇是实现“碳达峰、碳中和”目标的方法之一。
(1)利用焦炉煤气制取甲醇的主要反应原理为
则该反应的
_______  。
。
(2)完全燃烧 甲醇放出
甲醇放出 的热量,表示甲醇燃烧热的热化学方程式为
的热量,表示甲醇燃烧热的热化学方程式为_______ 。
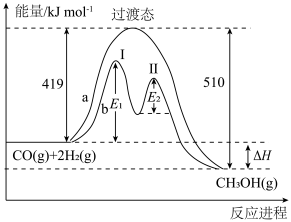
(3)某小组采用 催化加氢制甲醇来减少
催化加氢制甲醇来减少 对环境造成的影响。恒温恒容条件下,向4L的密闭容器中,充入
对环境造成的影响。恒温恒容条件下,向4L的密闭容器中,充入 和
和 ,发生反应
,发生反应 ,起始压强为
,起始压强为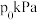 ,
, 后反应达平衡,此时
后反应达平衡,此时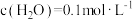 ,则:
,则:
① 转化率为
转化率为_______ %,
_______ 。
②该反应达到平衡时的平衡常数
_______ 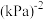 (列出计算式即可)。(
(列出计算式即可)。( 为分压表示的平衡常数,
为分压表示的平衡常数, 物质的量分数)
物质的量分数)
(4)某兴趣小组同学以甲醇燃料电池为电源研究有关电化学的问题。
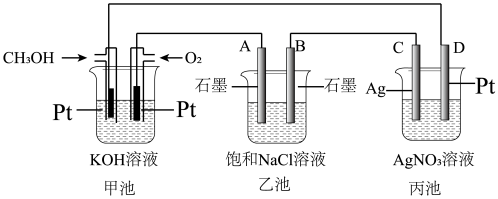
①乙池中,B极的电极名称为_______ 极,甲池中,通入氧气一极的电极反应式为_______ 。
②丙池中,通电前C、D两电极的质量相同,通电一段时间后,若两极的质量相差 ,则理论上甲池中消耗
,则理论上甲池中消耗 的体积为
的体积为_______  (标准状况下)。
(标准状况下)。
 转化为甲醇和乙醇是实现“碳达峰、碳中和”目标的方法之一。
转化为甲醇和乙醇是实现“碳达峰、碳中和”目标的方法之一。(1)利用焦炉煤气制取甲醇的主要反应原理为


则该反应的

 。
。(2)完全燃烧
 甲醇放出
甲醇放出 的热量,表示甲醇燃烧热的热化学方程式为
的热量,表示甲醇燃烧热的热化学方程式为(3)某小组采用
 催化加氢制甲醇来减少
催化加氢制甲醇来减少 对环境造成的影响。恒温恒容条件下,向4L的密闭容器中,充入
对环境造成的影响。恒温恒容条件下,向4L的密闭容器中,充入 和
和 ,发生反应
,发生反应 ,起始压强为
,起始压强为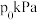 ,
, 后反应达平衡,此时
后反应达平衡,此时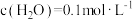 ,则:
,则:①
 转化率为
转化率为
②该反应达到平衡时的平衡常数

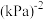 (列出计算式即可)。(
(列出计算式即可)。( 为分压表示的平衡常数,
为分压表示的平衡常数, 物质的量分数)
物质的量分数)(4)某兴趣小组同学以甲醇燃料电池为电源研究有关电化学的问题。

①乙池中,B极的电极名称为
②丙池中,通电前C、D两电极的质量相同,通电一段时间后,若两极的质量相差
 ,则理论上甲池中消耗
,则理论上甲池中消耗 的体积为
的体积为 (标准状况下)。
(标准状况下)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)已知:0.5mol乙醇液体燃烧生成二氧化碳和水蒸气,放出的热量为617.1kJ/mol,又知H2O(l)=H2O(g);△H=+44.2kJ/mol,请写出乙醇液体完全燃烧生成液态水的燃烧热的热化学方程式___ 。
(2)某温度下,纯水中c(H+)为1×10-6mol/L,则该温度下0.05mol/LBa(OH)2的pH为___ 。
(3)某温度时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的离子积常数Kw=___ ,该温度___ (填“>”、“=”或“<”)25℃。
(4)常温下,将1mLpH=1的H2SO4溶液加水稀释到100mL,稀释后的溶液中 =
=___ 。
(5)25℃时将pH=1的稀硫酸V1L与pH=13的苛性钠溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=__ 。
(1)已知:0.5mol乙醇液体燃烧生成二氧化碳和水蒸气,放出的热量为617.1kJ/mol,又知H2O(l)=H2O(g);△H=+44.2kJ/mol,请写出乙醇液体完全燃烧生成液态水的燃烧热的热化学方程式
(2)某温度下,纯水中c(H+)为1×10-6mol/L,则该温度下0.05mol/LBa(OH)2的pH为
(3)某温度时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的离子积常数Kw=
(4)常温下,将1mLpH=1的H2SO4溶液加水稀释到100mL,稀释后的溶液中
 =
=(5)25℃时将pH=1的稀硫酸V1L与pH=13的苛性钠溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH=_____ kJ·mol-1。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是____ kJ。
(3)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g)ΔH。表中所列为常见化学键的键能数据:
则该反应的ΔH=____ kJ·mol-1。
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图1所示。
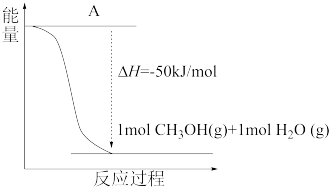
补全上图:图中A处应填入_______ 。
(5)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图2所示。
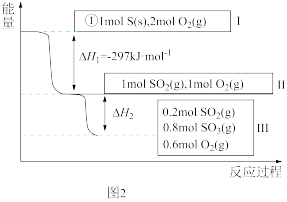
已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
①写出能表示硫的燃烧热的热化学方程式:____ 。
②ΔH2=___ kJ·mol-1。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH=
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是
(3)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g)ΔH。表中所列为常见化学键的键能数据:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ·mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图1所示。

补全上图:图中A处应填入
(5)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图2所示。

已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
①写出能表示硫的燃烧热的热化学方程式:
②ΔH2=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】研究 、
、 、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为: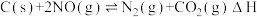 。某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温
。某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温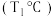 条件下反应,反应进行到不同时间测得各物质的浓度如下.
条件下反应,反应进行到不同时间测得各物质的浓度如下.
① 时,该反应的平衡常数
时,该反应的平衡常数
______  保留两位小数
保留两位小数 .
.
② 后,改变某一条件,反应重新达到平衡,则改变的条件可能是
后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ______ ;
③若30min后升高温度至 ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、 、
、 的浓度之比为5:3:3,则该反应的
的浓度之比为5:3:3,则该反应的
______  填“
填“ ”、“
”、“ ”或“
”或“ ”
”
(2)用 催化还原氮氧化物可以消除氮氧化物的污染.已知:
催化还原氮氧化物可以消除氮氧化物的污染.已知:
①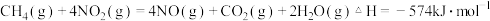
②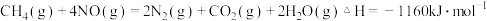
③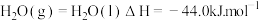
写出 与
与 反应生成
反应生成 、
、 和
和 的热化学方程式
的热化学方程式 ______
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的 ,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用
,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用 外,还能得到一种复合肥料.
外,还能得到一种复合肥料.
①该复合肥料可能的化学式为______  写出一种即可
写出一种即可 .
.
②若氨水与 恰好完全反应生成正盐,则此时溶液呈
恰好完全反应生成正盐,则此时溶液呈 ______ 性 填“酸”或“碱”
填“酸”或“碱” .
. 已知常温下:氨水
已知常温下:氨水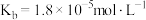 ,
,
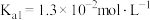 ,
,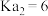 .
.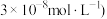
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为______  常温下,
常温下, 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数
______ .

 、
、 、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.(1)用活性炭还原法处理氮氧化物.有关反应为:
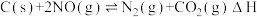 。某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温
。某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温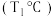 条件下反应,反应进行到不同时间测得各物质的浓度如下.
条件下反应,反应进行到不同时间测得各物质的浓度如下.| 浓度/mol·L-1 时间/min | NO |  |  |
| 0 |  | 0 | 0 |
| 10 | 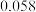 |  |  |
| 20 | 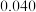 | 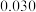 | 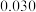 |
| 30 | 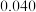 | 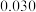 | 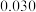 |
| 40 | 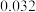 | 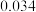 |  |
| 50 | 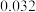 | 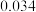 |  |
 时,该反应的平衡常数
时,该反应的平衡常数
 保留两位小数
保留两位小数 .
.②
 后,改变某一条件,反应重新达到平衡,则改变的条件可能是
后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ③若30min后升高温度至
 ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、 、
、 的浓度之比为5:3:3,则该反应的
的浓度之比为5:3:3,则该反应的
 填“
填“ ”、“
”、“ ”或“
”或“ ”
”
(2)用
 催化还原氮氧化物可以消除氮氧化物的污染.已知:
催化还原氮氧化物可以消除氮氧化物的污染.已知:①
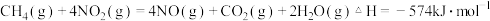
②
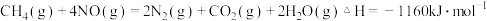
③
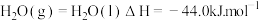
写出
 与
与 反应生成
反应生成 、
、 和
和 的热化学方程式
的热化学方程式 (3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的
 ,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用
,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用 外,还能得到一种复合肥料.
外,还能得到一种复合肥料.①该复合肥料可能的化学式为
 写出一种即可
写出一种即可 .
.②若氨水与
 恰好完全反应生成正盐,则此时溶液呈
恰好完全反应生成正盐,则此时溶液呈  填“酸”或“碱”
填“酸”或“碱” .
. 已知常温下:氨水
已知常温下:氨水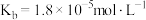 ,
,
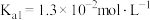 ,
,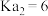 .
.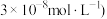
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为
 常温下,
常温下, 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数

您最近一年使用:0次
【推荐2】正丁烷可用做燃料电池,还可通过催化脱氢制备丁烯,该工艺流程的副产物有炭(C),生成的炭会附着在催化剂表面,影响催化效果。正丁烷(C4H10)脱氢制1﹣丁烯(C4H8)的热化学方程式为:
①C4H10(g)=C4H8(g)+H2(g)△H
已知:②C4H10(g)+ O2(g)=C4H8(g)+H2O(g)△H1=﹣119kJ•mol﹣1
O2(g)=C4H8(g)+H2O(g)△H1=﹣119kJ•mol﹣1
③H2(g)+ O2(g)=H2O(g)△H2=﹣242kJ•mol﹣1
O2(g)=H2O(g)△H2=﹣242kJ•mol﹣1
回答下列问题:
(1)反应①的平衡常数表达式为_______ ,反应①的△H=_______ kJ•mol﹣1。
(2)其他条件相同,30min时测得正丁烷转化率、1﹣丁烯收率随温度的变化如图1所示。[收率= )×100%]
)×100%]
①实际生产温度选择590℃,理由是_______ 。
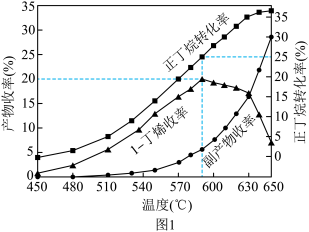
②590℃时,向体积为1L的密闭容器中充入3mol正丁烷气体,据图1计算0~30min内生成1﹣丁烯的平均反应速率为_______ mol/(L•min),1﹣丁烯的收率在590℃之前随温度的升高而增大的原因是_______ 。
(3)其他条件相同,30min时,丁烷和氢气的混合气体以一定的流速通过填充有催化剂的反应器,氢气的作用是活化催化剂。1﹣丁烯收率随进料气中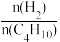 的变化如图2所示。图中曲线呈现先升高后降低的变化趋势,其升高的原因可能是
的变化如图2所示。图中曲线呈现先升高后降低的变化趋势,其升高的原因可能是_______ 。

(4)一种丁烷燃料电池工作原理如图3所示。
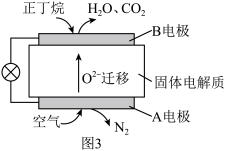
①A电极上发生的是_______ 反应(填“氧化“或“还原”)。
②写出B电极的电极反应式_______ 。
①C4H10(g)=C4H8(g)+H2(g)△H
已知:②C4H10(g)+
 O2(g)=C4H8(g)+H2O(g)△H1=﹣119kJ•mol﹣1
O2(g)=C4H8(g)+H2O(g)△H1=﹣119kJ•mol﹣1③H2(g)+
 O2(g)=H2O(g)△H2=﹣242kJ•mol﹣1
O2(g)=H2O(g)△H2=﹣242kJ•mol﹣1回答下列问题:
(1)反应①的平衡常数表达式为
(2)其他条件相同,30min时测得正丁烷转化率、1﹣丁烯收率随温度的变化如图1所示。[收率=
 )×100%]
)×100%]
①实际生产温度选择590℃,理由是
②590℃时,向体积为1L的密闭容器中充入3mol正丁烷气体,据图1计算0~30min内生成1﹣丁烯的平均反应速率为
(3)其他条件相同,30min时,丁烷和氢气的混合气体以一定的流速通过填充有催化剂的反应器,氢气的作用是活化催化剂。1﹣丁烯收率随进料气中
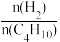 的变化如图2所示。图中曲线呈现先升高后降低的变化趋势,其升高的原因可能是
的变化如图2所示。图中曲线呈现先升高后降低的变化趋势,其升高的原因可能是
(4)一种丁烷燃料电池工作原理如图3所示。

①A电极上发生的是
②写出B电极的电极反应式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】Ⅰ. 已知:
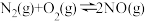
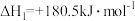 K1=a
K1=a

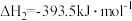 K2=b
K2=b

 K3=c
K3=c
(1)若某反应的平衡常数表达式为 ,请根据以上反应写出此反应的热化学方程式
,请根据以上反应写出此反应的热化学方程式___________ 。该反应的K=___________ (用a、b、c表示)
Ⅱ.利用如图装置测定中和热的实验步骤如下:

①用量筒量取 硫酸倒入小烧杯中,测出硫酸温度;
硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取 溶液,并用另一温度计测出其温度;
溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(2)倒入NaOH溶液的正确操作是___________ (填字母序号,下同)。
A. 沿玻璃棒缓慢倒入 B. 分三次少量倒入 C. 一次迅速倒入
(3)烧杯间填满碎泡沫塑料的作用是___________ 。
(4)使硫酸与NaOH溶液混合均匀的正确操作是___________ 。
a. 用温度计小心搅拌
b. 揭开硬纸片用玻璃棒搅拌
c. 轻轻地振荡烧杯
d. 用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(5)实验数据如表:
①反应后溶液的比热容 ,硫酸溶液和氢氧化钠溶液密度近似为
,硫酸溶液和氢氧化钠溶液密度近似为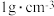 ,依据该学生的实验数据计算,温度差平均值为
,依据该学生的实验数据计算,温度差平均值为___________ ℃,该实验测得的中和热 =
=___________  (保留一位小数)。
(保留一位小数)。
②该实验测得的中和热 与理论值有偏差,其原因可能是
与理论值有偏差,其原因可能是___________ 。
a. 用量筒量取硫酸溶液仰视读数
b. 大烧杯上硬纸板没盖好
c. 大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
d. 测量完硫酸溶液温度的温度计直接用来测NaOH溶液的温度
(6)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液分别和 的稀硫酸恰好完全反应,其反应热分别为
的稀硫酸恰好完全反应,其反应热分别为 、
、 ,则
,则
_________  (填“>、<或=”)。
(填“>、<或=”)。
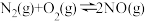
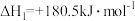 K1=a
K1=a
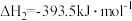 K2=b
K2=b
 K3=c
K3=c(1)若某反应的平衡常数表达式为
 ,请根据以上反应写出此反应的热化学方程式
,请根据以上反应写出此反应的热化学方程式Ⅱ.利用如图装置测定中和热的实验步骤如下:

①用量筒量取
 硫酸倒入小烧杯中,测出硫酸温度;
硫酸倒入小烧杯中,测出硫酸温度;②用另一量筒量取
 溶液,并用另一温度计测出其温度;
溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(2)倒入NaOH溶液的正确操作是
A. 沿玻璃棒缓慢倒入 B. 分三次少量倒入 C. 一次迅速倒入
(3)烧杯间填满碎泡沫塑料的作用是
(4)使硫酸与NaOH溶液混合均匀的正确操作是
a. 用温度计小心搅拌
b. 揭开硬纸片用玻璃棒搅拌
c. 轻轻地振荡烧杯
d. 用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(5)实验数据如表:
| 温度 实验次数 | 起始温度t℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/ ℃ | ||
 |  | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
 ,硫酸溶液和氢氧化钠溶液密度近似为
,硫酸溶液和氢氧化钠溶液密度近似为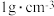 ,依据该学生的实验数据计算,温度差平均值为
,依据该学生的实验数据计算,温度差平均值为 =
= (保留一位小数)。
(保留一位小数)。②该实验测得的中和热
 与理论值有偏差,其原因可能是
与理论值有偏差,其原因可能是a. 用量筒量取硫酸溶液仰视读数
b. 大烧杯上硬纸板没盖好
c. 大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
d. 测量完硫酸溶液温度的温度计直接用来测NaOH溶液的温度
(6)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液分别和
 的稀硫酸恰好完全反应,其反应热分别为
的稀硫酸恰好完全反应,其反应热分别为 、
、 ,则
,则
 (填“>、<或=”)。
(填“>、<或=”)。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】元素A、B、C、D、E、F原子序数依次增大,且都为短周期元素。A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族;E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6。
(1)由A、C、F三种元素按原子个数比1∶1∶1组成的化合物的电子为_________ ,
该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式______________ 。
(2)将化合物EC2通入只含有 n mol 化合物D2E的溶液中,充分反应后,溶液出现浑浊,则该化合物D2E的溶液最多能吸收化合物EC2的物质的量为______ (不考虑水中溶解的化合物EC2)
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的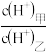 =
=________ ;乙溶液中所含离子的物质的量浓度由大到小的顺序是________________ 。
(4)电解由A与F形成化合物的溶液时,若阴、阳极都用石墨作电极,则阴极发生_______ 反应(填“氧化”、“还原”),阳极的电极反应式为____________________ 。
(1)由A、C、F三种元素按原子个数比1∶1∶1组成的化合物的电子为
该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式
(2)将化合物EC2通入只含有 n mol 化合物D2E的溶液中,充分反应后,溶液出现浑浊,则该化合物D2E的溶液最多能吸收化合物EC2的物质的量为
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的
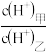 =
=(4)电解由A与F形成化合物的溶液时,若阴、阳极都用石墨作电极,则阴极发生
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
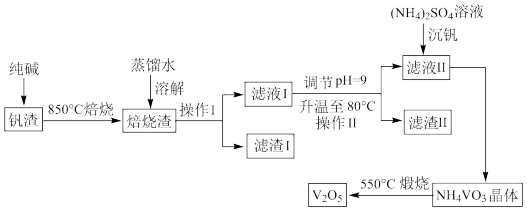
【推荐2】 可用作合金添加剂、有机化工的催化剂。钒钛磁铁矿炼钢后剩余的尾渣中含有
可用作合金添加剂、有机化工的催化剂。钒钛磁铁矿炼钢后剩余的尾渣中含有 、
、 、
、 、
、 、
、 等,利用该钒渣制备
等,利用该钒渣制备 的工艺流程如下:
的工艺流程如下:
已知:①焙烧后 、
、 、
、 分别生成
分别生成 、
、 、
、 。
。
② 价钒在溶液中的主要存在形式与溶液
价钒在溶液中的主要存在形式与溶液 的关系如下表:
的关系如下表:
(1)写出焙烧时 发生反应的化学方程式:
发生反应的化学方程式:_____________________ 。
(2)“滤渣Ⅰ”的成分是________________ (写化学式)。
(3)用离子方程式表示 溶液显碱性的原因:
溶液显碱性的原因:_______________________ ; 的
的 溶液中各离子浓度由大到小的顺序为
溶液中各离子浓度由大到小的顺序为________________ 。
(4)“沉钒”操作中,需控制溶液的 为
为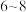 ,原因为
,原因为_______________________________ 。
(5)煅烧生成的气体产物可以用_________ 溶液吸收后返回到_________ 工序重新利用。
 可用作合金添加剂、有机化工的催化剂。钒钛磁铁矿炼钢后剩余的尾渣中含有
可用作合金添加剂、有机化工的催化剂。钒钛磁铁矿炼钢后剩余的尾渣中含有 、
、 、
、 、
、 、
、 等,利用该钒渣制备
等,利用该钒渣制备 的工艺流程如下:
的工艺流程如下:
已知:①焙烧后
 、
、 、
、 分别生成
分别生成 、
、 、
、 。
。②
 价钒在溶液中的主要存在形式与溶液
价钒在溶液中的主要存在形式与溶液 的关系如下表:
的关系如下表:
|
|
|
|
|
主要离子 |
|
|
|
|
(1)写出焙烧时
 发生反应的化学方程式:
发生反应的化学方程式:(2)“滤渣Ⅰ”的成分是
(3)用离子方程式表示
 溶液显碱性的原因:
溶液显碱性的原因: 的
的 溶液中各离子浓度由大到小的顺序为
溶液中各离子浓度由大到小的顺序为(4)“沉钒”操作中,需控制溶液的
 为
为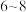 ,原因为
,原因为(5)煅烧生成的气体产物可以用
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】已知下列反应的热化学方程式为:
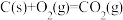
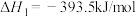

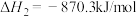
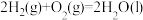
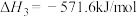
请计算
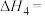
_____________ 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
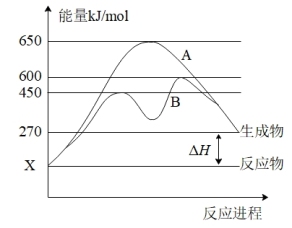
①据图判断该反应是_______ (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,降低温度,反应物的转化率_______ (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为__________ (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)一定温度下,在3L容积可变的密闭容器中发生反应H2(g)+CO2(g) H2O (g)+CO(g),已知c(CO)与反应时间t变化曲线I如图所示,
H2O (g)+CO(g),已知c(CO)与反应时间t变化曲线I如图所示,
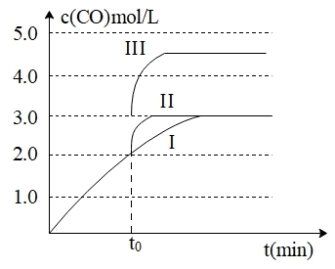
若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。 当曲线I变为曲线II时,改变的条件是_______________ 。当曲线I变为曲线III时,改变的条件是________ .
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的乙酸与0.1 mol/LNaOH溶液等体积混合后溶液显酸性,则混合溶液中离子浓度由大到小的顺序为_________________________ 。
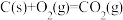
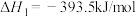

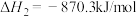
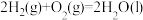
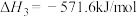
请计算

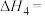
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断该反应是
②其中B历程表明此反应采用的条件为
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)一定温度下,在3L容积可变的密闭容器中发生反应H2(g)+CO2(g)
 H2O (g)+CO(g),已知c(CO)与反应时间t变化曲线I如图所示,
H2O (g)+CO(g),已知c(CO)与反应时间t变化曲线I如图所示,
若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。 当曲线I变为曲线II时,改变的条件是
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的乙酸与0.1 mol/LNaOH溶液等体积混合后溶液显酸性,则混合溶液中离子浓度由大到小的顺序为
您最近一年使用:0次