研究 、
、 、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为: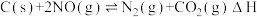 。某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温
。某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温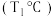 条件下反应,反应进行到不同时间测得各物质的浓度如下.
条件下反应,反应进行到不同时间测得各物质的浓度如下.
① 时,该反应的平衡常数
时,该反应的平衡常数
______  保留两位小数
保留两位小数 .
.
② 后,改变某一条件,反应重新达到平衡,则改变的条件可能是
后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ______ ;
③若30min后升高温度至 ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、 、
、 的浓度之比为5:3:3,则该反应的
的浓度之比为5:3:3,则该反应的
______  填“
填“ ”、“
”、“ ”或“
”或“ ”
”
(2)用 催化还原氮氧化物可以消除氮氧化物的污染.已知:
催化还原氮氧化物可以消除氮氧化物的污染.已知:
①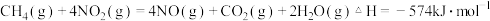
②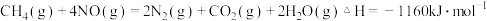
③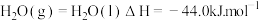
写出 与
与 反应生成
反应生成 、
、 和
和 的热化学方程式
的热化学方程式 ______
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的 ,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用
,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用 外,还能得到一种复合肥料.
外,还能得到一种复合肥料.
①该复合肥料可能的化学式为______  写出一种即可
写出一种即可 .
.
②若氨水与 恰好完全反应生成正盐,则此时溶液呈
恰好完全反应生成正盐,则此时溶液呈 ______ 性 填“酸”或“碱”
填“酸”或“碱” .
. 已知常温下:氨水
已知常温下:氨水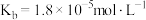 ,
,
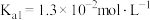 ,
,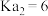 .
.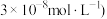
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为______  常温下,
常温下, 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数
______ .

 、
、 、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.(1)用活性炭还原法处理氮氧化物.有关反应为:
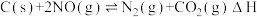 。某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温
。某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温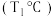 条件下反应,反应进行到不同时间测得各物质的浓度如下.
条件下反应,反应进行到不同时间测得各物质的浓度如下.| 浓度/mol·L-1 时间/min | NO |  |  |
| 0 |  | 0 | 0 |
| 10 | 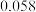 |  |  |
| 20 | 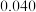 | 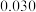 | 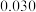 |
| 30 | 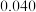 | 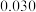 | 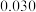 |
| 40 | 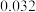 | 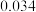 |  |
| 50 | 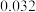 | 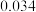 |  |
 时,该反应的平衡常数
时,该反应的平衡常数
 保留两位小数
保留两位小数 .
.②
 后,改变某一条件,反应重新达到平衡,则改变的条件可能是
后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ③若30min后升高温度至
 ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、 、
、 的浓度之比为5:3:3,则该反应的
的浓度之比为5:3:3,则该反应的
 填“
填“ ”、“
”、“ ”或“
”或“ ”
”
(2)用
 催化还原氮氧化物可以消除氮氧化物的污染.已知:
催化还原氮氧化物可以消除氮氧化物的污染.已知:①
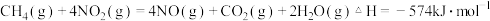
②
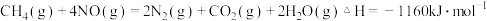
③
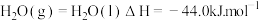
写出
 与
与 反应生成
反应生成 、
、 和
和 的热化学方程式
的热化学方程式 (3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的
 ,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用
,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用 外,还能得到一种复合肥料.
外,还能得到一种复合肥料.①该复合肥料可能的化学式为
 写出一种即可
写出一种即可 .
.②若氨水与
 恰好完全反应生成正盐,则此时溶液呈
恰好完全反应生成正盐,则此时溶液呈  填“酸”或“碱”
填“酸”或“碱” .
. 已知常温下:氨水
已知常温下:氨水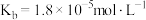 ,
,
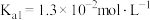 ,
,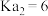 .
.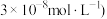
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为
 常温下,
常温下, 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数

更新时间:2020-02-13 11:06:21
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】国家主席习近平在2020年9月22日召开的第七十五届联合国大会上表示:“中国将争取在2060年前实现碳中和”。回答下列问题:
(1) 催化加氢法:以下是
催化加氢法:以下是 催化加氢合成二甲醚发生的两个主要反应:
催化加氢合成二甲醚发生的两个主要反应:
反应Ⅰ:
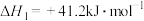
反应Ⅱ:
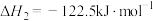
①反应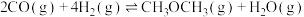

___________  。
。
②在恒压、 和
和 起始量一定的条件下,
起始量一定的条件下, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如图所示。其中:
的选择性随温度的变化如图所示。其中: 的选择性
的选择性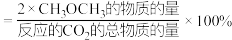 。
。
一定温度下,向 恒容容器中加入
恒容容器中加入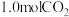 和
和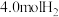 发生上述反应,达到平衡时测得
发生上述反应,达到平衡时测得 转化率为50%,
转化率为50%, 选择性为
选择性为 ,则平衡时体系中生成的
,则平衡时体系中生成的 的物质的量为
的物质的量为___________  。
。
③对于上述反应体系,下列说法错误的是___________ (填标号)。
A.增大 的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂, 的平衡转化率增大
的平衡转化率增大
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
④ 前,
前, 平衡转化率随温度升高而下降的原因是
平衡转化率随温度升高而下降的原因是___________ 。
(2)已知:
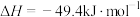 。该反应的正反应速率可表示为
。该反应的正反应速率可表示为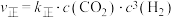 ,逆反应速率可表示为
,逆反应速率可表示为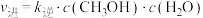 ,其中
,其中 、
、 为速率常数。下图中能够代表
为速率常数。下图中能够代表 的曲线为
的曲线为___________ (填“ ”“
”“ ”“
”“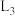 ”或“
”或“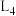 ”)。
”)。

(3)在一密闭容器中投入 和
和 发生反应
发生反应
 ,实验测得平衡时甲醇的物质的量随温度、压强变化关系如图所示:
,实验测得平衡时甲醇的物质的量随温度、压强变化关系如图所示:

①M、N两点的化学反应速率: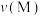
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②当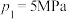 时,M点的
时,M点的
___________ 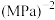 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。计算结果用最简分式表示)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。计算结果用最简分式表示)。
(1)
 催化加氢法:以下是
催化加氢法:以下是 催化加氢合成二甲醚发生的两个主要反应:
催化加氢合成二甲醚发生的两个主要反应:反应Ⅰ:

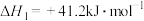
反应Ⅱ:

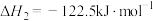
①反应
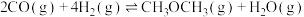

 。
。②在恒压、
 和
和 起始量一定的条件下,
起始量一定的条件下, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如图所示。其中:
的选择性随温度的变化如图所示。其中: 的选择性
的选择性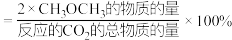 。
。
一定温度下,向
 恒容容器中加入
恒容容器中加入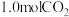 和
和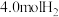 发生上述反应,达到平衡时测得
发生上述反应,达到平衡时测得 转化率为50%,
转化率为50%, 选择性为
选择性为 ,则平衡时体系中生成的
,则平衡时体系中生成的 的物质的量为
的物质的量为 。
。③对于上述反应体系,下列说法错误的是
A.增大
 的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
的浓度,反应Ⅰ、Ⅱ的正反应速率均增加B.加入催化剂,
 的平衡转化率增大
的平衡转化率增大C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
④
 前,
前, 平衡转化率随温度升高而下降的原因是
平衡转化率随温度升高而下降的原因是(2)已知:

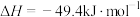 。该反应的正反应速率可表示为
。该反应的正反应速率可表示为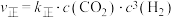 ,逆反应速率可表示为
,逆反应速率可表示为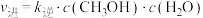 ,其中
,其中 、
、 为速率常数。下图中能够代表
为速率常数。下图中能够代表 的曲线为
的曲线为 ”“
”“ ”“
”“ ”或“
”或“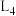 ”)。
”)。
(3)在一密闭容器中投入
 和
和 发生反应
发生反应
 ,实验测得平衡时甲醇的物质的量随温度、压强变化关系如图所示:
,实验测得平衡时甲醇的物质的量随温度、压强变化关系如图所示:
①M、N两点的化学反应速率:
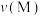
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②当
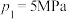 时,M点的
时,M点的
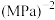 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。计算结果用最简分式表示)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。计算结果用最简分式表示)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】采用N2O5为硝化剂是一种新型的绿色硝化技术,F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4 kJ· mol-1
N2O4(g) 2NO2(g) △H2=+55.3 kJ· mol-1
2NO2(g) △H2=+55.3 kJ· mol-1
则反应N2O5(g)=2NO2(g)+ O2(g)的 △H=
O2(g)的 △H=________ kJ· mol-1。
(2)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强介p∞(35℃)______ 63.1kPa(填“大于”“等于”或“小于”),原因是________________________________________________ 。
(3)25℃时N2O4(g) 2NO2(g)反应的平衡常数Kp=
2NO2(g)反应的平衡常数Kp=________ kPa (Kp为以分压表示的平衡常数,计算结果保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______ 。

(4)邻二甲苯经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX)。某研究小组研究了采用N2O5为硝化剂时催化剂用量对该反应的影响。将一定量的催化剂和邻二甲苯置于反应瓶中,控制温度反应一定时间。测得邻二甲苯的转化率和3-NOX的选择性如图所示:

①描述并解释随着催化剂用量的增加,邻二甲苯转化率的变化趋势:____________ 。
②在图中画出4-NOX的选择性随催化剂用量变化的曲线_____________ 。

其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
N2O4(g)
 2NO2(g) △H2=+55.3 kJ· mol-1
2NO2(g) △H2=+55.3 kJ· mol-1则反应N2O5(g)=2NO2(g)+
 O2(g)的 △H=
O2(g)的 △H=(2)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强介p∞(35℃)
(3)25℃时N2O4(g)
 2NO2(g)反应的平衡常数Kp=
2NO2(g)反应的平衡常数Kp=
(4)邻二甲苯经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX)。某研究小组研究了采用N2O5为硝化剂时催化剂用量对该反应的影响。将一定量的催化剂和邻二甲苯置于反应瓶中,控制温度反应一定时间。测得邻二甲苯的转化率和3-NOX的选择性如图所示:

①描述并解释随着催化剂用量的增加,邻二甲苯转化率的变化趋势:
②在图中画出4-NOX的选择性随催化剂用量变化的曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知CH4、CO、H2的燃烧热分别为akJ/mol、bkJ/mol、ckJ/mol。18g液态水转化为气态水吸热dkJ/mol。利用甲烷制备合成气的化学方程式CH4(g)+H2O(g) CO(g)+3H2(g) ΔH。
CO(g)+3H2(g) ΔH。
①ΔH=__ kJ/mol。
②一定温度下,在恒容的密闭容器中发生上述反应,下列表示反应达到平衡状态的有___ (填字母)。
A.v正(CH4)=v逆(H2O)
B.气体压强不再变化
C.单位时间每消耗1molCH4,同时产生3molH2
D.CH4与H2的物质的量之比为1∶3
(2)在某密闭容器中通入2molCH4和2molH2O(g),在不同条件下发生反应CH4(g)+H2O(g)⇌CO(g)+3H2(g),测得平衡时CH4的体积分数与温度、压强的关系如图所示。
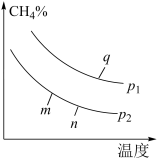
①p1___ p2(填“<”、“>”或“=”),该反应为___ (填吸或放)热反应。
②m、n、q三点的化学平衡常数大小关系为__ 。
③若q点对应的纵坐标为30,此时甲烷的转化率为___ ,该条件下的化学平衡常数Kp=___ (用含有P1的表达式表示,Kp为以分压表示的平衡常数)。
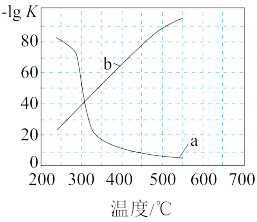
(3)实验测定该反应的化学平衡常数Kp随温度变化的曲线是如图中的___ (填a、b),理由是___ 。
(1)已知CH4、CO、H2的燃烧热分别为akJ/mol、bkJ/mol、ckJ/mol。18g液态水转化为气态水吸热dkJ/mol。利用甲烷制备合成气的化学方程式CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH。
CO(g)+3H2(g) ΔH。①ΔH=
②一定温度下,在恒容的密闭容器中发生上述反应,下列表示反应达到平衡状态的有
A.v正(CH4)=v逆(H2O)
B.气体压强不再变化
C.单位时间每消耗1molCH4,同时产生3molH2
D.CH4与H2的物质的量之比为1∶3
(2)在某密闭容器中通入2molCH4和2molH2O(g),在不同条件下发生反应CH4(g)+H2O(g)⇌CO(g)+3H2(g),测得平衡时CH4的体积分数与温度、压强的关系如图所示。

①p1
②m、n、q三点的化学平衡常数大小关系为
③若q点对应的纵坐标为30,此时甲烷的转化率为
(3)实验测定该反应的化学平衡常数Kp随温度变化的曲线是如图中的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】I、丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
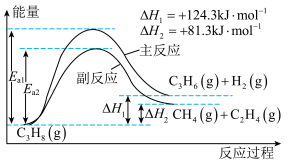
(1)由上图可知,主反应在___________________ (选“高温”或“低温”)时更加容易自发进行
(2)丙烷脱氢制丙烯的过程中。恒压时向原料气中掺入高温水蒸气,则 K(主反应)___________________ (填“增大”、“减小”或“不变”,下同),转化率 α (C3H8)___________________ 。温度升高,副反应更容易发生的主要原因是___________________ 。
(3)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为 104 Pa 和 105 Pa)。
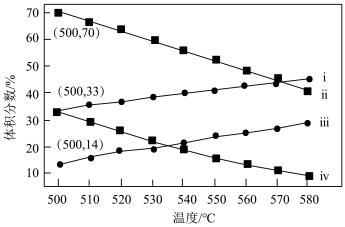
105 Pa 时,图中表示丙烯的曲线是___________________ (填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
II、一定温度下,在 3.0L 密闭容器中,通入 0.10mol CH4和 0.20molNO2进行反应,CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g) △H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
(4)已知 4min 时容器中甲烷为 0.04mol,计算 0~4min 内 υ (NO2)=_________ ,该温度下的压强平衡常数 Kp=______ kPa。

(5)在一恒容密闭容器中,通入一定量 CH4和 NO2,测得在相同时间内,不同温度下,NO2 的转化率随温度的变化如图。c 点___________________ (填“是”或“不是”)反应达平衡的点。

(1)由上图可知,主反应在
(2)丙烷脱氢制丙烯的过程中。恒压时向原料气中掺入高温水蒸气,则 K(主反应)
(3)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为 104 Pa 和 105 Pa)。

105 Pa 时,图中表示丙烯的曲线是
II、一定温度下,在 3.0L 密闭容器中,通入 0.10mol CH4和 0.20molNO2进行反应,CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g) △H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:| 时间(t/min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强(p/kPa) | 480 | 544 | 576 | 592 | 600 | 600 |
(4)已知 4min 时容器中甲烷为 0.04mol,计算 0~4min 内 υ (NO2)=

(5)在一恒容密闭容器中,通入一定量 CH4和 NO2,测得在相同时间内,不同温度下,NO2 的转化率随温度的变化如图。c 点
您最近一年使用:0次
【推荐2】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=
CaCO3(s)+2H2(g),其反应的平衡常数K=____ (用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为_____ ;向该容器中补充amol炭,水蒸气的转化率将_____ (填“增大”、“减小”或“不变”)。
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡_____ 移动( 填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___ (填“变大”、“变小”或“不变”)。
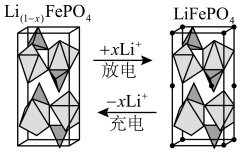
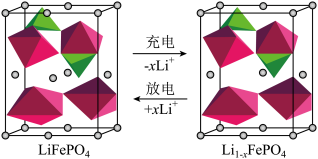
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:______ 。
Ⅰ.C(s)+H2O(g)
 CO(g)+H2(g) K1;
CO(g)+H2(g) K1;Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;Ⅲ.CaO(s)+CO2(g)
 CaCO3(s) K3;
CaCO3(s) K3;燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g),其反应的平衡常数K=
CaCO3(s)+2H2(g),其反应的平衡常数K=(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】空气质量评价的主要污染物为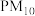 、
、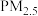 、
、 、
、 、
、 、CO等物质。研究碳、氮、硫及其化合物的转化,对于消除环境污染有重要意义。
、CO等物质。研究碳、氮、硫及其化合物的转化,对于消除环境污染有重要意义。
(1)用 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
已知: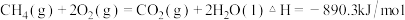
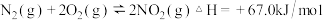
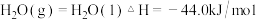
写出 催化还原
催化还原 生成
生成 和
和 的热化学方程式:
的热化学方程式:________
(2)体积可变的密闭容器如图1,现将4molNO和3mol 放入容器,移动活塞至体积V为2L,用铆钉固定在A、B点,发生反应
放入容器,移动活塞至体积V为2L,用铆钉固定在A、B点,发生反应 (不考虑
(不考虑 转化为
转化为 )。测定不同条件、不同时间段内的NO的转化率,得到如表数据:
)。测定不同条件、不同时间段内的NO的转化率,得到如表数据:

①根据上表数据,请比较T1______ (T2填“ ”“
”“ ”或“
”或“ ”)
”)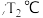 下,第30min时,
下,第30min时,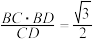
___________ 该温度下的化学平衡常数为___________ 。
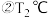 下,第40min时,拔去铆钉
下,第40min时,拔去铆钉 容器密封性良好
容器密封性良好 后,活塞没有发生移动,再向容器中通入3molNO和
后,活塞没有发生移动,再向容器中通入3molNO和 ,此时v(正)
,此时v(正)_____ v(逆)填(“ ”
” ”或“
”或“ ”)。
”)。
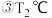 下,上述反应重新达到平衡后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是
下,上述反应重新达到平衡后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是___________  填字母代号
填字母代号
A.气体颜色加深
B.单位时间内消耗 和
和 的物质的量之比大于1:2
的物质的量之比大于1:2
C.NO的百分含量减少
 用
用 催化还原
催化还原 也可以消除氮氧化物的污染。如图2采用
也可以消除氮氧化物的污染。如图2采用 作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为
作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为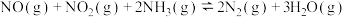 。
。
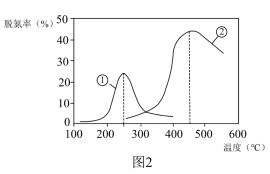
①该反应的
___________ 0,∆H_______ (填 ”
” ”或“
”或“ ”)。
”)。
②下列说法正确的是___________  填字母代号
填字母代号 。
。
A.在相同条件下,第②种催化剂比第①种催化剂脱氮率高
B.在相同条件下,改变压强对脱氮率没有影响
C.催化剂①②分别适合于 和
和 左右脱氮
左右脱氮
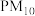 、
、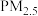 、
、 、
、 、
、 、CO等物质。研究碳、氮、硫及其化合物的转化,对于消除环境污染有重要意义。
、CO等物质。研究碳、氮、硫及其化合物的转化,对于消除环境污染有重要意义。(1)用
 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。已知:
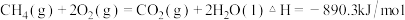
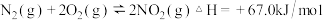
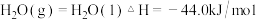
写出
 催化还原
催化还原 生成
生成 和
和 的热化学方程式:
的热化学方程式:(2)体积可变的密闭容器如图1,现将4molNO和3mol
 放入容器,移动活塞至体积V为2L,用铆钉固定在A、B点,发生反应
放入容器,移动活塞至体积V为2L,用铆钉固定在A、B点,发生反应 (不考虑
(不考虑 转化为
转化为 )。测定不同条件、不同时间段内的NO的转化率,得到如表数据:
)。测定不同条件、不同时间段内的NO的转化率,得到如表数据:
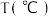 | 10min | 20min | 30min | 40min |
 |  |  |  |  |
 |  |  | 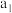 | 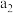 |
①根据上表数据,请比较T1
 ”“
”“ ”或“
”或“ ”)
”)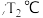 下,第30min时,
下,第30min时,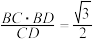
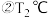 下,第40min时,拔去铆钉
下,第40min时,拔去铆钉 容器密封性良好
容器密封性良好 后,活塞没有发生移动,再向容器中通入3molNO和
后,活塞没有发生移动,再向容器中通入3molNO和 ,此时v(正)
,此时v(正) ”
” ”或“
”或“ ”)。
”)。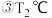 下,上述反应重新达到平衡后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是
下,上述反应重新达到平衡后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是 填字母代号
填字母代号
A.气体颜色加深
B.单位时间内消耗
 和
和 的物质的量之比大于1:2
的物质的量之比大于1:2C.NO的百分含量减少
 用
用 催化还原
催化还原 也可以消除氮氧化物的污染。如图2采用
也可以消除氮氧化物的污染。如图2采用 作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为
作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为 。
。
①该反应的

 ”
” ”或“
”或“ ”)。
”)。②下列说法正确的是
 填字母代号
填字母代号 。
。A.在相同条件下,第②种催化剂比第①种催化剂脱氮率高
B.在相同条件下,改变压强对脱氮率没有影响
C.催化剂①②分别适合于
 和
和 左右脱氮
左右脱氮
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】NaClO和KAl(SO4)2都是重要的化工产品,均可用于造纸业。
(1)NaClO溶液pH>7,用离子方程式表示原因_______ 。
(2)在纸浆中加入NaClO溶液的目的是_______ 。
(3)用如图装置探究饱和NaClO和KAl(SO4)2溶液反应的实验。打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是________ 。

(4)下表为常温下浓度均为0.1mol/L的5种溶液的pH:
下列反应不能发生的是_______(填编号)。
(5)室温下,下列溶液中粒子的物质的量浓度关系正确的是_______。
(1)NaClO溶液pH>7,用离子方程式表示原因
(2)在纸浆中加入NaClO溶液的目的是
(3)用如图装置探究饱和NaClO和KAl(SO4)2溶液反应的实验。打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是

(4)下表为常温下浓度均为0.1mol/L的5种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| A.CO2+H2O+2NaClO=Na2CO3+2HClO |
| B.CO2+H2O+NaClO=NaHCO3+HClO |
| C.CH3COOH+NaCN=CH3COONa+HCN |
| D.CH3COOH+NaClO=CH3COONa+HClO |
A.Na2CO3溶液:2c(Na+)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
| B.NaClO溶液:c(Na+)>c(ClO-)>c(OH-)>c(H+) |
C.NaHCO3溶液:c(H+)+c(HCO )+2c(H2CO3)=c(OH-) )+2c(H2CO3)=c(OH-) |
D.pH=2的HCl与pH=12的氨水等体积混合,所得溶液中:c(NH )+c(OH-)>c(Cl-)+c(H+) )+c(OH-)>c(Cl-)+c(H+) |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】食醋(主要成分CH3COOH )、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题:
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____ (填代号。)
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=____
⑶常温下,将20mL 0.1mol/L CH3COOH溶液 和20mL 0.1mol/LHNO2 溶液分别与 20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,则表示CH3COOH溶液的曲线是_______ (填写序号);

⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示 ,则HX的电离平衡常数
,则HX的电离平衡常数______ (填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=
⑶常温下,将20mL 0.1mol/L CH3COOH溶液 和20mL 0.1mol/LHNO2 溶液分别与 20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,则表示CH3COOH溶液的曲线是

⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示
 ,则HX的电离平衡常数
,则HX的电离平衡常数⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】I.氮元素有着多变价态和种类繁多的化合物,它们在工农业生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
①比较K1、K2的大小:K1___________ K2(填“>”、“=”或“<”)。
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是___________ (填序号)。
a.2v(H2)正=3v(NH3)逆 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率___________ (填“增大”、“减小”或“不变”);平衡向___________ 方向移动。
II.某酸HA是一元弱酸,25℃时的电离平衡常数Ka=4.0×10-8。
(2)写出该酸的电离方程式___________ ,其电离平衡常数表达式
___________ 。
(3)25℃时,向1moL·L-1HA溶液中加入1moL·L-1盐酸,会___________ (“抑制”或“促进”) 的电离,c(H+)
的电离,c(H+)___________ (填“增大”、“减小”或“不变”),电离平衡常数Ka=______ (填“增大”、“减小”或“不变”)
(4)25℃时,若 的起始浓度为0.01moL·L-1,则平衡时c(H+)=
的起始浓度为0.01moL·L-1,则平衡时c(H+)=_________ mol/L
(1)在一密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是
a.2v(H2)正=3v(NH3)逆 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率
II.某酸HA是一元弱酸,25℃时的电离平衡常数Ka=4.0×10-8。
(2)写出该酸的电离方程式

(3)25℃时,向1moL·L-1HA溶液中加入1moL·L-1盐酸,会
 的电离,c(H+)
的电离,c(H+)(4)25℃时,若
 的起始浓度为0.01moL·L-1,则平衡时c(H+)=
的起始浓度为0.01moL·L-1,则平衡时c(H+)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】开发使用新型电池技术是减少传统化石燃料的使用、实现“碳达峰“”*碳中和”战略的重要手段。
(1)科学家利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O 2HCOOH+O2.通入CO2的电极II为电池的
2HCOOH+O2.通入CO2的电极II为电池的_______ 极,其电极反应式为_______ 。通过质子膜的微粒移动方向为_______ (填 “由左向右”或“由右向左”)。电极I周围的pH随着过程的进行将_______ (填“减小”、“增大”或“不变”)。
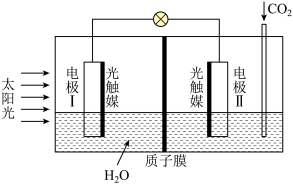
(2)使用刀片电池的比亚迪新能源汽车续航里程大大提高,刀片电池主要使用LiFePO4技术。作为电极材料之一的LiFePO4在充放电过程中的示意图如图所示,放电时,其正极反应式为_______ ,充电时,LiFePO4电极应连接电源的_______ 极。
(1)科学家利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O
 2HCOOH+O2.通入CO2的电极II为电池的
2HCOOH+O2.通入CO2的电极II为电池的
(2)使用刀片电池的比亚迪新能源汽车续航里程大大提高,刀片电池主要使用LiFePO4技术。作为电极材料之一的LiFePO4在充放电过程中的示意图如图所示,放电时,其正极反应式为

您最近一年使用:0次
【推荐2】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如图:
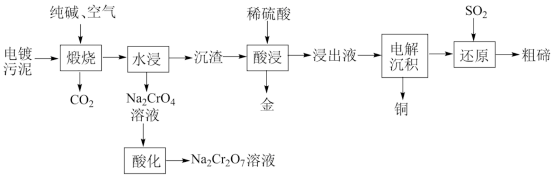
已知:煅烧时,Cu2Te发生的反应为:Cu2Te+2O2→2CuO+TeO2。
(1)Te元素在元素周期表中的位置为_____ ,该元素最高化合价____ 。
(2)煅烧时,Cr2O3发生反应的化学方程式为_____ 。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还含有_____ (填化学式)。电解沉积过程中析出单质铜的电极为____ 极。
(4)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
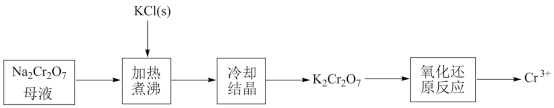
通过冷却结晶能析出大量K2Cr2O7的原因是_____ 。
(5)测定产品中K2Cr2O7含量的方法如下:称取试样2.50g配成250mL溶液,取25.00mL置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol•L-1(NH4)2Fe(SO4)2标准液进行滴定。滴定过程中发生反应的离子方程式为____ 。

已知:煅烧时,Cu2Te发生的反应为:Cu2Te+2O2→2CuO+TeO2。
(1)Te元素在元素周期表中的位置为
(2)煅烧时,Cr2O3发生反应的化学方程式为
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还含有
(4)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:

通过冷却结晶能析出大量K2Cr2O7的原因是
(5)测定产品中K2Cr2O7含量的方法如下:称取试样2.50g配成250mL溶液,取25.00mL置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol•L-1(NH4)2Fe(SO4)2标准液进行滴定。滴定过程中发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】电镀实验在生产生活中应用广泛。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是___________ (填阴极或阳极),对应的电极方程式为:___________ ;如图装置电解一段时间后,溶液中___________ (填微粒化学式)浓度下降,从而影响镀铜的速率和质量。
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
(2)实验①中,无色气体产生的原因是 或
或___________ 。
(3)实验①中,气体减少,推测是由于溶液中 减少,且
减少,且___________ 。
(4)欲测定实验①溶液中 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的___________ ,用 标准溶液滴定时应选用
标准溶液滴定时应选用___________ 滴定管(填“酸式”或“碱式”)。
(5)为确定实验①电解质溶液中 的准确浓度
的准确浓度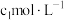 ,实验操作为:准确量取
,实验操作为:准确量取 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用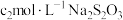 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: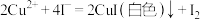 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为___________ ,滴定终点观察到的现象为:当滴入最后半滴标准溶液时,锥形㼛中溶液___________ 。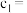
___________ (用 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果___________ (填“偏大”“偏小”或“无影响”)。
(6)实验②中, 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为___________ ,反应后的体系呈___________ 色。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
| 装置示意图 | 序号 | 电解质溶液 | 实验现象 |
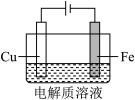 | ① | 0.1mol/L +少量 +少量 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,铁电极表面有 生成。 生成。 |
| ② | 0.1mol/L +过量氨水 +过量氨水 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体,经检验,电解液中无Fe元素。 |
 或
或(3)实验①中,气体减少,推测是由于溶液中
 减少,且
减少,且(4)欲测定实验①溶液中
 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的 标准溶液滴定时应选用
标准溶液滴定时应选用(5)为确定实验①电解质溶液中
 的准确浓度
的准确浓度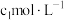 ,实验操作为:准确量取
,实验操作为:准确量取 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用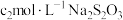 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: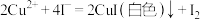 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为
 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果(6)实验②中,
 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为
您最近一年使用:0次



