1 . 以 、
、 为原料合成
为原料合成 是工业上的成熟方法。我国科学家用
是工业上的成熟方法。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为
转化为 (甲醇)。
(甲醇)。
(1) 和
和 制取
制取 的反应,一般认为通过如下步骤实现:
的反应,一般认为通过如下步骤实现:
①

②
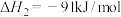
则

_________ 。
(2)某温度的恒容密闭容器中,以 和
和 为原料制取
为原料制取 ,
, 和
和 的起始浓度分别为a
的起始浓度分别为a 和
和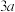
 ,
, 转化为
转化为 的平衡转化率为b,则平衡时
的平衡转化率为b,则平衡时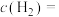
_________ 。
(3)恒压下, 和
和 起始物质的量比为1∶3时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图1所示,其中分子筛膜能选择性分离出
起始物质的量比为1∶3时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图1所示,其中分子筛膜能选择性分离出 。
。
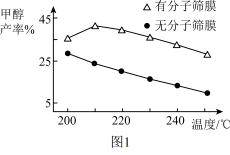
①无分子筛膜时,甲醇平衡产率随温度升高而降低的原因是_________ 。
②有分子筛膜时,随温度升高甲醇平衡产率先升高后降低的原因是_________ 。
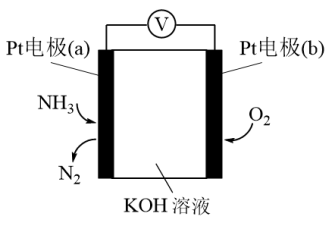
(4)用稀硫酸作电解质溶液,电解 也可制取
也可制取 ,装置如图2所示,电极b为电解池的
,装置如图2所示,电极b为电解池的_________ 极(填“阴”或“阳”),生成 的电极反应式是
的电极反应式是_________ 。

 、
、 为原料合成
为原料合成 是工业上的成熟方法。我国科学家用
是工业上的成熟方法。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为
转化为 (甲醇)。
(甲醇)。(1)
 和
和 制取
制取 的反应,一般认为通过如下步骤实现:
的反应,一般认为通过如下步骤实现:①


②

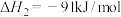
则


(2)某温度的恒容密闭容器中,以
 和
和 为原料制取
为原料制取 ,
, 和
和 的起始浓度分别为a
的起始浓度分别为a 和
和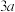
 ,
, 转化为
转化为 的平衡转化率为b,则平衡时
的平衡转化率为b,则平衡时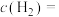
(3)恒压下,
 和
和 起始物质的量比为1∶3时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图1所示,其中分子筛膜能选择性分离出
起始物质的量比为1∶3时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图1所示,其中分子筛膜能选择性分离出 。
。
①无分子筛膜时,甲醇平衡产率随温度升高而降低的原因是
②有分子筛膜时,随温度升高甲醇平衡产率先升高后降低的原因是
(4)用稀硫酸作电解质溶液,电解
 也可制取
也可制取 ,装置如图2所示,电极b为电解池的
,装置如图2所示,电极b为电解池的 的电极反应式是
的电极反应式是
您最近一年使用:0次
解题方法
2 . 合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH1=−akJ·mol-1
O2(g)+2H2(g)=2H2O(l) ΔH2=−bkJ·mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是___________ 。
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下H2的转化率为___________ ,平衡常数K=___________ (可用分数表示)。
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________ (填“正向”、“逆向”或“无法判断”)。
③L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

i.X代表的物理量是___________ 。
ii.判断L1、L2的大小关系,并简述理由___________ 。
(3)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示,则a极的电极反应式为___________ 。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH1=−akJ·mol-1
O2(g)+2H2(g)=2H2O(l) ΔH2=−bkJ·mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
| 物质 | N2 | H2 | NH3 |
| 平衡时物质的量/mol | 0.2 | 0.6 | 0.2 |
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为
| 物质 | N2 | H2 | NH3 |
| 起始浓度(mol/L) | 0.5 | 1.5 | 0.5 |

i.X代表的物理量是
ii.判断L1、L2的大小关系,并简述理由
(3)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示,则a极的电极反应式为

您最近一年使用:0次



