名校
解题方法
1 . 以CO和 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。
已知:①
 kJ·mol
kJ·mol
②
 kJ·mol
kJ·mol
③
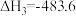 kJ·mol
kJ·mol
下列说法不正确 的是
 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。已知:①

 kJ·mol
kJ·mol
②

 kJ·mol
kJ·mol
③

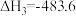 kJ·mol
kJ·mol
下列说法
A.若温度不变,反应①中生成1 mol  时,放出的热量大于90.5 kJ 时,放出的热量大于90.5 kJ |
B. 与 与 合成甲醇的热化学方程式为: 合成甲醇的热化学方程式为:  kJ·mol kJ·mol |
C.通过电解制 和选用高效催化剂,可降低 和选用高效催化剂,可降低 与 与 合成甲醇反应的焓变 合成甲醇反应的焓变 |
D.以 和 和 为原料合成甲醇,同时生成 为原料合成甲醇,同时生成 ,该反应需要吸收能量 ,该反应需要吸收能量 |
您最近一年使用:0次
2022-11-27更新
|
929次组卷
|
7卷引用:北京市海淀区2021-2022学年高三上学期期中考试化学试题
北京市海淀区2021-2022学年高三上学期期中考试化学试题天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题北京市第二十二中学2021-2022学年高三上学期12月阶段性测试理科化学试题北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题(已下线)2023年北京卷高考真题变式题(选择题11-14)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)化学反应的热效应
名校
解题方法
2 . 工业上采用 CO 或 CO2以及 H2为原料催化合成甲醇。两种方法如下
方法1:CO(g)+2H2(g)=CH3OH(g) ΔH = -90.14 kJ/mol
方法2:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH = -48.97 kJ/mol
两种方法同时存在以下副反应
副反应 1:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)
副反应 2:CO2(g)+H2(g)⇌CO(g)+H2O(g)
资料:甲醇沸点 64.7℃ 甲醚沸点-23℃
Ⅰ.使用方法1,利用焦炉气(主要含 CH4、CO、H2 等气体,并含有少量水蒸气)合成甲醇
(1)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=_____________
(2)合成前,焦炉气中甲烷需要在高温条件下和水蒸气催化生成 CO 和 H2,该反应的化学方程式为_________________________ 。
(3)向焦炉气中补充少量 CO2,可以减少 CH3OCH3(g)的生成,请结合平衡移动原理解释原因______________________ 。
(4)将反应后气体冷凝可以得到粗甲醇,继续纯化的操作是________________ 。
II.利用方法2,使用工业废气(主要含 CO2)和H2合成甲醇
(5)实验测得相同时间,不同温度下甲醇产率图象如下图所示。图中前两个数据点远远低于平衡产率,可能原因是________________________ 。

(6)图中后两个数据点呈现随温度升高而下降的趋势,对该趋势的解释合理是________ 。(答出一条即可)
(7)下表是不同催化剂成分对甲醇催化选择性的数据。在该实验条件下,一定能增加催化剂对甲醇选择性的物质是________________ 。
方法1:CO(g)+2H2(g)=CH3OH(g) ΔH = -90.14 kJ/mol
方法2:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH = -48.97 kJ/mol
两种方法同时存在以下副反应
副反应 1:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)
副反应 2:CO2(g)+H2(g)⇌CO(g)+H2O(g)
资料:甲醇沸点 64.7℃ 甲醚沸点-23℃
Ⅰ.使用方法1,利用焦炉气(主要含 CH4、CO、H2 等气体,并含有少量水蒸气)合成甲醇
(1)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=
(2)合成前,焦炉气中甲烷需要在高温条件下和水蒸气催化生成 CO 和 H2,该反应的化学方程式为
(3)向焦炉气中补充少量 CO2,可以减少 CH3OCH3(g)的生成,请结合平衡移动原理解释原因
(4)将反应后气体冷凝可以得到粗甲醇,继续纯化的操作是
II.利用方法2,使用工业废气(主要含 CO2)和H2合成甲醇
(5)实验测得相同时间,不同温度下甲醇产率图象如下图所示。图中前两个数据点远远低于平衡产率,可能原因是

(6)图中后两个数据点呈现随温度升高而下降的趋势,对该趋势的解释合理是
(7)下表是不同催化剂成分对甲醇催化选择性的数据。在该实验条件下,一定能增加催化剂对甲醇选择性的物质是
| CuO | ZnO | Al2O3 | ZrO2 | MnO | 选择性 | |
| ① | 65.8% | 26.3% | 7.9% | 0 | 0 | 40% |
| ② | 62.4% | 25.0% | 0 | 12.6% | 0 | 88% |
| ③ | 65.8% | 26.5% | 0 | 3.6% | 4% | 100% |
| ④ | 65.8% | 26.5% | 0 | 5.6% | 2% | 91% |
您最近一年使用:0次
名校
解题方法
3 . 将CO2转化成C2H4可以变废为宝、改善环境。以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
Ⅰ.CO2(g) + C2H6(g) C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
Ⅱ.C2H6(g) CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
(1)反应I的反应历程可分为如下两步:
i.C2H6(g) C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
ii.H2(g)+CO2(g) H2O(g)+CO(g) ∆H2 (反应速率较慢)
H2O(g)+CO(g) ∆H2 (反应速率较慢)
①∆H2 =______ kJ·mol-1
②相比于提高c(C2H6),提高c(CO2) 对反应I速率影响更大,原因是______ 。
(2)0.1 MPa时向密闭容器中充入CO2和C2H6,温度对催化剂K-Fe-Mn/Si-2 性能的影响如图所示:
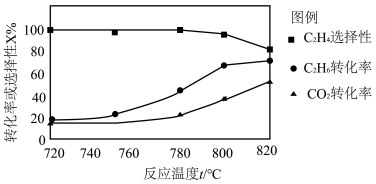
① 工业生产中反应I选择800℃,原因是______ 。
② 800℃时,不同的CO2和C2H6体积比对反应影响的实验数据如下表:
a. 随 增大, CO2转化率将
增大, CO2转化率将______ (填“增大”或“减小”)。
b. 解释 对产物中C2H4的质量分数影响的原因:
对产物中C2H4的质量分数影响的原因:______ 。
(3)我国科学家使用电化学的方法(装置如图)

用C2H6 和CO2合成了C2H4。
①N是电源的______ 极。
②阳极电极反应式是______ 。
Ⅰ.CO2(g) + C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)Ⅱ.C2H6(g)
 CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)(1)反应I的反应历程可分为如下两步:
i.C2H6(g)
 C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)ii.H2(g)+CO2(g)
 H2O(g)+CO(g) ∆H2 (反应速率较慢)
H2O(g)+CO(g) ∆H2 (反应速率较慢)①∆H2 =
②相比于提高c(C2H6),提高c(CO2) 对反应I速率影响更大,原因是
(2)0.1 MPa时向密闭容器中充入CO2和C2H6,温度对催化剂K-Fe-Mn/Si-2 性能的影响如图所示:

① 工业生产中反应I选择800℃,原因是
② 800℃时,不同的CO2和C2H6体积比对反应影响的实验数据如下表:
 | 平衡时有机产物的质量分数 | |
| CH4 | C2H4 | |
| 15.0/15.0 | 7.7 | 92.3 |
| 20.0/10.0 | 6.4 | 93.6 |
| 24.0 /6.0 | 4.5 | 95.5 |
 增大, CO2转化率将
增大, CO2转化率将b. 解释
 对产物中C2H4的质量分数影响的原因:
对产物中C2H4的质量分数影响的原因:(3)我国科学家使用电化学的方法(装置如图)

用C2H6 和CO2合成了C2H4。
①N是电源的
②阳极电极反应式是
您最近一年使用:0次
2020-11-09更新
|
274次组卷
|
4卷引用:北京市北京交通大学附属中学2020-2021学年高二上学期期末练习化学试题
名校
解题方法
4 . 甲醇(CH3OH)的合成与应用具有广阔的发展前景。
合成甲醇的部分工艺流程如下:原料气→预热装置→合成反应器→甲醇
(1)甲烷与水蒸气反应制备合成甲醇的原料气CO、CO2和H2。
CH4(g)+H2O(g)=CO(g)+3H2(g) ∆H =+206.2 kJ·mol-1
CO(g) + H2O(g) =CO2(g) + H2(g) ∆H =˗41.0 kJ·mol-1
甲烷与水蒸气反应生成CO2和H2的热化学方程式为__________________ 。
(2)在催化剂的作用下,200~300℃时,合成反应器内发生反应:
ⅰ.CO(g)+2H2(g)⇌CH3OH(g) ∆H<0
ⅱ.CO2(g)+3H2(g)⇌CH3OH(g) + H2O(g) ∆H<0
①一段时间内,记录合成反应器出、入口样品的温度,数据如图所示。曲线_______ 是合成反应器出口样品的温度。

②在催化剂的作用下,200~300℃时,合成反应器中有少量的副反应,会生成二甲醚(CH3OCH3)、甲酸甲酯等。
CO和H2生成二甲醚的化学方程式是______________ 。
(3)图为甲醇燃料电池的示意图。
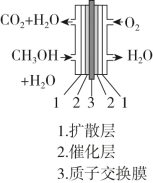
负极的电极反应式为______________ ;
正极的电极反应式为_______________ 。
合成甲醇的部分工艺流程如下:原料气→预热装置→合成反应器→甲醇
(1)甲烷与水蒸气反应制备合成甲醇的原料气CO、CO2和H2。
CH4(g)+H2O(g)=CO(g)+3H2(g) ∆H =+206.2 kJ·mol-1
CO(g) + H2O(g) =CO2(g) + H2(g) ∆H =˗41.0 kJ·mol-1
甲烷与水蒸气反应生成CO2和H2的热化学方程式为
(2)在催化剂的作用下,200~300℃时,合成反应器内发生反应:
ⅰ.CO(g)+2H2(g)⇌CH3OH(g) ∆H<0
ⅱ.CO2(g)+3H2(g)⇌CH3OH(g) + H2O(g) ∆H<0
①一段时间内,记录合成反应器出、入口样品的温度,数据如图所示。曲线

②在催化剂的作用下,200~300℃时,合成反应器中有少量的副反应,会生成二甲醚(CH3OCH3)、甲酸甲酯等。
CO和H2生成二甲醚的化学方程式是
(3)图为甲醇燃料电池的示意图。

负极的电极反应式为
正极的电极反应式为
您最近一年使用:0次
2020-10-14更新
|
153次组卷
|
2卷引用:北京市北大附中实验学校2020-2021学年高二上学期10月月考化学试题
名校
5 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
I. 甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为______ 。
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是______ 。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如右所示。
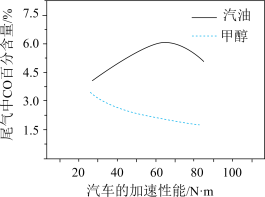
根据图信息分析,与汽油相比,甲醇作为燃料的优点是______ 。
II. 甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
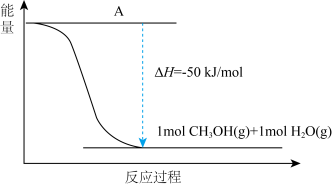
① 补全上图:图中A处应填入______ 。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______ (填“变大”“变小”或“不变”)。
(5)已知: CO(g)+1/2 O2(g) ==== CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) ==== H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g) + 2H2(g) ==== CH3OH(g) 。该反应的ΔH为_____ kJ/mol。
I. 甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如右所示。

根据图信息分析,与汽油相比,甲醇作为燃料的优点是
II. 甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

① 补全上图:图中A处应填入
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH
(5)已知: CO(g)+1/2 O2(g) ==== CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) ==== H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g) + 2H2(g) ==== CH3OH(g) 。该反应的ΔH为
您最近一年使用:0次
2019-07-07更新
|
1933次组卷
|
9卷引用:北京市海淀区2018-2019学年高二第二学期期末考试化学试题
北京市海淀区2018-2019学年高二第二学期期末考试化学试题北京市中央民族大学附属中学2019-2020学年高二下学期期末考试化学试题浙江省杭州市西湖高级中学2019-2020学年高二10月月考化学试题内蒙古包钢第一中学2019-2020学年高二上学期10月月考化学试题(已下线)第01章 化学反应与能量(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测(已下线)第1章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)四川省乐山市峨山彝族自治县第一中学2020-2021学年高二下学期4月月考化学试题四川省遂宁中学校2020-2021学年高二下学期第一次月考化学试题



