1 . CO2的资源化可以推动经济高质量发展和生态环境质量的持续改善。由CO2合成甲醇是CO2资源化利用的重要方法。
Ⅰ.合成甲醇
(1)由CO2催化加氢合成甲醇醇。
①一定条件下,由CO2和H2制备甲醇的过程中有下列反应:
反应1:CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
反应3:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
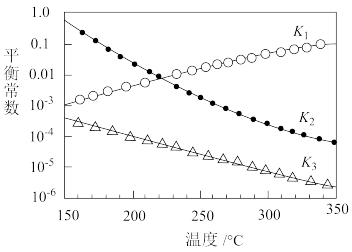
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。____ △H3(填“>”“<”或“=”)。
②对于上述CO2加氢合成CH3OH的反应体系,下列说法不正确 的是____ (填字母)。
a.增大初始投料比 ,有利于提高CO2的转化率
,有利于提高CO2的转化率
b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.体系达平衡后,若压缩容器体积,则反应1平衡不移动,反应3平衡正向移动
d.选用合适的催化剂可以提高反应3中CO2的平衡转化率
(2)电化学原理将CO2转化为甲醇。
在光电催化条件下可以高效地将CO2和H2O转化为甲醇,从电极反应的角度分析:
①甲醇在____ (填“阴”或“阳”)极生成;
②氧化反应为____ 。
Ⅱ.甲醇是重要的化工原料,也可用作甲醇燃料电池。以稀硫酸为电解质溶液,甲醇燃料电池的工作原理如图所示。_____ 。
(4)该电池负极的电极反应式是_____ 。
Ⅰ.合成甲醇
(1)由CO2催化加氢合成甲醇醇。
①一定条件下,由CO2和H2制备甲醇的过程中有下列反应:
反应1:CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1反应2:CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2反应3:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。
②对于上述CO2加氢合成CH3OH的反应体系,下列说法
a.增大初始投料比
 ,有利于提高CO2的转化率
,有利于提高CO2的转化率b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.体系达平衡后,若压缩容器体积,则反应1平衡不移动,反应3平衡正向移动
d.选用合适的催化剂可以提高反应3中CO2的平衡转化率
(2)电化学原理将CO2转化为甲醇。
在光电催化条件下可以高效地将CO2和H2O转化为甲醇,从电极反应的角度分析:
①甲醇在
②氧化反应为
Ⅱ.甲醇是重要的化工原料,也可用作甲醇燃料电池。以稀硫酸为电解质溶液,甲醇燃料电池的工作原理如图所示。
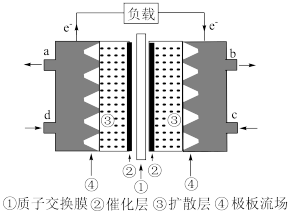
(4)该电池负极的电极反应式是
您最近一年使用:0次



