1 . 氨是一种重要的化工原料,迄今为止,人类仍然在追求低成本、高产率的合成氨技术。
Ⅰ. 直接合成氨。
直接合成氨。
(1)根据图1所示的能量转换关系, 合成
合成 的热化学方程式为
的热化学方程式为_______ 。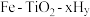 双催化剂,通过光辐射产生温差。使
双催化剂,通过光辐射产生温差。使 在
在_______ (填“热 ”或“冷
”或“冷 ”,下同)表面断裂,氨气在
”,下同)表面断裂,氨气在_______ 表面生成,有利于提高合成氨的反应速率和平衡产率。
Ⅱ.电化学法合成氨。
应用电化学原理,硝酸盐 亚硝酸盐
亚硝酸盐 氨,实现了高效合成氨,装置如图2。
氨,实现了高效合成氨,装置如图2。 的电极反应式是
的电极反应式是_______ 。
(4)当电路中有 电子通过时,一定量的
电子通过时,一定量的 被还原生成
被还原生成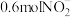 和
和_______ 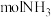 。
。
Ⅲ.氯化镁循环法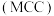 合成氨。
合成氨。 完成转化。
完成转化。
①选用 进行转化,将
进行转化,将 置于
置于 中能释放出
中能释放出 ,反应的方程式是
,反应的方程式是_______ 。
②选用 固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:
固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:_______ 。 ,用
,用 固体转化
固体转化 的优点有
的优点有_______ (写出一条即可)。
Ⅰ.
 直接合成氨。
直接合成氨。(1)根据图1所示的能量转换关系,
 合成
合成 的热化学方程式为
的热化学方程式为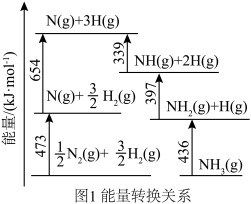
 双催化剂,通过光辐射产生温差。使
双催化剂,通过光辐射产生温差。使 在
在 ”或“冷
”或“冷 ”,下同)表面断裂,氨气在
”,下同)表面断裂,氨气在Ⅱ.电化学法合成氨。
应用电化学原理,硝酸盐
 亚硝酸盐
亚硝酸盐 氨,实现了高效合成氨,装置如图2。
氨,实现了高效合成氨,装置如图2。
 的电极反应式是
的电极反应式是(4)当电路中有
 电子通过时,一定量的
电子通过时,一定量的 被还原生成
被还原生成 和
和 。
。Ⅲ.氯化镁循环法
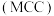 合成氨。
合成氨。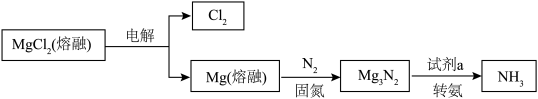
 完成转化。
完成转化。①选用
 进行转化,将
进行转化,将 置于
置于 中能释放出
中能释放出 ,反应的方程式是
,反应的方程式是②选用
 固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:
固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:
 ,用
,用 固体转化
固体转化 的优点有
的优点有
您最近半年使用:0次
2 . CO2的资源化可以推动经济高质量发展和生态环境质量的持续改善。由CO2合成甲醇是CO2资源化利用的重要方法。
Ⅰ.合成甲醇
(1)由CO2催化加氢合成甲醇醇。
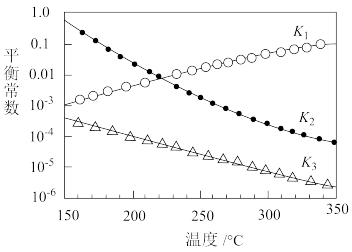
①一定条件下,由CO2和H2制备甲醇的过程中有下列反应:
反应1:CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
反应3:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。____ △H3(填“>”“<”或“=”)。
②对于上述CO2加氢合成CH3OH的反应体系,下列说法不正确 的是____ (填字母)。
a.增大初始投料比 ,有利于提高CO2的转化率
,有利于提高CO2的转化率
b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.体系达平衡后,若压缩容器体积,则反应1平衡不移动,反应3平衡正向移动
d.选用合适的催化剂可以提高反应3中CO2的平衡转化率
(2)电化学原理将CO2转化为甲醇。
在光电催化条件下可以高效地将CO2和H2O转化为甲醇,从电极反应的角度分析:
①甲醇在____ (填“阴”或“阳”)极生成;
②氧化反应为____ 。
Ⅱ.甲醇是重要的化工原料,也可用作甲醇燃料电池。以稀硫酸为电解质溶液,甲醇燃料电池的工作原理如图所示。_____ 。
(4)该电池负极的电极反应式是_____ 。
Ⅰ.合成甲醇
(1)由CO2催化加氢合成甲醇醇。
①一定条件下,由CO2和H2制备甲醇的过程中有下列反应:
反应1:CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1反应2:CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2反应3:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。
②对于上述CO2加氢合成CH3OH的反应体系,下列说法
a.增大初始投料比
 ,有利于提高CO2的转化率
,有利于提高CO2的转化率b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.体系达平衡后,若压缩容器体积,则反应1平衡不移动,反应3平衡正向移动
d.选用合适的催化剂可以提高反应3中CO2的平衡转化率
(2)电化学原理将CO2转化为甲醇。
在光电催化条件下可以高效地将CO2和H2O转化为甲醇,从电极反应的角度分析:
①甲醇在
②氧化反应为
Ⅱ.甲醇是重要的化工原料,也可用作甲醇燃料电池。以稀硫酸为电解质溶液,甲醇燃料电池的工作原理如图所示。
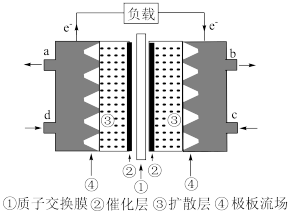
(4)该电池负极的电极反应式是
您最近半年使用:0次
3 . 全球大气 浓度升高对人类生活产生了影响,
浓度升高对人类生活产生了影响, 的捕集和资源化利用成为研究热点。
的捕集和资源化利用成为研究热点。
(1) 能引起海水酸化,原理为
能引起海水酸化,原理为___________ ,因此 过量排放对海洋生态系统会造成严重影响。
过量排放对海洋生态系统会造成严重影响。
(2)捕碳技术(主要指捕获 )在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是
)在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是___________ 。
A. B.CaO C.
B.CaO C. D.
D.
(3) 甲烷化是实现其资源化利用的有效方式之一、
甲烷化是实现其资源化利用的有效方式之一、
Ⅰ.热化学转化法:工业上常用 催化加氢合成
催化加氢合成 。
。
已知:①
②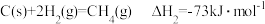
③
反应 的
的
___________ kJ/mol。
在该工业生产中,选用了高活性的Ni基催化剂,并且在低温下进行,其目的是:___________ 。
Ⅱ.电化学转化法:多晶Cu可高效催化 甲烷化,电解
甲烷化,电解 制备
制备 的原理示意图如下。
的原理示意图如下。
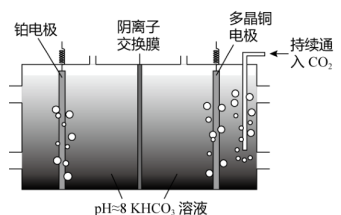
①多晶铜连接电源的___________ 极。(填“正”或“负”)
②阳极氧化产物只有 ,电解时实际生成
,电解时实际生成 的总量小于由
的总量小于由 理论计算所得
理论计算所得 的量,结合电极反应式解释原因:
的量,结合电极反应式解释原因:___________ 。
 浓度升高对人类生活产生了影响,
浓度升高对人类生活产生了影响, 的捕集和资源化利用成为研究热点。
的捕集和资源化利用成为研究热点。(1)
 能引起海水酸化,原理为
能引起海水酸化,原理为 过量排放对海洋生态系统会造成严重影响。
过量排放对海洋生态系统会造成严重影响。(2)捕碳技术(主要指捕获
 )在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是
)在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是A.
 B.CaO C.
B.CaO C. D.
D.
(3)
 甲烷化是实现其资源化利用的有效方式之一、
甲烷化是实现其资源化利用的有效方式之一、Ⅰ.热化学转化法:工业上常用
 催化加氢合成
催化加氢合成 。
。已知:①

②
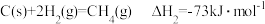
③

反应
 的
的
在该工业生产中,选用了高活性的Ni基催化剂,并且在低温下进行,其目的是:
Ⅱ.电化学转化法:多晶Cu可高效催化
 甲烷化,电解
甲烷化,电解 制备
制备 的原理示意图如下。
的原理示意图如下。
①多晶铜连接电源的
②阳极氧化产物只有
 ,电解时实际生成
,电解时实际生成 的总量小于由
的总量小于由 理论计算所得
理论计算所得 的量,结合电极反应式解释原因:
的量,结合电极反应式解释原因:
您最近半年使用:0次
解题方法
4 . 工业排放物可能对环境和人体健康产生危害,必须经过处理才可排放。根据题意回答下列问题。
Ⅰ.处理含SO2、NO的烟气
在323 K温度下,向盛有NaClO2溶液的鼓泡反应器中通入含有SO2和NO的烟气。
(1)写出NaClO2溶液脱硝过程中反应的离子方程式___________________ 。
(2)由实验测得,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________ 。
(3)采用NaClO、Ca(ClO) 2替代NaClO2,也能较好的除去SO2。从化学平衡原理分析,Ca(ClO) 2相比NaClO具有的优点是___________________ 。
Ⅱ.处理含H2S的烟气
生物脱H2S原理为:
H2S(g) + Fe2(SO4)3(aq) = S(s) + 2FeSO4(aq) + H2SO4(aq) ΔH1
4FeSO4(aq) + O2(g) + 2H2SO4(aq)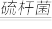 2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
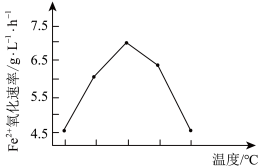
(1)反应2H2S(g) + O2 (g) = 2S(s) + 2H2O(l) 的ΔH3=___________________ 。
(2)若反应温度过高,反应速率下降(如图),其原因是______________ 。
Ⅲ.处理污水的化学方法有许多,混凝法、氧化还原法、中和法、电解法等。处理含Na2SO4的废水常用三室式电渗析法,原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

(1)负极反应式为___________________ 。
(2)当电路中通过1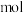 电子的电量时,会有
电子的电量时,会有_________ 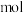 的O2生成。
的O2生成。
Ⅰ.处理含SO2、NO的烟气
在323 K温度下,向盛有NaClO2溶液的鼓泡反应器中通入含有SO2和NO的烟气。
(1)写出NaClO2溶液脱硝过程中反应的离子方程式
(2)由实验测得,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是
(3)采用NaClO、Ca(ClO) 2替代NaClO2,也能较好的除去SO2。从化学平衡原理分析,Ca(ClO) 2相比NaClO具有的优点是
Ⅱ.处理含H2S的烟气
生物脱H2S原理为:
H2S(g) + Fe2(SO4)3(aq) = S(s) + 2FeSO4(aq) + H2SO4(aq) ΔH1
4FeSO4(aq) + O2(g) + 2H2SO4(aq)
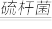 2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
2Fe2(SO4)3(aq) + 2H2O(l) ΔH2(1)反应2H2S(g) + O2 (g) = 2S(s) + 2H2O(l) 的ΔH3=
(2)若反应温度过高,反应速率下降(如图),其原因是

Ⅲ.处理污水的化学方法有许多,混凝法、氧化还原法、中和法、电解法等。处理含Na2SO4的废水常用三室式电渗析法,原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

(1)负极反应式为
(2)当电路中通过1
 电子的电量时,会有
电子的电量时,会有 的O2生成。
的O2生成。
您最近半年使用:0次
5 . CO2的排放会带来全球“温室”效应,因此,引起国际关注和研究,渴望21世纪 CO2将作为新碳源被广泛使用。
(1)以 CO2和 H2为原料可得到 CH4 燃料。
已知:① CH4 (g) + CO2(g) = 2CO(g) + 2H2(g) △ H1= + 247kJ·mol-1
② CH4 (g) + H2O(g) = CO(g) + 3H2(g) △ H2= + 205kJ·mol-1
写出由 CO2获得CH4的热化学方程式:_____ 。
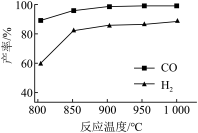
(2)CO2与CH4经催化重整可制得合成气:CH4(g)+CO2(g) = CO(g)+2H2(g) 按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率影响如图所示。此反应优选温度为900℃的原因是______________________ 。

(3)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
① 催化剂的催化效率与乙酸的生成速率随温度的变化关系如上图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是__________________ 。
② 为了提高该反应中CH4的转化率,可以采取的措施是________ (写出两种) 。
③ 将Cu2Al2O4溶解在稀硝酸中离子方程式是________________________ 。
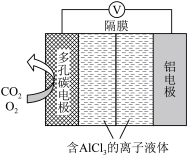
(4)O2辅助的Al—CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:_______________________ 。电池的正极反应式:2CO2+2e−= C2O42−该过程中,O2起催化作用,催化过程可表示为:i: 6 O2 + 6e− = 6 O2− ii: ……写出ii的离子方程式:______________________ 。
(1)以 CO2和 H2为原料可得到 CH4 燃料。
已知:① CH4 (g) + CO2(g) = 2CO(g) + 2H2(g) △ H1= + 247kJ·mol-1
② CH4 (g) + H2O(g) = CO(g) + 3H2(g) △ H2= + 205kJ·mol-1
写出由 CO2获得CH4的热化学方程式:
(2)CO2与CH4经催化重整可制得合成气:CH4(g)+CO2(g) = CO(g)+2H2(g) 按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率影响如图所示。此反应优选温度为900℃的原因是


(3)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
① 催化剂的催化效率与乙酸的生成速率随温度的变化关系如上图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是
② 为了提高该反应中CH4的转化率,可以采取的措施是
③ 将Cu2Al2O4溶解在稀硝酸中离子方程式是

(4)O2辅助的Al—CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:
您最近半年使用:0次
2019-04-08更新
|
405次组卷
|
2卷引用:【区级联考】北京市门头沟区2019届高三下学期3月综合练习(一模)化学试题
2009·天津·高考真题
真题
名校
6 . 已知:2CO(g)+O2(g)=2CO2(g) ΔH=" --" 566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g)ΔH=" --226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )

Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g)ΔH=" --226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )

| A.CO的燃烧热为283 kJ |
| B.上图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH< --452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
您最近半年使用:0次
2019-01-30更新
|
1524次组卷
|
18卷引用:北京市门头沟区2010年高三一模(理科综合)化学部分
(已下线)北京市门头沟区2010年高三一模(理科综合)化学部分2009年普通高等学校招生统一考试理综试题化学部分(天津卷)2009高考真题汇编-化学计算(已下线)2010年安徽师大附中高二第二学期期中考查(已下线)2010年天津市天津一中高三第五次月考(理综)化学部分(已下线)09~10学年浙江舟山七校高二下学期期末考试化学试题(已下线)2010年黑龙江牡丹江一中高二上学期期中考试化学试卷(已下线)2010~2011学年辽宁省瓦房店市高级中学高一下学期期末考试(已下线)2011-2012学年江西省上饶县中学高二第一次月考化学试卷(已下线)2010-2011学年北京市密云二中高二下期3月份月考化学试卷(已下线)2012届浙江省东阳中学高三下学期阶段检测化学试卷(已下线)2011-2012学年安徽省安工大附中、红星中学高二3月联考化学试卷(已下线)2013届吉林省长春外国语学校高三第一次月考化学试卷(已下线)2012-2013学年黑龙江省鹤岗一中高一下学期期中考试化学试卷2015-2016学年江苏省启东中学高二上期中选修化学试卷2016届河南省顶级名校高三上学期期中测试化学试卷【全国百强校】辽宁省鞍山市第一中学2017-2018学年高一下学期期中考试化学试题湖南师大附属颐华学校2022-2023学年高二上学期入学考试化学试题
解题方法
7 . “一带一路”将为中国化工企业开辟新的国际市场,其中,能源、资源整合和环境治理是保驾护航的基础。
(1)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________ 。
已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式:___________________ 。
(3)大气污染气的主要成分是SO2和NO2。利用下图所示装置(电极均为惰性电极)可以吸收SO2,还可以用阴极排出的溶液吸收NO2。
a极为_________ (填“阴”“阳”) b极的电极反应式为__________________ 。简述该装置能吸收SO2的原理:_____________________ 。
(1)下面是不同过程的热化学方程式,请写出FeO(s)被CO还原成Fe和CO2的热化学方程式
已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
(2)贵金属的冶炼中往往会产生有毒气体,先进技术使用NaBH4为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式:
②在纳米钴的催化作用下,肼可以发生分解反应3N2H4 (g) N2(g)+4NH3(g)
N2(g)+4NH3(g)
保持温度不变,向容积固定的容器中充入一定量的肼,下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.单位时间内生成amol N2的同时,生成4molNH3
c. N2H4 和NH3的物质的量之比保持不变的状态
d.混合气体的平均摩尔质量保持不变的状态
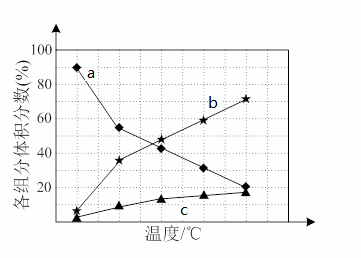
若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图所示,其中曲线b表示的是
(3)大气污染气的主要成分是SO2和NO2。利用下图所示装置(电极均为惰性电极)可以吸收SO2,还可以用阴极排出的溶液吸收NO2。
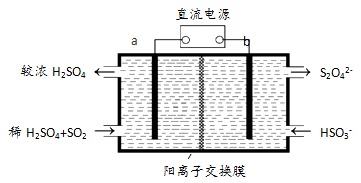
a极为
您最近半年使用:0次
8 . 为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:________________________ 。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=___________ kJ∙mol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=_______ 。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_____________________ 。
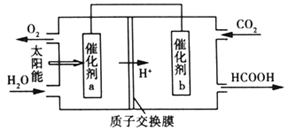
(5)氮氧化物进入水体可转化为 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
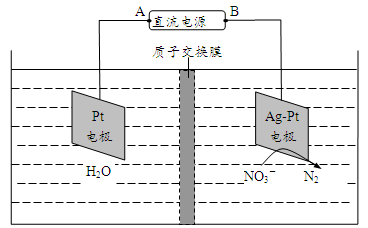
电源正极为_______ (填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的 为
为_________ g。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为

(5)氮氧化物进入水体可转化为
 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
电源正极为
 为
为
您最近半年使用:0次
2016-12-09更新
|
576次组卷
|
2卷引用:2015届北京市门头沟区高三3月综合练习理综化学试卷



