名校
解题方法
1 . 过渡金属氧化物离子(以MO+表示)在烃类的选择性氧化等方面应用广泛。MO+与CH4反应的过程如下图所示。不正确 的是
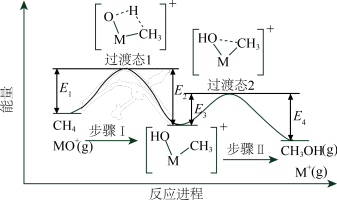
| A.反应速率:步骤I<步骤II |
| B.CH3OH分子中,键角:H—C—H>H—O—C |
| C.若MO+与CH3D反应,生成的氘代甲醇有2种 |
D.CH4(g) + MO+(g)=CH3OH(g) + M+(g)  = E2+E4-E1-E3 = E2+E4-E1-E3 |
您最近半年使用:0次
7日内更新
|
315次组卷
|
3卷引用:北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题
北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(已下线)通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)江苏省常州市第一中学2023-2024学年高二下学期4月期中考试化学试题
2 . 氨是一种重要的化工原料,迄今为止,人类仍然在追求低成本、高产率的合成氨技术。
Ⅰ. 直接合成氨。
直接合成氨。
(1)根据图1所示的能量转换关系, 合成
合成 的热化学方程式为
的热化学方程式为_______ 。 双催化剂,通过光辐射产生温差。使
双催化剂,通过光辐射产生温差。使 在
在_______ (填“热 ”或“冷
”或“冷 ”,下同)表面断裂,氨气在
”,下同)表面断裂,氨气在_______ 表面生成,有利于提高合成氨的反应速率和平衡产率。
Ⅱ.电化学法合成氨。
应用电化学原理,硝酸盐 亚硝酸盐
亚硝酸盐 氨,实现了高效合成氨,装置如图2。
氨,实现了高效合成氨,装置如图2。 的电极反应式是
的电极反应式是_______ 。
(4)当电路中有 电子通过时,一定量的
电子通过时,一定量的 被还原生成
被还原生成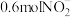 和
和_______ 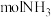 。
。
Ⅲ.氯化镁循环法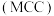 合成氨。
合成氨。 完成转化。
完成转化。
①选用 进行转化,将
进行转化,将 置于
置于 中能释放出
中能释放出 ,反应的方程式是
,反应的方程式是_______ 。
②选用 固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:
固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:_______ 。 ,用
,用 固体转化
固体转化 的优点有
的优点有_______ (写出一条即可)。
Ⅰ.
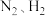 直接合成氨。
直接合成氨。(1)根据图1所示的能量转换关系,
 合成
合成 的热化学方程式为
的热化学方程式为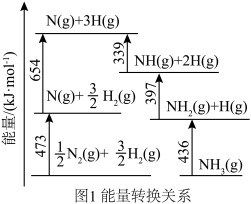
 双催化剂,通过光辐射产生温差。使
双催化剂,通过光辐射产生温差。使 在
在 ”或“冷
”或“冷 ”,下同)表面断裂,氨气在
”,下同)表面断裂,氨气在Ⅱ.电化学法合成氨。
应用电化学原理,硝酸盐
 亚硝酸盐
亚硝酸盐 氨,实现了高效合成氨,装置如图2。
氨,实现了高效合成氨,装置如图2。
 的电极反应式是
的电极反应式是(4)当电路中有
 电子通过时,一定量的
电子通过时,一定量的 被还原生成
被还原生成 和
和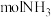 。
。Ⅲ.氯化镁循环法
 合成氨。
合成氨。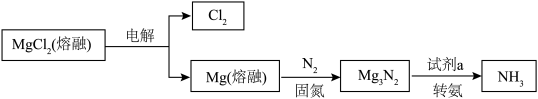
 完成转化。
完成转化。①选用
 进行转化,将
进行转化,将 置于
置于 中能释放出
中能释放出 ,反应的方程式是
,反应的方程式是②选用
 固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式:
固体进行转化,依据合成氨的过程(如图3),写出合成氨的总反应方程式: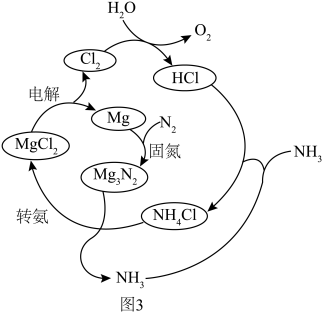
 ,用
,用 固体转化
固体转化 的优点有
的优点有
您最近半年使用:0次
名校
3 . 肼( )有较强的还原性,与
)有较强的还原性,与 等可组成火箭推进剂。
等可组成火箭推进剂。
(1)已知:Ⅰ.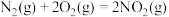

Ⅱ.
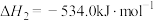
Ⅲ.

火箭发射时 与
与 反应生成
反应生成 和
和 。该反应的热化学方程式是
。该反应的热化学方程式是___________ 。
(2)肼的传统生产工艺为Raschig法,两步反应分别在不同容器的水溶液环境中进行:
i.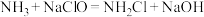 (快)
(快)
ii.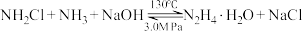 (慢)
(慢)
已知电负性N>Cl。下列说法正确的是___________ (填序号)。
a.反应i中NaClO做氧化剂
b.适当提高反应i温度,可显著提高相同时间内 的产量
的产量
c.采用3.0MPa压强可以增大 的溶解度,提高反应ii中
的溶解度,提高反应ii中 的利用率
的利用率
(3)采用Raschig法制得肼后,可采用分步蒸馏的方法将其从反应混合液中分离出来。
①水合肼( ,常温为液态)中
,常温为液态)中 与
与 间存在氢键,用“X-H…Y”表示
间存在氢键,用“X-H…Y”表示 与
与 间存在的氢键:
间存在的氢键:___________ 。
②蒸馏过程中首先馏出的物质是___________ (填序号)。
a. b.
b. c.NaCl
c.NaCl
(4)产品中肼含量的测定方法如下。
取0.50g产品加20mL水稀释,滴入2滴淀粉溶液,用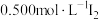 溶液滴定3次,平均每次消耗
溶液滴定3次,平均每次消耗 溶液20.00mL。已知:
溶液20.00mL。已知: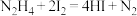
①样品中肼(以 计)的质量分数为
计)的质量分数为___________ 。
②若滴定过程中操作过于缓慢,则测定结果___________ (填“偏大”“偏小”或“不受影响”)。
(5)肼除做火箭推进剂外还可用于燃料电池中。某种碱性肼-空气燃料电池(电解质为KOH溶液)具有高效、无污染的特点,装置如右图所示。___________ 。
②电池工作一段时间后正极区KOH溶液pH基本保持不变,结合电极反应式解释原因___________ 。
 )有较强的还原性,与
)有较强的还原性,与 等可组成火箭推进剂。
等可组成火箭推进剂。(1)已知:Ⅰ.
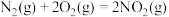

Ⅱ.

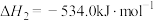
Ⅲ.


火箭发射时
 与
与 反应生成
反应生成 和
和 。该反应的热化学方程式是
。该反应的热化学方程式是(2)肼的传统生产工艺为Raschig法,两步反应分别在不同容器的水溶液环境中进行:
i.
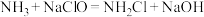 (快)
(快)ii.
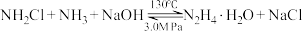 (慢)
(慢)已知电负性N>Cl。下列说法正确的是
a.反应i中NaClO做氧化剂
b.适当提高反应i温度,可显著提高相同时间内
 的产量
的产量c.采用3.0MPa压强可以增大
 的溶解度,提高反应ii中
的溶解度,提高反应ii中 的利用率
的利用率(3)采用Raschig法制得肼后,可采用分步蒸馏的方法将其从反应混合液中分离出来。
①水合肼(
 ,常温为液态)中
,常温为液态)中 与
与 间存在氢键,用“X-H…Y”表示
间存在氢键,用“X-H…Y”表示 与
与 间存在的氢键:
间存在的氢键:②蒸馏过程中首先馏出的物质是
a.
 b.
b. c.NaCl
c.NaCl(4)产品中肼含量的测定方法如下。
取0.50g产品加20mL水稀释,滴入2滴淀粉溶液,用
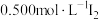 溶液滴定3次,平均每次消耗
溶液滴定3次,平均每次消耗 溶液20.00mL。已知:
溶液20.00mL。已知: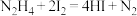
①样品中肼(以
 计)的质量分数为
计)的质量分数为②若滴定过程中操作过于缓慢,则测定结果
(5)肼除做火箭推进剂外还可用于燃料电池中。某种碱性肼-空气燃料电池(电解质为KOH溶液)具有高效、无污染的特点,装置如右图所示。
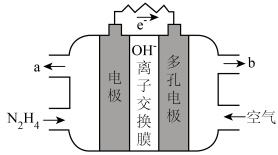
②电池工作一段时间后正极区KOH溶液pH基本保持不变,结合电极反应式解释原因
您最近半年使用:0次
4 . 烟气脱硝技术是环境科学研究的热点。实验室模拟 将烟气中的
将烟气中的 深度氧化为
深度氧化为 ,并进一步将
,并进一步将 转化获得含氮产品,流程示意图如下。
转化获得含氮产品,流程示意图如下。
i.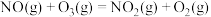
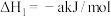
ii.

iii.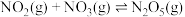

(1) 被
被 深度氧化,补全热化学方程式:
深度氧化,补全热化学方程式:


___________ 
(2)一定条件下,不同温度时, 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。
___________  (填“>”或“<”)。
(填“>”或“<”)。
②8s时, 的浓度不同的原因是
的浓度不同的原因是___________ 。
(3)一定条件下,NO的初始浓度为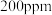 时,不同反应时间,深度氧化器中
时,不同反应时间,深度氧化器中 的浓度随
的浓度随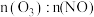 的变化如图所示。反应过程中
的变化如图所示。反应过程中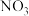 的浓度极低。
的浓度极低。 时,深度氧化器中发生的反应主要是
时,深度氧化器中发生的反应主要是___________ (填“i”“ii”或“iii”)。
② 时,
时, 的浓度随
的浓度随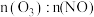 变化的原因是
变化的原因是___________ 。
(4) 且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是
且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是___________ 。
(5)深度氧化后的烟气通过吸收器完全转化为硝酸盐产品,产品浓度的测定方法如下。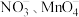 的还原产物分别是
的还原产物分别是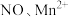 。产品中
。产品中 的物质的量浓度为
的物质的量浓度为___________  。
。
 将烟气中的
将烟气中的 深度氧化为
深度氧化为 ,并进一步将
,并进一步将 转化获得含氮产品,流程示意图如下。
转化获得含氮产品,流程示意图如下。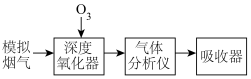
i.
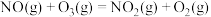
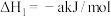
ii.


iii.
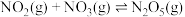

(1)
 被
被 深度氧化,补全热化学方程式:
深度氧化,补全热化学方程式:


(2)一定条件下,不同温度时,
 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。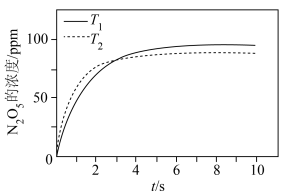

 (填“>”或“<”)。
(填“>”或“<”)。②8s时,
 的浓度不同的原因是
的浓度不同的原因是(3)一定条件下,NO的初始浓度为
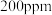 时,不同反应时间,深度氧化器中
时,不同反应时间,深度氧化器中 的浓度随
的浓度随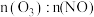 的变化如图所示。反应过程中
的变化如图所示。反应过程中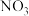 的浓度极低。
的浓度极低。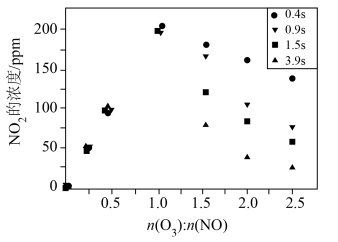
 时,深度氧化器中发生的反应主要是
时,深度氧化器中发生的反应主要是②
 时,
时, 的浓度随
的浓度随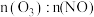 变化的原因是
变化的原因是(4)
 且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是
且恒压的条件下进行烟气处理,烟气达到排放标准所需深度氧化的时间仍较长。结合(3),保持上述条件不变,解决这一问题可采取的措施及目的分别是(5)深度氧化后的烟气通过吸收器完全转化为硝酸盐产品,产品浓度的测定方法如下。
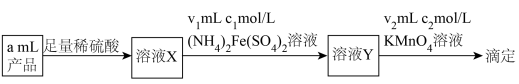
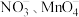 的还原产物分别是
的还原产物分别是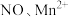 。产品中
。产品中 的物质的量浓度为
的物质的量浓度为 。
。
您最近半年使用:0次
解题方法
5 . CO2再生为“零碳甲醇”是实现碳中和的一种方式。
(1)CO2催化加氢可生成甲醇。
已知:i.2H2(g)+O2(g)=2H2O(g)ΔH=akJ·mol-1
ii.2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g)ΔH=bkJ·mol-1
2CO2(g)+4H2O(g)ΔH=bkJ·mol-1
①CO2和H2生成CH3OH和H2O的热化学方程式是___________ 。
②合成过程中选择高压条件的原因:___________ 。
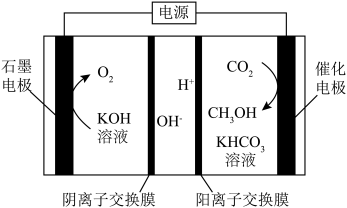
(2)电解还原法将CO2转化为甲醇的装置如图。 和选择性S的定义:
和选择性S的定义:
 (B)=
(B)= 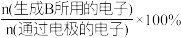
S(B)=
①电解过程中生成CH3OH的电极反应式:___________ 。
②当CO2完全消耗时,测得η(CH3OH)=33.3%,S(CH3OH)=25%。推测η(CH3OH)=33.3%的原因:
i.阴极有H2O放电。
ii.阴极有CO生成。
iii.……
a.通过检验电解产物判断推测i是否成立,需要检验的物质是___________ 。
b.假设放电的CO2一部分生成CH3OH,其余的CO2全部在阴极放电生成CO,则η(CO)=___________ 。
③研究CH3OH中的C来自于CO2还是KHCO3,方法如下:
方法I.其他条件不变,用N2代替CO2电解,无CH3OH产生。
方法II.其他条件不变,用14CO2代替CO2电解,有___________ 产生。
综上,证实CH3OH中的C来自于CO2
(1)CO2催化加氢可生成甲醇。
已知:i.2H2(g)+O2(g)=2H2O(g)ΔH=akJ·mol-1
ii.2CH3OH(g)+3O2(g)
 2CO2(g)+4H2O(g)ΔH=bkJ·mol-1
2CO2(g)+4H2O(g)ΔH=bkJ·mol-1①CO2和H2生成CH3OH和H2O的热化学方程式是
②合成过程中选择高压条件的原因:
(2)电解还原法将CO2转化为甲醇的装置如图。
 和选择性S的定义:
和选择性S的定义: (B)=
(B)= 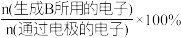
S(B)=

①电解过程中生成CH3OH的电极反应式:
②当CO2完全消耗时,测得η(CH3OH)=33.3%,S(CH3OH)=25%。推测η(CH3OH)=33.3%的原因:
i.阴极有H2O放电。
ii.阴极有CO生成。
iii.……
a.通过检验电解产物判断推测i是否成立,需要检验的物质是
b.假设放电的CO2一部分生成CH3OH,其余的CO2全部在阴极放电生成CO,则η(CO)=
③研究CH3OH中的C来自于CO2还是KHCO3,方法如下:
方法I.其他条件不变,用N2代替CO2电解,无CH3OH产生。
方法II.其他条件不变,用14CO2代替CO2电解,有
综上,证实CH3OH中的C来自于CO2
您最近半年使用:0次
解题方法
6 . 研究人员提出利用热化学硫碘循环实现硫化氢分解联产氢气和硫黄,转化过程如下,其中Y、Z代表I2或HI中的一种。下列说法不正确 的是
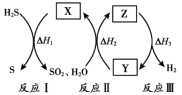
| A.Y在Z溶液中比在H2SO4溶液中易溶 |
| B.反应I中X的浓度与硫黄的产率无关 |
| C.反应Ⅱ的化学方程式为SO2+2H2O+I2=H2SO4+2HI |
| D.等压条件下,反应Ⅰ、Ⅱ、Ⅲ的反应热之和等于硫化氢直接分解的反应热 |
您最近半年使用:0次
名校
7 . 金属矿物常以硫化物形式存在,如 等。
等。
Ⅰ.掺烧 和
和 ,用于制铁精粉和硫酸
,用于制铁精粉和硫酸
(1)已知: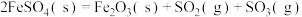 为吸热反应。
为吸热反应。 时,
时, 固体在
固体在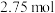 氧气中完全燃烧生成气态
氧气中完全燃烧生成气态 和
和 固体,放出
固体,放出 热量。
热量。
① 与
与 反应的热化学方程式为
反应的热化学方程式为_________ 。
②将 与
与 掺烧(混合燃烧),其目的包括
掺烧(混合燃烧),其目的包括_________ (填字母)。
 节约燃料和能量
节约燃料和能量  为制备硫酸提供原料
为制备硫酸提供原料  减少空气污染
减少空气污染
(2) 常带一定量的结晶水。
常带一定量的结晶水。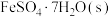 分解脱水反应的能量变化如图所示。
分解脱水反应的能量变化如图所示。
_________  。
。
②为维持炉内温度基本不变, 所带结晶水越多,掺烧比
所带结晶水越多,掺烧比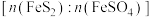 应
应_________ 。(填“增大”“减小”或“不变”)。
Ⅱ.浸出法处理
(3) 难溶于水,处理
难溶于水,处理 常使用酸浸法,两步反应依次为:
常使用酸浸法,两步反应依次为:
ⅰ.
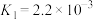
ⅱ.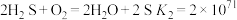
①平衡常数 的表达式为
的表达式为_________ 。
②仅发生反应ⅰ时, 酸浸效果不好,结合平衡常数说明原因:
酸浸效果不好,结合平衡常数说明原因:_________ 。
(4)从平衡移动角度解释通入 在
在 酸浸过程中的作用:
酸浸过程中的作用:_________ 。
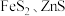 等。
等。Ⅰ.掺烧
 和
和 ,用于制铁精粉和硫酸
,用于制铁精粉和硫酸(1)已知:
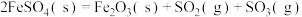 为吸热反应。
为吸热反应。 时,
时, 固体在
固体在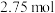 氧气中完全燃烧生成气态
氧气中完全燃烧生成气态 和
和 固体,放出
固体,放出 热量。
热量。①
 与
与 反应的热化学方程式为
反应的热化学方程式为②将
 与
与 掺烧(混合燃烧),其目的包括
掺烧(混合燃烧),其目的包括 节约燃料和能量
节约燃料和能量  为制备硫酸提供原料
为制备硫酸提供原料  减少空气污染
减少空气污染(2)
 常带一定量的结晶水。
常带一定量的结晶水。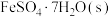 分解脱水反应的能量变化如图所示。
分解脱水反应的能量变化如图所示。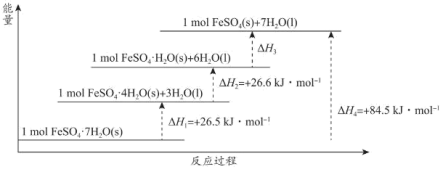

 。
。②为维持炉内温度基本不变,
 所带结晶水越多,掺烧比
所带结晶水越多,掺烧比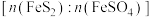 应
应Ⅱ.浸出法处理

(3)
 难溶于水,处理
难溶于水,处理 常使用酸浸法,两步反应依次为:
常使用酸浸法,两步反应依次为:ⅰ.

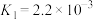
ⅱ.
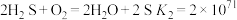
①平衡常数
 的表达式为
的表达式为②仅发生反应ⅰ时,
 酸浸效果不好,结合平衡常数说明原因:
酸浸效果不好,结合平衡常数说明原因:(4)从平衡移动角度解释通入
 在
在 酸浸过程中的作用:
酸浸过程中的作用:
您最近半年使用:0次
8 . 碱金属单质M和 反应的能量变化如下图所示。下列说法正确的是
反应的能量变化如下图所示。下列说法正确的是
 反应的能量变化如下图所示。下列说法正确的是
反应的能量变化如下图所示。下列说法正确的是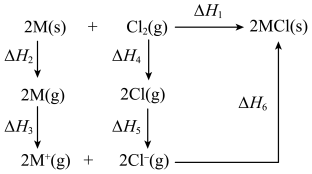
| A.CsCl晶体是共价晶体 |
B. |
C.若M分别为Na和K,则 :Na<K :Na<K |
D.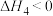 , ,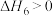 |
您最近半年使用:0次
解题方法
9 . 大气中 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。
(1) 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ: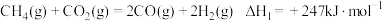
Ⅱ: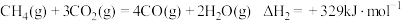
反应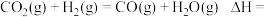
___________
(2)工业上可利用 制备
制备 :
:
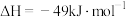
① 时,该反应的平衡常数
时,该反应的平衡常数 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②提高反应速率且增大 的平衡产率,可采取的措施
的平衡产率,可采取的措施___________ 。
A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出
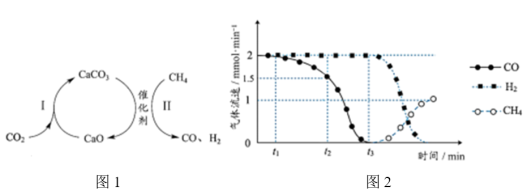
(3)一种捕获 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。___________ 。
② 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因___________ 。
③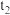 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为___________ 。
(4)在铜基配合物的催化作用下,利用电化学原理可将 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。___________ 。
②当有 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为___________ 。
 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。(1)
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ:
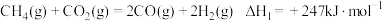
Ⅱ:
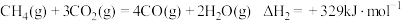
反应
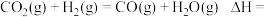
(2)工业上可利用
 制备
制备 :
:
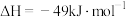
①
 时,该反应的平衡常数
时,该反应的平衡常数 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②提高反应速率且增大
 的平衡产率,可采取的措施
的平衡产率,可采取的措施A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出

(3)一种捕获
 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。
②
 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因③
 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为(4)在铜基配合物的催化作用下,利用电化学原理可将
 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。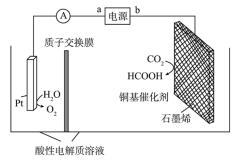
②当有
 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为
您最近半年使用:0次
10 . 我国科学家设计的化学链重整联合CO2捕集制H2系统如下图所示:
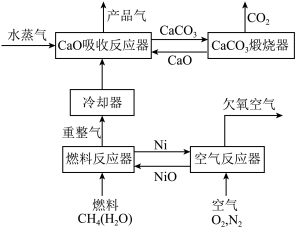
(1)空气反应器中发生___________ 反应(填“吸热”或“放热”)。
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有___________ 。
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =___________ 。
② 反应温度对H2产率(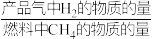 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
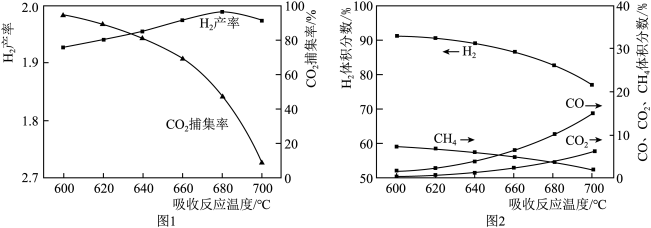
结合化学方程式说明图1中温度升高CO2捕集率降低的原因___________ ;解释图2中温度升高H2体积分数降低的原因___________ 。
(4)燃料反应器和吸收反应器中加入水蒸气的作用___________ 。

(1)空气反应器中发生
(2)重整气中有H2、CO、CO2、CH4和H2O,燃料反应器中CH4和NiO反应的化学方程式有
(3)CaO吸收反应器中还发生蒸汽变换反应(CO与水蒸气或CH4与水蒸气反应)
①1 mol CH4和水蒸气生成CO2和H2吸收热量165 kJ,1 mol CH4和水蒸气生成CO和H2吸收热量206 kJ,CO(g) + H2O (g) =H2(g) + CO2(g) ΔH =
② 反应温度对H2产率(
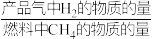 )、CO2捕集率(
)、CO2捕集率( )及产品气组成的影响如下图所示:
)及产品气组成的影响如下图所示:
结合化学方程式说明图1中温度升高CO2捕集率降低的原因
(4)燃料反应器和吸收反应器中加入水蒸气的作用
您最近半年使用:0次



