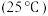名校
1 . 氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产生活中有着重要作用。
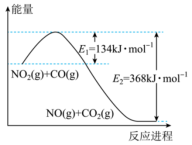
(1)根据能量变化示意图,写出NO2和CO反应的热化学方程式___________ 。
(2)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g) + 3O2 (g) = 2N2 (g)+ 6H2O(g) ΔH1= -akJ/mol ①
N2(g) + O2(g) = 2NO(g) ΔH2= -bkJ/mol ②
若1mol NH3还原NO至N2,则该反应过程中的反应热 ΔH3 =___________ kJ/mol (用含 a、b 的式子表示)。
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g) + 3H2(g) 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,
①该反应的平衡常数表达式:K=___________
②一定温度下,在2L密闭容器中充入1mol N2和3mol H2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的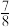 ,则N2的转化率α(N2) =
,则N2的转化率α(N2) =___________ ,以NH3 表示该过程的反应速率v(NH3)= ___________ 。
③下列选项不能证明合成氨反应达到化学平衡状态的是___________ 。
A. N2、H2和NH3的浓度不再变化
B. 单位时间内消耗n mol N2同时消耗3nmol H2
C. 1 mol氮氮三键断裂同时6molN-H键断裂
D. 恒容时容器内总压强不随时间而变化
E. 恒容时混合气体的密度保持不变
F. 混合气体的平均相对分子质量不再改变
(4)对反应N2O4(g) 2NO2(g) ΔH>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
2NO2(g) ΔH>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是___________ 。

a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用降温的方法
(1)根据能量变化示意图,写出NO2和CO反应的热化学方程式

(2)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g) + 3O2 (g) = 2N2 (g)+ 6H2O(g) ΔH1= -akJ/mol ①
N2(g) + O2(g) = 2NO(g) ΔH2= -bkJ/mol ②
若1mol NH3还原NO至N2,则该反应过程中的反应热 ΔH3 =
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g) + 3H2(g)
 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,①该反应的平衡常数表达式:K=
②一定温度下,在2L密闭容器中充入1mol N2和3mol H2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的
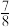 ,则N2的转化率α(N2) =
,则N2的转化率α(N2) =③下列选项不能证明合成氨反应达到化学平衡状态的是
A. N2、H2和NH3的浓度不再变化
B. 单位时间内消耗n mol N2同时消耗3nmol H2
C. 1 mol氮氮三键断裂同时6molN-H键断裂
D. 恒容时容器内总压强不随时间而变化
E. 恒容时混合气体的密度保持不变
F. 混合气体的平均相对分子质量不再改变
(4)对反应N2O4(g)
 2NO2(g) ΔH>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
2NO2(g) ΔH>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用降温的方法
您最近半年使用:0次
名校
解题方法
2 . CO2资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使CO2转化为CH4。反应体系中主要反应的热化学方程式为:
反应Ⅰ:

反应Ⅱ:

(1)将反应后气体通入___________ (填试剂),可证明反应Ⅱ发生。
(2)计算

___________ (用 和
和 表示)。
表示)。
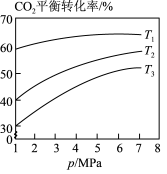
(3)相同投料比时,体系内 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为___________ 。
(4)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:
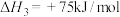
消碳反应:
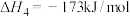
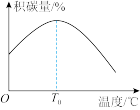
其他条件相同时,催化剂表面积碳量与温度的关系如图所示, ℃之后,温度升高积碳量减小的主要原因是
℃之后,温度升高积碳量减小的主要原因是___________ 。
(5)向 恒容、密闭容器中通入
恒容、密闭容器中通入 和
和 ,测得有关物质的物质的量随温度变化如下图。
,测得有关物质的物质的量随温度变化如下图。
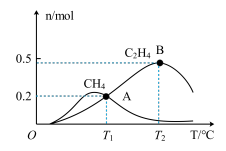
①催化剂在较低温度时主要选择___________ (填“反应Ⅰ”或“反应Ⅱ”)。
② 时
时 的转化率为
的转化率为___________ ,反应Ⅰ的平衡常数
___________ 。
反应Ⅰ:


反应Ⅱ:


(1)将反应后气体通入
(2)计算


 和
和 表示)。
表示)。(3)相同投料比时,体系内
 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
(4)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:

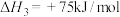
消碳反应:

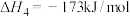
其他条件相同时,催化剂表面积碳量与温度的关系如图所示,
 ℃之后,温度升高积碳量减小的主要原因是
℃之后,温度升高积碳量减小的主要原因是
(5)向
 恒容、密闭容器中通入
恒容、密闭容器中通入 和
和 ,测得有关物质的物质的量随温度变化如下图。
,测得有关物质的物质的量随温度变化如下图。
①催化剂在较低温度时主要选择
②
 时
时 的转化率为
的转化率为
您最近半年使用:0次
名校
解题方法
3 . 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)知25℃和101KPa时,液态甲醇( )的燃烧热
)的燃烧热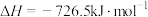 。请写出表示甲醇燃烧热的热化学方程式
。请写出表示甲醇燃烧热的热化学方程式___________ 。
(2) 资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使
资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使 转化为
转化为 。反应体系中主要反应的热化学方程式为:
。反应体系中主要反应的热化学方程式为:
反应Ⅰ: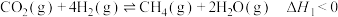
反应Ⅱ: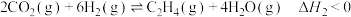
①将反应后气体通入___________ (填试剂名称),可证明反应Ⅱ发生。
②计算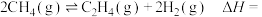
___________ (用 和
和 表示)
表示)
③相同投料比时,体系内 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为___________ 。
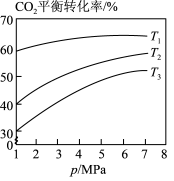
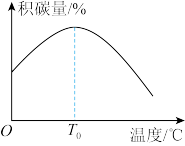
(3)镍氢催化剂活性因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:
消碳反应:
其他条件相同时,催化剂表面积碳量与温度的关系如图所示, ℃之后,温度升高积碳量减小的主要原因
℃之后,温度升高积碳量减小的主要原因___________ 。
(1)知25℃和101KPa时,液态甲醇(
 )的燃烧热
)的燃烧热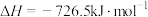 。请写出表示甲醇燃烧热的热化学方程式
。请写出表示甲醇燃烧热的热化学方程式(2)
 资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使
资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使 转化为
转化为 。反应体系中主要反应的热化学方程式为:
。反应体系中主要反应的热化学方程式为:反应Ⅰ:
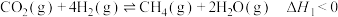
反应Ⅱ:
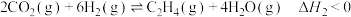
①将反应后气体通入
②计算
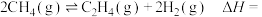
 和
和 表示)
表示)③相同投料比时,体系内
 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
(3)镍氢催化剂活性因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:

积碳反应:

消碳反应:

其他条件相同时,催化剂表面积碳量与温度的关系如图所示,
 ℃之后,温度升高积碳量减小的主要原因
℃之后,温度升高积碳量减小的主要原因
您最近半年使用:0次
4 .  资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使
资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使 转化为
转化为 。反应体系中主要反应的热化学方程式为:
。反应体系中主要反应的热化学方程式为:
反应I:

反应II: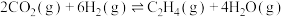

(1)基态镍原子核外电子的轨道表示式为____________
(2)将反应后气体通入______ (填试剂名称),可证明反应II发生。
(3)计算

______ (用 和
和 表示)
表示)
(4)相同投料比时,体系内 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为________ 。
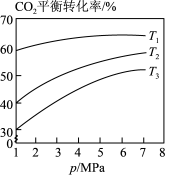
(5)向1 L恒压、密闭容器中通入1 mol 和4 mol
和4 mol  ,测得有关物质的物质的量随温度变化如图。
,测得有关物质的物质的量随温度变化如图。
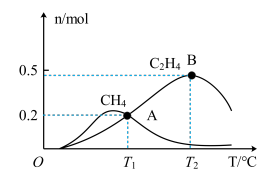
①催化剂在较低温度时主要选择______ (填“反应I”或“反应II”)
② 时
时 的转化率为
的转化率为______ ,反应I的平衡常数
______ 。
(6)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:
 +75 kJ/mol
+75 kJ/mol
消碳反应:
 -173 kJ/mol
-173 kJ/mol
其他条件相同时,催化剂表面积碳量与温度的关系如图所示, ℃之后,温度升高积碳量减小的主要原因是
℃之后,温度升高积碳量减小的主要原因是______ 。

 资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使
资源化利用对缓解碳减排压力具有重要意义,使用镍氢催化剂可使 转化为
转化为 。反应体系中主要反应的热化学方程式为:
。反应体系中主要反应的热化学方程式为:反应I:


反应II:

(1)基态镍原子核外电子的轨道表示式为
(2)将反应后气体通入
(3)计算


 和
和 表示)
表示)(4)相同投料比时,体系内
 的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
的平衡转化率与温度T和压强p的关系如图,温度从高到低的顺序为
(5)向1 L恒压、密闭容器中通入1 mol
 和4 mol
和4 mol  ,测得有关物质的物质的量随温度变化如图。
,测得有关物质的物质的量随温度变化如图。
①催化剂在较低温度时主要选择
②
 时
时 的转化率为
的转化率为
(6)镍氢催化剂活性会因为甲烷分解产生积碳而降低,同时二氧化碳可与碳发生消碳反应:
积碳反应:

 +75 kJ/mol
+75 kJ/mol消碳反应:

 -173 kJ/mol
-173 kJ/mol其他条件相同时,催化剂表面积碳量与温度的关系如图所示,
 ℃之后,温度升高积碳量减小的主要原因是
℃之后,温度升高积碳量减小的主要原因是
您最近半年使用:0次
名校
解题方法
5 . 工业上制硫酸的主要反应之一为: ,反应过程中能量的变化如图所示。
,反应过程中能量的变化如图所示。
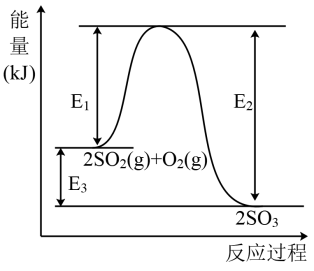
(1)向反应体系中加入催化剂后,图中
_______ (填“增大”、“减小”或“不变”,下同),
_______ 。
(2)已知:

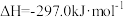
若 与
与 反应产生
反应产生 和
和 ,则反应的热化学方程式为
,则反应的热化学方程式为_______ 。
(3)某温度下,反应的起始浓度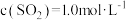 ,
,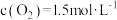 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为_______ 。
(4)在 温度时,该反应的平衡常数
温度时,该反应的平衡常数 ,若在此温度下,向
,若在此温度下,向 的恒容密闭容器中,充入
的恒容密闭容器中,充入 、
、 和
和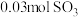 ,则反应开始时正反应速率
,则反应开始时正反应速率_______ (填“>”、“=”或“<”)逆反应速率。
(5)恒温恒容条件下,下列叙述能证明该反应已达化学平衡状态的是_______。(填字母)
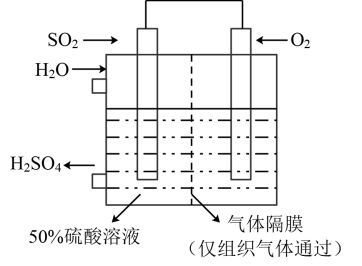
(6)若以如图所示装置生产硫酸,将 、
、 以一定压强喷到活性电极上反应。负极的电极反应式为
以一定压强喷到活性电极上反应。负极的电极反应式为_______ 。
 ,反应过程中能量的变化如图所示。
,反应过程中能量的变化如图所示。
(1)向反应体系中加入催化剂后,图中


(2)已知:

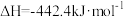

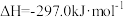
若
 与
与 反应产生
反应产生 和
和 ,则反应的热化学方程式为
,则反应的热化学方程式为(3)某温度下,反应的起始浓度
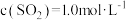 ,
,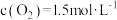 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为(4)在
 温度时,该反应的平衡常数
温度时,该反应的平衡常数 ,若在此温度下,向
,若在此温度下,向 的恒容密闭容器中,充入
的恒容密闭容器中,充入 、
、 和
和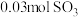 ,则反应开始时正反应速率
,则反应开始时正反应速率(5)恒温恒容条件下,下列叙述能证明该反应已达化学平衡状态的是_______。(填字母)
A. 的体积分数不再发生变化 的体积分数不再发生变化 |
| B.恒容时,容器内压强不再发生变化 |
| C.容器内,气体原子总数不再发生变化 |
D.相同时间内消耗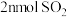 的同时生成 的同时生成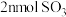 |
 、
、 以一定压强喷到活性电极上反应。负极的电极反应式为
以一定压强喷到活性电极上反应。负极的电极反应式为
您最近半年使用:0次
2022-01-21更新
|
283次组卷
|
2卷引用:北京市丰台区2021~2022学年高二上学期期末考试化学试题
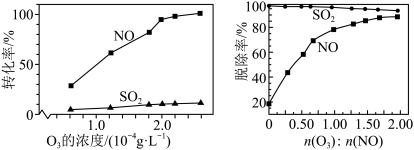
6 . 烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟O3氧化结合(NH4)2SO3溶液吸收法同时脱除SO2和NO。气体反应器中的主要反应原理及相关数据如下表。
不正确 的是
反应 | 平衡常数 | 活化能/ |
 |  | 24.6 |
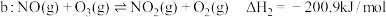 | 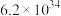 | 3.17 |
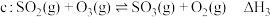 | 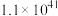 | 58.17 |
A.已知: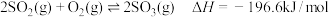 则 则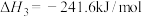 |
| B.其他条件不变,在相同时间内,SO2和NO的转化率均随温度升高而降低 |
| C.其他条件不变,在相同时间内,随O3浓度的升高,NO的转化率远远高于SO2的转化率 |
| D.其他条件不变,在相同时间内,O3的浓度很低时,SO2的脱除率远高于NO的脱除率,因为反应c速率大于反应b |
您最近半年使用:0次
7 . 二氧化碳与氢气催化合成乙烯具有重要的意义。将 和
和 按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。
按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。
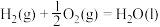
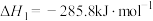
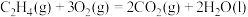
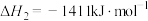

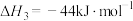
下列说法不正确 的是
 和
和 按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。
按物质的量之比1:3加入VL的密闭容器中,压强为0.1MPa,反应达到平衡状态时,各组分的物质的量分数x随温度T的变化如下图所示。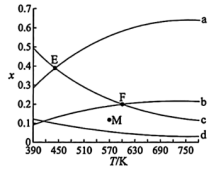
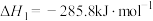
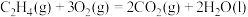
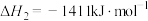

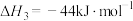
下列说法
A. 与 与 合成 合成 反应的热化学方程式: 反应的热化学方程式: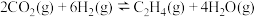 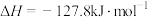 |
B.图中b、d分别表示 、 、 的变化曲线 的变化曲线 |
C.570K、0.2MPa反应达到平衡状态时,M点显示的可能是 的物质的量分数 的物质的量分数 |
D. 与 与 合成 合成 反应的 反应的 |
您最近半年使用:0次
解题方法
8 . 研究人员提出利用热化学硫碘循环实现硫化氢分解联产氢气和硫黄,转化过程如下,其中Y、Z代表I2或HI中的一种。下列说法不正确 的是
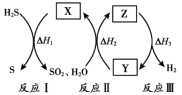
| A.Y在Z溶液中比在H2SO4溶液中易溶 |
| B.反应I中X的浓度与硫黄的产率无关 |
| C.反应Ⅱ的化学方程式为SO2+2H2O+I2=H2SO4+2HI |
| D.等压条件下,反应Ⅰ、Ⅱ、Ⅲ的反应热之和等于硫化氢直接分解的反应热 |
您最近半年使用:0次
9 .  和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
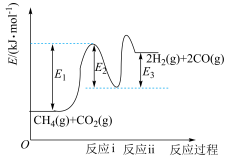
(1)干重整主反应的热化学方程式为_____ (用 、
、 、
、 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定_____ (填“ⅰ”或“ⅱ”)。
(2)反应器中还同时存在副反应: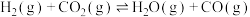
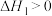
①下图表示投料比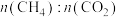 为
为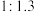 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是_____ 。(填字母)
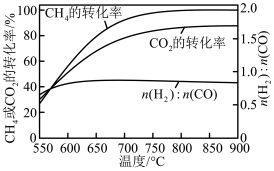
A.加压有利于增大 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率
B.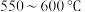 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡
C.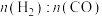 始终低于
始终低于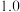 ,与副反应有关
,与副反应有关
②体系中会发生积炭反应
 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应_____ 的 。
。
③添加一定量的载氧剂 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式_____ 。
(3)文献中指出 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由_____ 。
 和
和 是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
是两种造成温室效应的主要气体,高温下可发生干重整反应进行综合利用,反应过程的能量变化如图所示:
(1)干重整主反应的热化学方程式为
 、
、 、
、 表示反应热),反应速率由反应决定
表示反应热),反应速率由反应决定(2)反应器中还同时存在副反应:
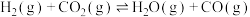
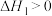
①下图表示投料比
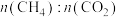 为
为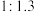 时,不同温度下的反应结果,下列说法中正确的是
时,不同温度下的反应结果,下列说法中正确的是
A.加压有利于增大
 和
和 反应的速率但不利于提高二者的平衡转化率
反应的速率但不利于提高二者的平衡转化率B.
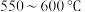 ,升温更有利于主反应,主反应先达到平衡
,升温更有利于主反应,主反应先达到平衡C.
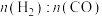 始终低于
始终低于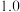 ,与副反应有关
,与副反应有关②体系中会发生积炭反应

 ,为研究其热效应,还需要利用反应
,为研究其热效应,还需要利用反应 。
。③添加一定量的载氧剂
 ,可避免积炭反应发生,增大
,可避免积炭反应发生,增大 的值,推测可能发生的反应,写出化学反应方程式
的值,推测可能发生的反应,写出化学反应方程式(3)文献中指出
 和
和 可以发生反应生成
可以发生反应生成 和
和 ,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由
,且反应进行程度较大,但干重整反应器中进行程度小。结合键能数据,从平衡角度阐明理由| 化学键 | 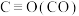 |  |  |  |
键能 | 1072 | 436 | 413 | 464 |
您最近半年使用:0次
名校
解题方法
10 . I.CO2相关转化的研究对解决环境、能源问题意义重大。
(1)CO2与CH4经催化重整可制得合成气:CO2(g)+CH4(g) 2CO(g)+2H2(g),按一定体积比加入CH4和CO2,在恒压下发生反应温度对CO和H2产率影响如图所示。生产中优选的温度范围是
2CO(g)+2H2(g),按一定体积比加入CH4和CO2,在恒压下发生反应温度对CO和H2产率影响如图所示。生产中优选的温度范围是___________ (填字母序号)。

a.800℃~850℃ b.850℃~900℃ c.950℃~1000℃
Ⅱ.CO2与H2反应制取甲醇(CH3OH)
(2)CO2与H2反应的热化学方程式表示如下:
反应i:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-58kJ·mol﹣1
CH3OH(g)+H2O(g) △H1=-58kJ·mol﹣1
反应ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+42kJ·mol﹣1
CO(g)+H2O(g) △H2=+42kJ·mol﹣1
写出CO(g)与H2(g)生成CH3OH(g)的热化学方程式___________ 。
(3)关于反应i和反应ⅱ的说法正确的是___________ 。
a.升高温度能使反应i的反应速率增大,平衡常数增大
b.增大压强能提高反应ⅱ中CO2的转化率
c.低温、高压有利于CO2催化加氢制取CH3OH
(4)某同学研究温度、压强对反应平衡的影响,得到上述反应i和反应ⅱ中CO2平衡转化率、甲醇选择性与温度、压强的关系如下图。已知:
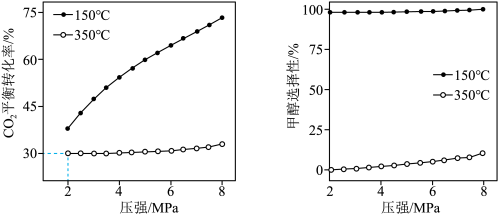
结合上图,350℃、2MPa时,发生的主要反应是___________ (填“反应i”或“反应ii”)。此条件下,a mol/LCO2和a mol/LH2在恒容、密闭容器中充分反应达到平衡,写出所发生反应的化学平衡常数K的计算过程及结果___________ (结果用分数表示)。
Ⅲ.利用Al-CO2电池(工作原理如下图所示)能有效地将CO2转化成化工原料草酸铝Al2(C2O4)3。

(5)电池的负极反应式为___________ 。
(6)电池的正极反应式:2CO2+2e-= (草酸根)。正极反应过程分两步,其中O2起催化作用,催化过程可表示为:①6O2+6e-=6
(草酸根)。正极反应过程分两步,其中O2起催化作用,催化过程可表示为:①6O2+6e-=6 ,②∙∙∙∙∙∙
,②∙∙∙∙∙∙
写出反应②的离子方程式___________ 。
(7)若电池反应生成1molAl2(C2O4)3,则转移电子的物质的量为___________ 。
(1)CO2与CH4经催化重整可制得合成气:CO2(g)+CH4(g)
 2CO(g)+2H2(g),按一定体积比加入CH4和CO2,在恒压下发生反应温度对CO和H2产率影响如图所示。生产中优选的温度范围是
2CO(g)+2H2(g),按一定体积比加入CH4和CO2,在恒压下发生反应温度对CO和H2产率影响如图所示。生产中优选的温度范围是
a.800℃~850℃ b.850℃~900℃ c.950℃~1000℃
Ⅱ.CO2与H2反应制取甲醇(CH3OH)
(2)CO2与H2反应的热化学方程式表示如下:
反应i:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-58kJ·mol﹣1
CH3OH(g)+H2O(g) △H1=-58kJ·mol﹣1反应ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+42kJ·mol﹣1
CO(g)+H2O(g) △H2=+42kJ·mol﹣1写出CO(g)与H2(g)生成CH3OH(g)的热化学方程式
(3)关于反应i和反应ⅱ的说法正确的是
a.升高温度能使反应i的反应速率增大,平衡常数增大
b.增大压强能提高反应ⅱ中CO2的转化率
c.低温、高压有利于CO2催化加氢制取CH3OH
(4)某同学研究温度、压强对反应平衡的影响,得到上述反应i和反应ⅱ中CO2平衡转化率、甲醇选择性与温度、压强的关系如下图。已知:


结合上图,350℃、2MPa时,发生的主要反应是
Ⅲ.利用Al-CO2电池(工作原理如下图所示)能有效地将CO2转化成化工原料草酸铝Al2(C2O4)3。

(5)电池的负极反应式为
(6)电池的正极反应式:2CO2+2e-=
 (草酸根)。正极反应过程分两步,其中O2起催化作用,催化过程可表示为:①6O2+6e-=6
(草酸根)。正极反应过程分两步,其中O2起催化作用,催化过程可表示为:①6O2+6e-=6 ,②∙∙∙∙∙∙
,②∙∙∙∙∙∙写出反应②的离子方程式
(7)若电池反应生成1molAl2(C2O4)3,则转移电子的物质的量为
您最近半年使用:0次