名校
1 . 碳单质在工业上有多种用途。
(1)焦炭可用于制取水煤气。测得 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了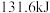 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是___________ 。
(2)活性炭可处理大气污染物 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:

①请结合上表数据,写出 与活性炭反应的化学方程式
与活性炭反应的化学方程式___________ 。
②上述反应 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。
Ⅰ.计算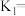
___________ 。
Ⅱ.根据上述信息判断,温度 和
和 的关系是(填序号)
的关系是(填序号)___________ 。
a. b.
b. c.无法比较
c.无法比较
③在T温度下反应达到平衡后,下列措施不能改变 的转化率的是
的转化率的是___________ 。
a.增大 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属。若 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到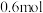 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是___________ 。
(1)焦炭可用于制取水煤气。测得
 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了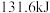 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是(2)活性炭可处理大气污染物
 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出
 与活性炭反应的化学方程式
与活性炭反应的化学方程式②上述反应
 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。Ⅰ.计算
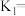
Ⅱ.根据上述信息判断,温度
 和
和 的关系是(填序号)
的关系是(填序号)a.
 b.
b. c.无法比较
c.无法比较③在T温度下反应达到平衡后,下列措施不能改变
 的转化率的是
的转化率的是a.增大
 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F(3)工业上可用焦炭冶炼金属。若
 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到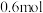 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是
您最近半年使用:0次
名校
2 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)25℃时, 和
和 能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是
能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是___________ 。
(2)与 燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型
燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型 燃料电池原理如下图所示:
燃料电池原理如下图所示:
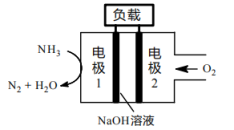
①电极1为___________ (填“正极”或“负极”),电极2的反应式为___________ 。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)=2H2O(g) ΔH1,N2(g)+3H2(g)=2NH3(g) ΔH2,4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3, 、
、 、
、 之间的关系式为:
之间的关系式为:
___________ 。
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是原电池可将氧化反应与还原反应___________ 进行,使得电子发生定向移动,形成电流。
(3)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是___________ 。
(4)常温常压下电解法合成氨的原理如下图所示:
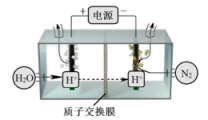
①阳极产生的气体是___________ 。
②阴极生成氨的电极反应式为___________ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式___________ 。
(1)25℃时,
 和
和 能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是
能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是(2)与
 燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型
燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型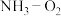 燃料电池原理如下图所示:
燃料电池原理如下图所示:
①电极1为
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)=2H2O(g) ΔH1,N2(g)+3H2(g)=2NH3(g) ΔH2,4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3,
 、
、 、
、 之间的关系式为:
之间的关系式为:
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是原电池可将氧化反应与还原反应
(3)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① |  |  |
| ② | 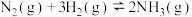 | 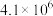 |

①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
您最近半年使用:0次
名校
解题方法
3 . 我国是世界上最早冶炼锌的国家之一,有独立的炼锌发展史。在现代工业中,锌在电池制造、合金生产等领域有着广泛的用途。
已知:锌的熔点420℃,沸点907℃。
Ⅰ.如图是古代以炉甘石(ZnCO3)为原料炼锌的示意图

i.

ii.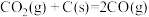

……
总反应:

(1)利用 和
和 计算
计算 时,还需要利用
时,还需要利用___________ 反应的 。
。
(2)c处收集到___________ (填“固”“液”或“气”)态金属锌。a和b两处小孔位于相反的位置,目的是___________ 。
(3)通过观察b处火焰可确定罐内反应状态。正常时,火焰应呈蓝色,燃烧的物质主要是___________ 。当火焰呈蓝绿色(Zn的焰色)时,可采取的措施是___________ 。
Ⅱ.现代炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2)为原料联合生产锌和高纯度二氧化锰的一种流程如下:
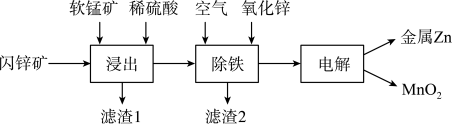
(4)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
i:
ii:……
①写出ii的离子方程式:___________ 。
②下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.___________ 。
(5)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是___________ 。
(6)电解:总反应(未配平): 。若不考虑副反应,为了使电解液中的Zn2+、Mn2+均恰好完全反应,理论上需要再添加哪种离子?
。若不考虑副反应,为了使电解液中的Zn2+、Mn2+均恰好完全反应,理论上需要再添加哪种离子?___________ 。(填“Zn2+”、“Mn2+”或“都不需要”)。
已知:锌的熔点420℃,沸点907℃。
Ⅰ.如图是古代以炉甘石(ZnCO3)为原料炼锌的示意图

i.


ii.
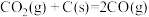

……
总反应:


(1)利用
 和
和 计算
计算 时,还需要利用
时,还需要利用 。
。(2)c处收集到
(3)通过观察b处火焰可确定罐内反应状态。正常时,火焰应呈蓝色,燃烧的物质主要是
Ⅱ.现代炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2)为原料联合生产锌和高纯度二氧化锰的一种流程如下:

(4)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
i:

ii:……
①写出ii的离子方程式:
②下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.
(5)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是
(6)电解:总反应(未配平):
 。若不考虑副反应,为了使电解液中的Zn2+、Mn2+均恰好完全反应,理论上需要再添加哪种离子?
。若不考虑副反应,为了使电解液中的Zn2+、Mn2+均恰好完全反应,理论上需要再添加哪种离子?
您最近半年使用:0次
名校
解题方法
4 . 合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
 kJ·mol
kJ·mol

 kJ·mol
kJ·mol


(1)
_______ kJ·mol-1(用含a、b的代数式表示)
(2)目前工业合成氨的主要方法是HaberBosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是_______ 。
②理论上,为了增大平衡时 的转化率,可采取的措施是
的转化率,可采取的措施是_______ (写出1条)。
③将物质的量之比为1∶3的 和
和 充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下 的转化率为
的转化率为_______ ,平衡常数
_______ (可用分数表示)。
④若按以下浓度投料,其它反应条件与③相同,起始时反应进行的方向为_______ (填“正向”、“逆向”或“无法判断”)。
(3)图1是某压强下 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是_______ 。
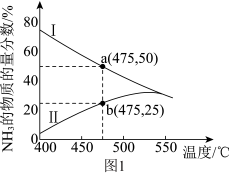
a.图中a点,容器内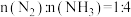
b.图中b点,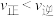
c.400~530℃,II中 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
(4)电化学气敏传感器可用于检测环境中 的含量,其工作原理如图2所示。
的含量,其工作原理如图2所示。

①反应消耗的 与
与 的物质的量之比为
的物质的量之比为_______ 。
②a极的电极反应式为_______ 。
已知:

 kJ·mol
kJ·mol

 kJ·mol
kJ·mol


(1)

(2)目前工业合成氨的主要方法是HaberBosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是
②理论上,为了增大平衡时
 的转化率,可采取的措施是
的转化率,可采取的措施是③将物质的量之比为1∶3的
 和
和 充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:| 物质 |  |  |  |
平衡时物质的量 | 0.2 | 0.6 | 0.2 |
 的转化率为
的转化率为
④若按以下浓度投料,其它反应条件与③相同,起始时反应进行的方向为
| 物质 |  |  |  |
起始浓度(mol·L ) ) | 0.5 | 1.5 | 0.5 |
 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
a.图中a点,容器内
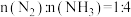
b.图中b点,
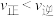
c.400~530℃,II中
 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大(4)电化学气敏传感器可用于检测环境中
 的含量,其工作原理如图2所示。
的含量,其工作原理如图2所示。
①反应消耗的
 与
与 的物质的量之比为
的物质的量之比为②a极的电极反应式为
您最近半年使用:0次
解题方法
5 . 煤的综合利用是合理利用资源,实现“绿色发展”的重要途径。图是某煤化工产业链的一部分
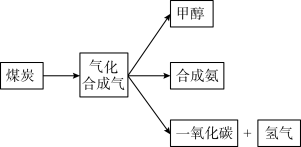
(1)已知:
a. C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
b. 2H2(g)+O2(g)=2H2O(g) ΔH=-484.0 kJ·mol-1
c. CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
①计算反应a消耗24 g C(s)时,反应放出的热量为_______ kJ。
②为加快水煤气(CO和H2混合气)的生产速率可采取措施有_______ 。
A. 将煤炭粉碎 B. 降低温度 C. 增大反应容器体积 D. 使用催化剂
③根据已知,写出 C(s)与H2O(g)反应制备水煤气的热化学方程式是_______ 。
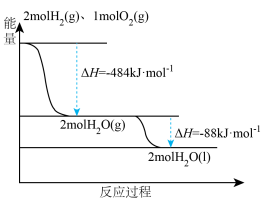
(2)煤气化后得到气体中的氢气是一种新型的绿色能源,根据如图,写出表示氢气燃烧热的热化学方程式为_______
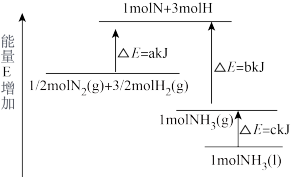
(3)工业合成氨用途广泛,其能量变化如图所示,根据图示,写出合成N2(g)和H2(g)合成液态氨的热化学方程式_______ 。

(1)已知:
a. C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
b. 2H2(g)+O2(g)=2H2O(g) ΔH=-484.0 kJ·mol-1
c. CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1①计算反应a消耗24 g C(s)时,反应放出的热量为
②为加快水煤气(CO和H2混合气)的生产速率可采取措施有
A. 将煤炭粉碎 B. 降低温度 C. 增大反应容器体积 D. 使用催化剂
③根据已知,写出 C(s)与H2O(g)反应制备水煤气的热化学方程式是
(2)煤气化后得到气体中的氢气是一种新型的绿色能源,根据如图,写出表示氢气燃烧热的热化学方程式为

(3)工业合成氨用途广泛,其能量变化如图所示,根据图示,写出合成N2(g)和H2(g)合成液态氨的热化学方程式

您最近半年使用:0次
6 . 丙酸钙[(CH3CH2COO)2Ca]在生活、生产中有广泛用途。
I.用蛋壳(主要成分为CaCO3)制备丙酸钙。
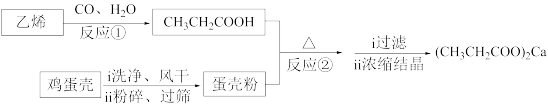
(1)上述流程中,有利于提高反应速率的操作有_______ 。
(2)已知:
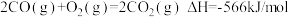

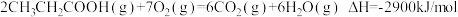
反应①: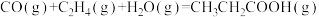 =
=______________ kJ/mol。
(3)反应②的化学方程式为_______ 。
Ⅱ.丙酸钙的用途
(4)丙酸钙是世界卫生组织批准使用的食品用防霉剂。某小组同学为探究丙酸钙的防霉效果,按下列①~⑥的配方(每个配方均使用50g面粉和0.75g酵母)蒸制6个馒头,冷却后置于密封袋中,定期观察记录如下:
本实验可以得出的结论(写两点):①_______ ;②_______ 。
(5) 已知:丙酸钙高温分解产生CaO和还原性的烃或烃基(以CHX表示) 。燃煤中添加丙酸钙后,尾气中SO2、NO排放量显著减少,其可能的原因是_______ 。
I.用蛋壳(主要成分为CaCO3)制备丙酸钙。

(1)上述流程中,有利于提高反应速率的操作有
(2)已知:
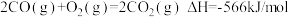

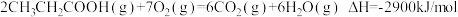
反应①:
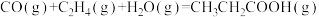 =
=(3)反应②的化学方程式为
Ⅱ.丙酸钙的用途
(4)丙酸钙是世界卫生组织批准使用的食品用防霉剂。某小组同学为探究丙酸钙的防霉效果,按下列①~⑥的配方(每个配方均使用50g面粉和0.75g酵母)蒸制6个馒头,冷却后置于密封袋中,定期观察记录如下:
组别 | 第一组 | 第二组 | ||||
序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
蔗糖/g | 0 | 0 | 0 | 5 | 5 | 5 |
丙酸钙/g | 0 | 0.06 | 0.10 | 0 | 0.06 | 0.10 |
开始发霉的时间 | 第3天 | 第4天 | 第5天 | 第3天 | 第4天 | 第5天 |
本实验可以得出的结论(写两点):①
(5) 已知:丙酸钙高温分解产生CaO和还原性的烃或烃基(以CHX表示) 。燃煤中添加丙酸钙后,尾气中SO2、NO排放量显著减少,其可能的原因是
您最近半年使用:0次
名校
解题方法
7 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
Ⅰ.汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:
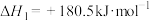

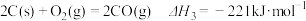
若某反应的平衡常数表达式为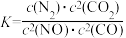 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
(2) 在一定条件下可发生分解:
在一定条件下可发生分解: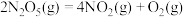 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是_______ (填字母)。
a. 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c.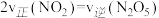 d.气体的密度保持不变
d.气体的密度保持不变
Ⅱ.甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
(3)已知 CO2(g) + 3H2(g)⇌ CH3OH(g) + H2O(g),将 和
和 按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成
按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
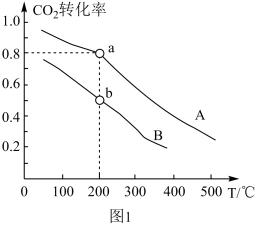
①a、b两点化学反应速率分别用Va、Vb,表示,则Va_______ Vb (填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K=_______ 。
(4)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_______ 。
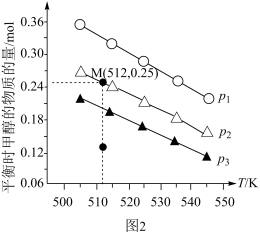
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为
D.在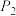 及512 K时,图中N点
及512 K时,图中N点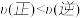
(5) 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即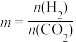 。
。
①图3中投料比相同,温度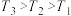 ,则该反应的焓变
,则该反应的焓变
_______ 0(填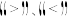 )。
)。

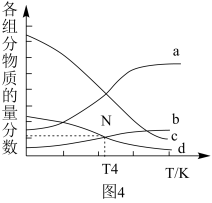
②m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_______ (填化学式)。
Ⅰ.汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:

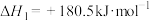

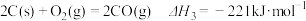
若某反应的平衡常数表达式为
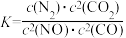 ,则此反应的热化学方程式为
,则此反应的热化学方程式为(2)
 在一定条件下可发生分解:
在一定条件下可发生分解: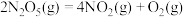 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是
进行该反应,能判断反应已达到化学平衡状态的是a.
 和
和 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化c.
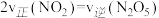 d.气体的密度保持不变
d.气体的密度保持不变Ⅱ.甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
(3)已知 CO2(g) + 3H2(g)⇌ CH3OH(g) + H2O(g),将
 和
和 按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成
按物质的量之比1∶3充入体积为2.0 L的恒容密闭容器中反应生成 ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下 转化率随温度的变化关系。
转化率随温度的变化关系。
①a、b两点化学反应速率分别用Va、Vb,表示,则Va
②列出a点对应的平衡常数表达式K=
(4)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g) + 3H2(g)⇌CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是

A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为

D.在
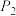 及512 K时,图中N点
及512 K时,图中N点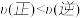
(5)
 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)⇌C2H5OH(g) + 3H2O(g)  ;m代表起始时的投料比,即
;m代表起始时的投料比,即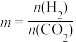 。
。①图3中投料比相同,温度
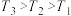 ,则该反应的焓变
,则该反应的焓变
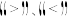 )。
)。
②m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为

您最近半年使用:0次
2021-02-02更新
|
670次组卷
|
3卷引用:北京市密云二中2023-2024学年高二上学期10月月考化学试卷
8 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)与H2-O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如下图所示:
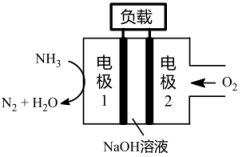
①电极1为_______ (填“正极”或“负极”),电极2的反应式为_______ 。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:i.2H2(g)+O2(g)=2H2O(g) ΔH1
ii.N2(g)+3H2(g)⇌2NH3(g) ΔH2
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=_______ 。
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是_______ 。
(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是_______ 。。
②列举一条既能提高速率又能提高原料转化率的措施_______ 。
(3)常温常压下电解法合成氨的原理如下图所示:
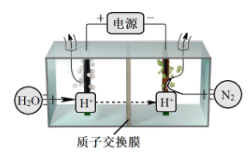
①阳极产生的气体是_______ 。
②阴极生成氨的电极反应式为_______ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式_______ 。
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有_______ 性。
(1)与H2-O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如下图所示:

①电极1为
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:i.2H2(g)+O2(g)=2H2O(g) ΔH1
ii.N2(g)+3H2(g)⇌2NH3(g) ΔH2
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是
(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是
②列举一条既能提高速率又能提高原料转化率的措施
(3)常温常压下电解法合成氨的原理如下图所示:

①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有
您最近半年使用:0次
2021-01-22更新
|
256次组卷
|
2卷引用:北京市丰台区2020-2021学年高二上学期期末考试化学试题
9 . 甲醇(CH3OH)在作为内燃机燃料、制作燃料电池等方面具有重要的用途。
(1)25℃、101 kPa时,1 mol甲醇完全燃烧生成液态水释放的能量是762.5 kJ,写出该反应的热化学方程式______ 。
(2)64 g甲醇完全燃烧生成液态水释放的热量为_______ kJ。
(3)工业上以CO2和H2为原料合成甲醇:CO2(g) + 3H2(g) = CH3OH(g)+H2O(l) ΔH= a kJ/mol,若要计算a,需要知道甲醇完全燃烧生成液态水的焓变以及_______ 的焓变(文字描述)。
(4)甲醇的另一种用途是制成燃料电池,装置图如图所示。采用铂作为电极材料,稀硫酸作电解质溶液,向其中一个电极直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
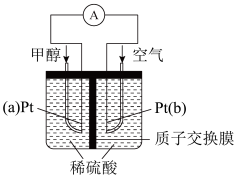
① 电池的正极反应式为:____________ ,负极反应式为:___________ 。
② 该电池工作时,H+的移动方向是由_____ 极经质子交换膜流向_____ 极(填“a”或“b”)。
③ 甲醇可作为内燃机燃料,也可用于制作燃料电池,其反应均为甲醇与氧气的反应,但能量转化形式不同,电池将化学能转化为电能的根本原因是___________ 。
(1)25℃、101 kPa时,1 mol甲醇完全燃烧生成液态水释放的能量是762.5 kJ,写出该反应的热化学方程式
(2)64 g甲醇完全燃烧生成液态水释放的热量为
(3)工业上以CO2和H2为原料合成甲醇:CO2(g) + 3H2(g) = CH3OH(g)+H2O(l) ΔH= a kJ/mol,若要计算a,需要知道甲醇完全燃烧生成液态水的焓变以及
(4)甲醇的另一种用途是制成燃料电池,装置图如图所示。采用铂作为电极材料,稀硫酸作电解质溶液,向其中一个电极直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:

① 电池的正极反应式为:
② 该电池工作时,H+的移动方向是由
③ 甲醇可作为内燃机燃料,也可用于制作燃料电池,其反应均为甲醇与氧气的反应,但能量转化形式不同,电池将化学能转化为电能的根本原因是
您最近半年使用:0次
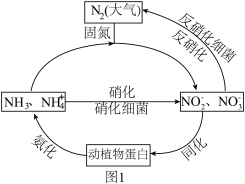
10 . (1)如图1的氮循环是生态系统物质循环的重要部分,人类活动加剧了氮循环中的物质转化。
①下列说法正确的是_____ (填字母序号)。
A.固氮过程中,N2只做氧化剂
B.硝化过程需要有氧化剂参与
C.反硝化过程有助于弥补人工固氮对氮循环造成的影响
D.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
②反硝化过程中,CH3OH可作为反应的还原剂,1mol还原剂失去6mol电子。请将该反应的离子方程式补充完整:5CH3OH+_____ NO3﹣
__________ +__________ +__________ +__________ 。
(2)研究表明,氮氧化物(NOx)和二氧化硫都与大气中雾霾的形成有关。
①已知:SO2生成SO3总反应方程式是2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ/mol
此反应可通过如下两步完成:2NO(g)+O2(g)⇌2NO2(g)△H1=﹣113kJ/mol
NO2(g)+SO2(g)⇌SO3(g)+NO(g)△H2=_____ 。
②一定温度下,向2L恒容密闭容器中充入NO2和SO2各1mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1:3,则NO2的平衡转化率是_____ 。
(3)砷(As)是第四周期ⅤA族元素,其化合物,有着广泛的用途。
①AsH3的稳定性比NH3的稳定性_____ (填“强”或“弱”)。用原子结构解释原因_____ 。
②常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_____ 。
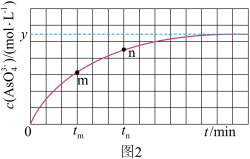
③298K时,将20mL3x mol•L﹣1 Na3AsO3、20mL3x mol•L﹣1 I2和20mLNaOH溶液混合,发生反应: (aq)+I2(aq)+2OH﹣⇌
(aq)+I2(aq)+2OH﹣⇌ (aq)+2I﹣(aq)+H2O(l)。溶液中c(
(aq)+2I﹣(aq)+H2O(l)。溶液中c( )与反应时间(t)的关系如图2所示。若平衡时溶液的pH=14,则该反应的平衡常数K为
)与反应时间(t)的关系如图2所示。若平衡时溶液的pH=14,则该反应的平衡常数K为_____ 。
①下列说法正确的是
A.固氮过程中,N2只做氧化剂
B.硝化过程需要有氧化剂参与
C.反硝化过程有助于弥补人工固氮对氮循环造成的影响
D.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
②反硝化过程中,CH3OH可作为反应的还原剂,1mol还原剂失去6mol电子。请将该反应的离子方程式补充完整:5CH3OH+

(2)研究表明,氮氧化物(NOx)和二氧化硫都与大气中雾霾的形成有关。
①已知:SO2生成SO3总反应方程式是2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ/mol
此反应可通过如下两步完成:2NO(g)+O2(g)⇌2NO2(g)△H1=﹣113kJ/mol
NO2(g)+SO2(g)⇌SO3(g)+NO(g)△H2=
②一定温度下,向2L恒容密闭容器中充入NO2和SO2各1mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1:3,则NO2的平衡转化率是
(3)砷(As)是第四周期ⅤA族元素,其化合物,有着广泛的用途。
①AsH3的稳定性比NH3的稳定性
②常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
③298K时,将20mL3x mol•L﹣1 Na3AsO3、20mL3x mol•L﹣1 I2和20mLNaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH﹣⇌
(aq)+I2(aq)+2OH﹣⇌ (aq)+2I﹣(aq)+H2O(l)。溶液中c(
(aq)+2I﹣(aq)+H2O(l)。溶液中c( )与反应时间(t)的关系如图2所示。若平衡时溶液的pH=14,则该反应的平衡常数K为
)与反应时间(t)的关系如图2所示。若平衡时溶液的pH=14,则该反应的平衡常数K为

您最近半年使用:0次



