解题方法
1 . CO2可用于制备CH4、合成气(CO、H2),是CO2资源化利用的重要途径。
(1)CO2甲烷化过程可能发生反应:
i.
ii.
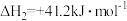
iii.
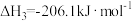
△H1=_______  。
。
(2)利用CO、 合成甲醇的反应为
合成甲醇的反应为
 ,向密闭容器中充入1molCO和
,向密闭容器中充入1molCO和 ,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
①由此可知,P1_______ P2(填“大于”或“小于”)。有利于提高CO平衡转化率的措施是_______ 。
②P2kPa、250℃条件下,反应5min达到平衡,此时H2的物质的量为_______ ,该反应的压强平衡常数Kp=_______ (kPa)2(用分压代替浓度,分压=总压×该组分物质的量分数,用P2的式子表示)。
(1)CO2甲烷化过程可能发生反应:
i.

ii.

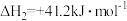
iii.

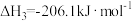
△H1=
 。
。(2)利用CO、
 合成甲醇的反应为
合成甲醇的反应为
 ,向密闭容器中充入1molCO和
,向密闭容器中充入1molCO和 ,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:温度/℃ 转化率 压强/kPa | 50 | 100 | 150 | 200 | 250 | 300 |
| P1 | 0.82 | 0.70 | 0.34 | 0.12 | 0.04 | 0.02 |
| P2 | 0.90 | 0.86 | 0.76 | 0.48 | 0.20 | 0.10 |
①由此可知,P1
②P2kPa、250℃条件下,反应5min达到平衡,此时H2的物质的量为
您最近一年使用:0次
解题方法
2 . CO2可用于制备CH4、合成气(CO、H2),是CO2资源化利用的重要途径。
(1)CO2甲烷化过程可能发生反应:
i.
ii.
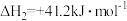
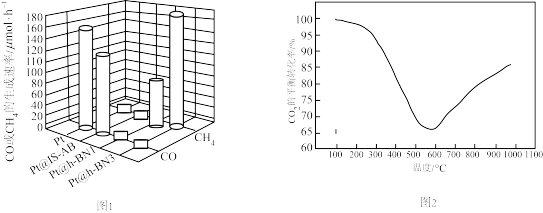
iii.
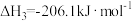
①
___________  。
。
②利用不同催化剂,在一定温度和反应时间条件下,测得产物的生成速率与催化剂的关系如图1.可知有利于制甲烷的催化剂是___________ 。
③压强一定时,按照 投料,发生上述反应,
投料,发生上述反应, 的平衡转化率与温度的关系如图2。
的平衡转化率与温度的关系如图2。
请解释温度高于600℃之后,随着温度升高 转化率增大的原因
转化率增大的原因___________ 。
(2)利用CO、 合成甲醇的反应为
合成甲醇的反应为
 ,向密闭容器中充入1molCO和
,向密闭容器中充入1molCO和 ,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
①由此可知,P1_____ P2(填“大于”或“小于”)。有利于提高CO平衡转化率的措施是______ 。
②P2kPa、250℃条件下,反应5min达到平衡,此时H2的物质的量为_____ ,该反应的压强平衡常数Kp=_______ (kPa)2(用分压代替浓度,分压=总压×该组分物质的量分数,用P2的式子表示)。
(1)CO2甲烷化过程可能发生反应:
i.

ii.

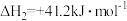
iii.

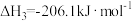
①

 。
。②利用不同催化剂,在一定温度和反应时间条件下,测得产物的生成速率与催化剂的关系如图1.可知有利于制甲烷的催化剂是
③压强一定时,按照
 投料,发生上述反应,
投料,发生上述反应, 的平衡转化率与温度的关系如图2。
的平衡转化率与温度的关系如图2。
请解释温度高于600℃之后,随着温度升高
 转化率增大的原因
转化率增大的原因(2)利用CO、
 合成甲醇的反应为
合成甲醇的反应为
 ,向密闭容器中充入1molCO和
,向密闭容器中充入1molCO和 ,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:| 温度/℃ 转化率 压强/kPa | 50 | 100 | 150 | 200 | 250 | 300 |
| P1 | 0.82 | 0.70 | 0.34 | 0.12 | 0.04 | 0.02 |
| P2 | 0.90 | 0.86 | 0.76 | 0.48 | 0.20 | 0.10 |
②P2kPa、250℃条件下,反应5min达到平衡,此时H2的物质的量为
您最近一年使用:0次
名校
解题方法
3 . 研究反应过程的热量变化对于生产生活有重要意义。
Ⅰ.甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在一定条件下合成甲醇。请按要求回答下列问题:
(1)反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是
CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是___ (填字母代号)。

A.该可逆反应的正反应为吸热反应
B.断裂反应物中的化学键所吸收的总能量小于形成生成物中的化学键所释放的总能量
C.曲线b是使用了催化剂对应的曲线,且加入催化剂后,反应热变小
(2)CO、CO2和H2在合成过程中发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
则ΔH3=____ 。
(3)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
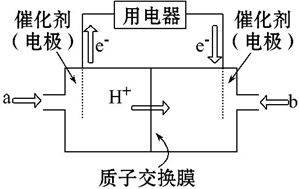
则通入a气体的电极是电池的____ (填“正”或“负”)极,其电极反应式为___ 。
Ⅱ.已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态下,有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图所示:

(1)在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2的体积分数不小于_____ 。
(2)若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,S(s)+O2(g)===SO2(g)ΔH=-a kJ·mol-1,则S8中硫硫键的键能为_____ 。
Ⅰ.甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在一定条件下合成甲醇。请按要求回答下列问题:
(1)反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是
CH3OH(g)+H2O(g)在使用和未使用催化剂时,反应过程和能量的对应关系如图所示。下列说法正确的是
A.该可逆反应的正反应为吸热反应
B.断裂反应物中的化学键所吸收的总能量小于形成生成物中的化学键所释放的总能量
C.曲线b是使用了催化剂对应的曲线,且加入催化剂后,反应热变小
(2)CO、CO2和H2在合成过程中发生的主要反应如下:
①CO(g)+2H2(g)
 CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1③CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3则ΔH3=
(3)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

则通入a气体的电极是电池的
Ⅱ.已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态下,有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图所示:

(1)在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2的体积分数不小于
(2)若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,S(s)+O2(g)===SO2(g)ΔH=-a kJ·mol-1,则S8中硫硫键的键能为
您最近一年使用:0次
名校
解题方法
4 . 科幻电影《阿凡达》中外星人流的是蓝色的血液,其实血液的颜色主要是由血蛋白中含有的金属元素决定的,如含铁元素的为常见红色血液、含铜元素的为蓝色血液、含钒元素的为绿色血液等,铜、铁、钒在科学研究和工农业生产中有许多用途。回答下列问题:
(1)钒催化剂参与反应的能量变化如图所示,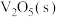 与
与 反应生成
反应生成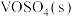 和
和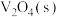 的热化学方程式为
的热化学方程式为___________ 。
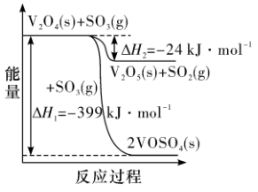
(2) 溶解在NaOH溶液中,可得到钒酸钠
溶解在NaOH溶液中,可得到钒酸钠 。
。 与
与 的空间结构相同,其中V原子的杂化方式为
的空间结构相同,其中V原子的杂化方式为________ ,写出一种空间结构与之相同的阳离子:________ (填离子符号)。
(3) 与双缩脲(
与双缩脲( )在碱性溶液中作用形成紫红色络合物。
)在碱性溶液中作用形成紫红色络合物。
①该配离子中不存在的作用力有___________ (填标号)。
a.离子键 b.共价键 c.配位键
②双缩脲中所含元素中为同周期的元素的第一电离能由大到小的顺序为___________ 。
(4)向 溶液中加入过量氨水,可生成
溶液中加入过量氨水,可生成 配离子。
配离子。
①1mol 含有σ键的数目为
含有σ键的数目为___________ 。
②画出 的结构:
的结构:___________ (用“→”或“—”将配位键表示出来)。
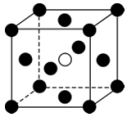
(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示(黑球代表Fe,白球代表N),该反应的化学方程式为___________ 。若该晶体的密度是 ,则两个距离最近的Fe原子间的距离为
,则两个距离最近的Fe原子间的距离为___________ nm(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)钒催化剂参与反应的能量变化如图所示,
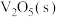 与
与 反应生成
反应生成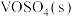 和
和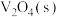 的热化学方程式为
的热化学方程式为
(2)
 溶解在NaOH溶液中,可得到钒酸钠
溶解在NaOH溶液中,可得到钒酸钠 。
。 与
与 的空间结构相同,其中V原子的杂化方式为
的空间结构相同,其中V原子的杂化方式为(3)
 与双缩脲(
与双缩脲( )在碱性溶液中作用形成紫红色络合物。
)在碱性溶液中作用形成紫红色络合物。①该配离子中不存在的作用力有
a.离子键 b.共价键 c.配位键
②双缩脲中所含元素中为同周期的元素的第一电离能由大到小的顺序为
(4)向
 溶液中加入过量氨水,可生成
溶液中加入过量氨水,可生成 配离子。
配离子。①1mol
 含有σ键的数目为
含有σ键的数目为②画出
 的结构:
的结构:(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示(黑球代表Fe,白球代表N),该反应的化学方程式为
 ,则两个距离最近的Fe原子间的距离为
,则两个距离最近的Fe原子间的距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
5 . 硫酸亚铁在工农业生产中有许多用途,如可用作农药,防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
(1)在 气氛中,
气氛中,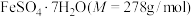 的脱水热分解过程如图所示:
的脱水热分解过程如图所示:
________ 。
(2)已知下列热化学方程式:
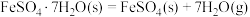

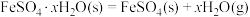

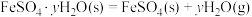

则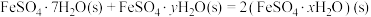 的
的
________  。
。
(3)将 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: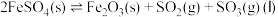 。平衡时
。平衡时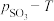 的关系如图所示。660K时,该反应的平衡总压
的关系如图所示。660K时,该反应的平衡总压
________ kPa、平衡常数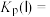
________  。
。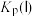 随反应温度升高而
随反应温度升高而________ (填“增大”“减小”或“不变”)。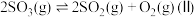 ,平衡时
,平衡时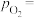
________ (用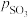 、
、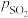 表示)。在929K时,
表示)。在929K时,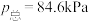 、
、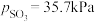 ,则
,则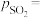
________ kPa,
________ kPa(列出计算式)。
(1)在
 气氛中,
气氛中,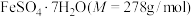 的脱水热分解过程如图所示:
的脱水热分解过程如图所示: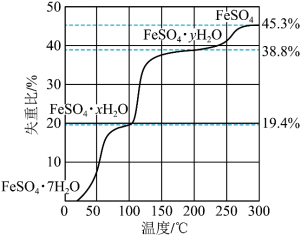

(2)已知下列热化学方程式:
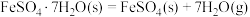

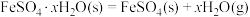

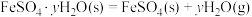

则
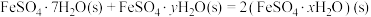 的
的
 。
。(3)将
 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: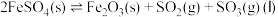 。平衡时
。平衡时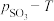 的关系如图所示。660K时,该反应的平衡总压
的关系如图所示。660K时,该反应的平衡总压
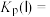
 。
。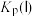 随反应温度升高而
随反应温度升高而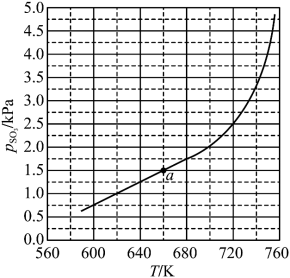
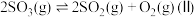 ,平衡时
,平衡时
 、
、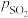 表示)。在929K时,
表示)。在929K时,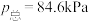 、
、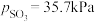 ,则
,则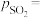

您最近一年使用:0次
2023-07-19更新
|
506次组卷
|
2卷引用:湖南师范大学附属中学2024届高三摸底考试化学试题
解题方法
6 . 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。

(1)实验室中常用来制备氯气的化学方程式为__________ 。
(2)工业上利用天然气(主要成分为 )与
)与 进行高温重整制备CO,已知
进行高温重整制备CO,已知 、
、 和CO的燃烧热(
和CO的燃烧热( )分别为
)分别为 、
、 、
、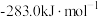 ,则生成1mol CO所需热量为
,则生成1mol CO所需热量为__________ (保留2位小数)。
(3)实验室中可用氯仿( )与双氧水直接反应制备光气,其反应的化学方程式为:
)与双氧水直接反应制备光气,其反应的化学方程式为:__________ 。
(4)右图是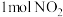 和1mol CO反应生成
和1mol CO反应生成 和NO过程中能量变化示意图,则该反应是
和NO过程中能量变化示意图,则该反应是______ (填“吸热”或“放热”)反应;若使用催化剂,则图中:
______ 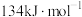 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(5)已知:
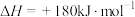

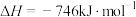
则反应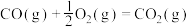 的
的
______ 
(6)已知 、
、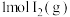 与
与 分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成
分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成 和
和 的热化学方程式为:
的热化学方程式为:______ 。

(1)实验室中常用来制备氯气的化学方程式为
(2)工业上利用天然气(主要成分为
 )与
)与 进行高温重整制备CO,已知
进行高温重整制备CO,已知 、
、 和CO的燃烧热(
和CO的燃烧热( )分别为
)分别为 、
、 、
、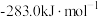 ,则生成1mol CO所需热量为
,则生成1mol CO所需热量为(3)实验室中可用氯仿(
 )与双氧水直接反应制备光气,其反应的化学方程式为:
)与双氧水直接反应制备光气,其反应的化学方程式为:(4)右图是
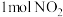 和1mol CO反应生成
和1mol CO反应生成 和NO过程中能量变化示意图,则该反应是
和NO过程中能量变化示意图,则该反应是
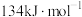 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。(5)已知:

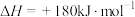

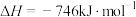
则反应
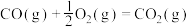 的
的

(6)已知
 、
、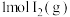 与
与 分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成
分子中化学键断裂时分别需要吸收的能量为436kJ、151kJ、299kJ,则HI分解生成 和
和 的热化学方程式为:
的热化学方程式为:
您最近一年使用:0次
解题方法
7 . Ⅰ.碘及其化合物在化工生产中用途广泛。298K时碘甲烷( )热裂解制低碳烯烃的主要反应如下:
)热裂解制低碳烯烃的主要反应如下:
①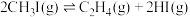

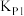
②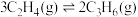

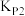
③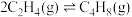

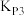
(1)实际生产中,发生副反应 ,
, ,
,
___________ (用含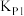 、
、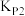 、
、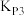 的代数式表达)。
的代数式表达)。
(2)对于反应①:提高碘甲烷平衡转化率的措施有___________ (任写一条)。
(3)反应②的速率表达式为 ,
, ,其中
,其中 、
、 为速率常数,只与温度有关。达平衡后,在温度升高过程中
为速率常数,只与温度有关。达平衡后,在温度升高过程中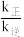
___________ (选填“增大”、“减小”或“不变”)。
(4)增大压强, 不断
不断___________ (填“增大”或“减小”),可能的原因是___________ 。
Ⅱ.在催化剂作用下 和
和 发生反应
发生反应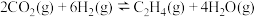 。在一密闭容器中投入
。在一密闭容器中投入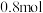
 和
和
 ,达平衡时测得
,达平衡时测得 的平衡转化率与温度(T)、压强(p)的关系如图所示。
的平衡转化率与温度(T)、压强(p)的关系如图所示。
___________ (只要列出计算式)。
III.利用电解法将 转化为
转化为 的制备原理如图所示,
的制备原理如图所示,___________ 。
 )热裂解制低碳烯烃的主要反应如下:
)热裂解制低碳烯烃的主要反应如下:①
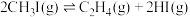

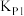
②
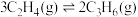

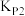
③
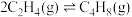

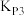
(1)实际生产中,发生副反应
 ,
, ,
,
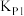 、
、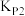 、
、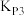 的代数式表达)。
的代数式表达)。(2)对于反应①:提高碘甲烷平衡转化率的措施有
(3)反应②的速率表达式为
 ,
, ,其中
,其中 、
、 为速率常数,只与温度有关。达平衡后,在温度升高过程中
为速率常数,只与温度有关。达平衡后,在温度升高过程中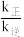
(4)增大压强,
 不断
不断Ⅱ.在催化剂作用下
 和
和 发生反应
发生反应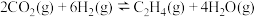 。在一密闭容器中投入
。在一密闭容器中投入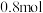
 和
和
 ,达平衡时测得
,达平衡时测得 的平衡转化率与温度(T)、压强(p)的关系如图所示。
的平衡转化率与温度(T)、压强(p)的关系如图所示。

III.利用电解法将
 转化为
转化为 的制备原理如图所示,
的制备原理如图所示,
您最近一年使用:0次
名校
8 . 甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义
(1)一种重要的工业制备甲醇的反应为
①
 H
H
②
 H1=+40.9kJ/mol
H1=+40.9kJ/mol
③
 H2=-90.4kJ/mol
H2=-90.4kJ/mol
试计算 H
H___________ kJ/mol。
(2)对于反应 ,v正=k正·p(CO2)·p3(H2),v逆=k逆·p(CH3OH)·p(H2)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,分别按初始投料比n(CO2):n(H2)=3:1,n(CO2):n(H2)=1:l、n(CO2):n(H2)=1:3进行反应,测得H2的平衡转化率随压强变化的关系如图所示:
,v正=k正·p(CO2)·p3(H2),v逆=k逆·p(CH3OH)·p(H2)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,分别按初始投料比n(CO2):n(H2)=3:1,n(CO2):n(H2)=1:l、n(CO2):n(H2)=1:3进行反应,测得H2的平衡转化率随压强变化的关系如图所示:___________ 。(填“a”、“b”或“c”)
②已知点N在曲线b上,计算该温度下压强平衡常数Kp=___________ (MPa)-2.(用平衡分压代替平衡浓度计算)
③该温度下,测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时v正:v逆=___________ 。(保留2位有效数字)
(3)甲醇催化制取丙烯的反应为: 。已知Arrhenius经验公式为
。已知Arrhenius经验公式为 (其中Ea为活化能,k为速率常数,R和C为常数)。该反应的Arrhenius经验公式的实验数据如图所示:
(其中Ea为活化能,k为速率常数,R和C为常数)。该反应的Arrhenius经验公式的实验数据如图所示:___________ kJ/mol。
②当用更高效催化剂时,请在图中画出Rlnk与 关系的曲线
关系的曲线___________ 。
(4)目前世界上一半以上的乙酸都采用甲醇与CO反应来制备:
 H<0。在恒压密闭容器中通入一定量的CH3OH和CO气体,测得甲醇的转化率随温度变化关系如图所示:
H<0。在恒压密闭容器中通入一定量的CH3OH和CO气体,测得甲醇的转化率随温度变化关系如图所示:___________ v(A)逆(填“>”,“=”或“<”)。
②B、C、D三点逆反应速率由大到小的顺序为___________ 。[用“v(D)”、“v(C)”、“v(B)”表示]
(1)一种重要的工业制备甲醇的反应为
①

 H
H②

 H1=+40.9kJ/mol
H1=+40.9kJ/mol③

 H2=-90.4kJ/mol
H2=-90.4kJ/mol试计算
 H
H(2)对于反应
 ,v正=k正·p(CO2)·p3(H2),v逆=k逆·p(CH3OH)·p(H2)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,分别按初始投料比n(CO2):n(H2)=3:1,n(CO2):n(H2)=1:l、n(CO2):n(H2)=1:3进行反应,测得H2的平衡转化率随压强变化的关系如图所示:
,v正=k正·p(CO2)·p3(H2),v逆=k逆·p(CH3OH)·p(H2)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,分别按初始投料比n(CO2):n(H2)=3:1,n(CO2):n(H2)=1:l、n(CO2):n(H2)=1:3进行反应,测得H2的平衡转化率随压强变化的关系如图所示:
②已知点N在曲线b上,计算该温度下压强平衡常数Kp=
③该温度下,测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时v正:v逆=
(3)甲醇催化制取丙烯的反应为:
 。已知Arrhenius经验公式为
。已知Arrhenius经验公式为 (其中Ea为活化能,k为速率常数,R和C为常数)。该反应的Arrhenius经验公式的实验数据如图所示:
(其中Ea为活化能,k为速率常数,R和C为常数)。该反应的Arrhenius经验公式的实验数据如图所示:
②当用更高效催化剂时,请在图中画出Rlnk与
 关系的曲线
关系的曲线(4)目前世界上一半以上的乙酸都采用甲醇与CO反应来制备:

 H<0。在恒压密闭容器中通入一定量的CH3OH和CO气体,测得甲醇的转化率随温度变化关系如图所示:
H<0。在恒压密闭容器中通入一定量的CH3OH和CO气体,测得甲醇的转化率随温度变化关系如图所示:
②B、C、D三点逆反应速率由大到小的顺序为
您最近一年使用:0次
2023-04-22更新
|
678次组卷
|
4卷引用:湖南省长郡中学2024届高三上学期月考卷(一)化学试题
解题方法
9 . 甲烷在日常生活及有机合成中用途广泛,某研究小组研究甲烷在高温下气相裂解反应的原理及其应用。
(1)已知:


则甲烷气相裂解反应: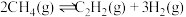 的
的 =
=________ 。
(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

① 时,向2L恒容密闭容器中充入0.3mol
时,向2L恒容密闭容器中充入0.3mol ,只发生反应
,只发生反应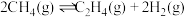 ,达到平衡时,测得
,达到平衡时,测得 。该反应达到平衡时,
。该反应达到平衡时, 的转化率为
的转化率为________ 。
②对上述平衡状态,若改变温度至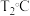 ,经10s后再次达到平衡,
,经10s后再次达到平衡, ,则10s内
,则10s内 的平均反应速率
的平均反应速率 =
=________ ,上述变化过程中T1________ (填“>”或“<”)T2,判断理由是________ 。
③在①建立的平衡状态基础上,其他条件不变,再通入0.5mol ,平衡将
,平衡将_________ (填“不移动”、“正向移动”或“逆向移动”),与原平衡相比, 的平衡转化率
的平衡转化率__________ (填“不变”、“变大”或“变小”)。
(3)若容器中发生反应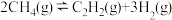 ,计算该反应在图中A点温度时的平衡常数Kp=
,计算该反应在图中A点温度时的平衡常数Kp=________________  (用平衡分压代替平衡浓度)。
(用平衡分压代替平衡浓度)。
(1)已知:



则甲烷气相裂解反应:
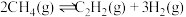 的
的 =
=(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①
 时,向2L恒容密闭容器中充入0.3mol
时,向2L恒容密闭容器中充入0.3mol ,只发生反应
,只发生反应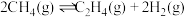 ,达到平衡时,测得
,达到平衡时,测得 。该反应达到平衡时,
。该反应达到平衡时, 的转化率为
的转化率为②对上述平衡状态,若改变温度至
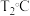 ,经10s后再次达到平衡,
,经10s后再次达到平衡, ,则10s内
,则10s内 的平均反应速率
的平均反应速率 =
=③在①建立的平衡状态基础上,其他条件不变,再通入0.5mol
 ,平衡将
,平衡将 的平衡转化率
的平衡转化率(3)若容器中发生反应
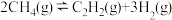 ,计算该反应在图中A点温度时的平衡常数Kp=
,计算该反应在图中A点温度时的平衡常数Kp= (用平衡分压代替平衡浓度)。
(用平衡分压代替平衡浓度)。
您最近一年使用:0次
10 . 甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g)ΔH1=+92.09kJ·mol-1
氧化法:CH3OH(g)+ O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64kJ·mol-1,则ΔH2=_______ 。
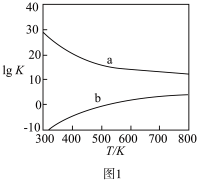
(2)图1为甲醇制备甲醛反应的lgK(K为平衡常数)随温度(T)的变化曲线。曲线_______ (填“a”或“b”)对应脱氢法,判断依据为_______ 。
II.甲醛的用途
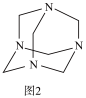
(3)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为_______ 。
(4)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为_______ 。
III.甲醛的检测
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_______ 。当电路中转移4×10-4mol电子时,传感器内参加反应的HCHO为_______ mg。

I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g)ΔH1=+92.09kJ·mol-1
氧化法:CH3OH(g)+
 O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64kJ·mol-1,则ΔH2=
(2)图1为甲醇制备甲醛反应的lgK(K为平衡常数)随温度(T)的变化曲线。曲线

II.甲醛的用途
(3)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为

(4)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为
III.甲醛的检测
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为

您最近一年使用:0次



