名校
1 . 碳单质在工业上有多种用途。
(1)焦炭可用于制取水煤气。测得 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了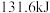 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是___________ 。
(2)活性炭可处理大气污染物 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:

①请结合上表数据,写出 与活性炭反应的化学方程式
与活性炭反应的化学方程式___________ 。
②上述反应 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。
Ⅰ.计算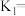
___________ 。
Ⅱ.根据上述信息判断,温度 和
和 的关系是(填序号)
的关系是(填序号)___________ 。
a. b.
b. c.无法比较
c.无法比较
③在T温度下反应达到平衡后,下列措施不能改变 的转化率的是
的转化率的是___________ 。
a.增大 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属。若 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到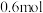 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是___________ 。
(1)焦炭可用于制取水煤气。测得
 碳与水蒸气完全反应生成水煤气(主要成分为
碳与水蒸气完全反应生成水煤气(主要成分为 和
和 )时,吸收了
)时,吸收了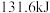 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是(2)活性炭可处理大气污染物
 。在
。在 密闭容器中加入
密闭容器中加入 和活性炭(无杂质),生成气体E和F。当温度分别在
和活性炭(无杂质),生成气体E和F。当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出
 与活性炭反应的化学方程式
与活性炭反应的化学方程式②上述反应
 时的平衡常数为
时的平衡常数为 时的平衡常数为
时的平衡常数为 。
。Ⅰ.计算
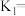
Ⅱ.根据上述信息判断,温度
 和
和 的关系是(填序号)
的关系是(填序号)a.
 b.
b. c.无法比较
c.无法比较③在T温度下反应达到平衡后,下列措施不能改变
 的转化率的是
的转化率的是a.增大
 b.增大压强 c.升高温度 d.移去部分F
b.增大压强 c.升高温度 d.移去部分F(3)工业上可用焦炭冶炼金属。若
 碳完全与赤铁矿(Fe2O3)反应,得到
碳完全与赤铁矿(Fe2O3)反应,得到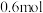 铁,同时生成2种常见气体,则该反应的化学方程式是
铁,同时生成2种常见气体,则该反应的化学方程式是
您最近一年使用:0次
名校
2 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)25℃时, 和
和 能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是
能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是___________ 。
(2)与 燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型
燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型 燃料电池原理如下图所示:
燃料电池原理如下图所示:
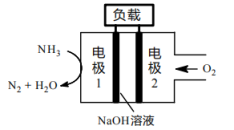
①电极1为___________ (填“正极”或“负极”),电极2的反应式为___________ 。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)=2H2O(g) ΔH1,N2(g)+3H2(g)=2NH3(g) ΔH2,4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3, 、
、 、
、 之间的关系式为:
之间的关系式为:
___________ 。
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是原电池可将氧化反应与还原反应___________ 进行,使得电子发生定向移动,形成电流。
(3)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是___________ 。
(4)常温常压下电解法合成氨的原理如下图所示:
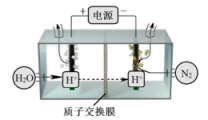
①阳极产生的气体是___________ 。
②阴极生成氨的电极反应式为___________ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式___________ 。
(1)25℃时,
 和
和 能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是
能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是(2)与
 燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型
燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型 燃料电池原理如下图所示:
燃料电池原理如下图所示:
①电极1为
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)=2H2O(g) ΔH1,N2(g)+3H2(g)=2NH3(g) ΔH2,4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3,
 、
、 、
、 之间的关系式为:
之间的关系式为:
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是原电池可将氧化反应与还原反应
(3)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① |  |  |
| ② | 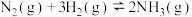 | 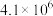 |

①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
您最近一年使用:0次
3 . 甲醇(CH3OH)在作为内燃机燃料、制作燃料电池等方面具有重要的用途。
(1)25℃、101 kPa时,1 mol甲醇完全燃烧生成液态水释放的能量是762.5 kJ,写出该反应的热化学方程式______ 。
(2)64 g甲醇完全燃烧生成液态水释放的热量为_______ kJ。
(3)工业上以CO2和H2为原料合成甲醇:CO2(g) + 3H2(g) = CH3OH(g)+H2O(l) ΔH= a kJ/mol,若要计算a,需要知道甲醇完全燃烧生成液态水的焓变以及_______ 的焓变(文字描述)。
(4)甲醇的另一种用途是制成燃料电池,装置图如图所示。采用铂作为电极材料,稀硫酸作电解质溶液,向其中一个电极直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
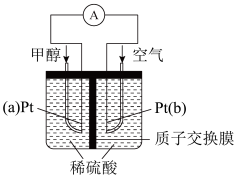
① 电池的正极反应式为:____________ ,负极反应式为:___________ 。
② 该电池工作时,H+的移动方向是由_____ 极经质子交换膜流向_____ 极(填“a”或“b”)。
③ 甲醇可作为内燃机燃料,也可用于制作燃料电池,其反应均为甲醇与氧气的反应,但能量转化形式不同,电池将化学能转化为电能的根本原因是___________ 。
(1)25℃、101 kPa时,1 mol甲醇完全燃烧生成液态水释放的能量是762.5 kJ,写出该反应的热化学方程式
(2)64 g甲醇完全燃烧生成液态水释放的热量为
(3)工业上以CO2和H2为原料合成甲醇:CO2(g) + 3H2(g) = CH3OH(g)+H2O(l) ΔH= a kJ/mol,若要计算a,需要知道甲醇完全燃烧生成液态水的焓变以及
(4)甲醇的另一种用途是制成燃料电池,装置图如图所示。采用铂作为电极材料,稀硫酸作电解质溶液,向其中一个电极直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:

① 电池的正极反应式为:
② 该电池工作时,H+的移动方向是由
③ 甲醇可作为内燃机燃料,也可用于制作燃料电池,其反应均为甲醇与氧气的反应,但能量转化形式不同,电池将化学能转化为电能的根本原因是
您最近一年使用:0次
4 . CO2在工业中有重要的用途,请回答:
I.用CrO3作催化剂,CO2重整乙烷(C2H6)制乙烯(C2H4)的反应过程如下:
①C2H6(g) C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;
②3H2(g)+2CrO3(s) =3H2O(g)+Cr2O3(s) ΔH2;
③Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3;
(1)反应C2H6(g)+CO2(g) C2H4(g)+CO(g)+H2O(g)的反应热ΔH=
C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)向2L的恒容密闭容器中充入0.1molC2H6(g)和0.1molCO2(g),发生(1)中反应,C2H6(g)的平衡转化率[a(C2H6)]与温度(T)的关系如图所示。

①在相应温度下,A点的反应速v(正)____ v(逆)(填“>”、“<”或“=”)。
②若不考虑副反应的发生,为提高α(C2H6),除了将生成物及时从体系中分离出来外,还可采取的措施有___________ (任写一种)。
Ⅱ.在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
(3)该反应为_________ 反应(填“吸热”、“放热”),原因为_________________ 。
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内v(H2)=________ ,转化率α(CO2)=___________ 。
I.用CrO3作催化剂,CO2重整乙烷(C2H6)制乙烯(C2H4)的反应过程如下:
①C2H6(g)
 C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;②3H2(g)+2CrO3(s) =3H2O(g)+Cr2O3(s) ΔH2;
③Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3;
(1)反应C2H6(g)+CO2(g)
 C2H4(g)+CO(g)+H2O(g)的反应热ΔH=
C2H4(g)+CO(g)+H2O(g)的反应热ΔH=(2)向2L的恒容密闭容器中充入0.1molC2H6(g)和0.1molCO2(g),发生(1)中反应,C2H6(g)的平衡转化率[a(C2H6)]与温度(T)的关系如图所示。

①在相应温度下,A点的反应速v(正)
②若不考虑副反应的发生,为提高α(C2H6),除了将生成物及时从体系中分离出来外,还可采取的措施有
Ⅱ.在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内v(H2)=
您最近一年使用:0次
2020-01-08更新
|
88次组卷
|
2卷引用:北京昌平区新学道临川学校2021-2022学年高二上学期期中考试化学试题
5 . 铝、氧化铝、氢氧化铝等在工业上用途广泛。
(1)用原子结构知识解释Al的金属性比Na弱:Al与Na在元素周期表中位于同一周期,_________________ ,Al的金属性比Na弱。
(2)结合化学用语,用化学平衡知识解释,氢氧化铝既溶于强酸溶液,又溶于强碱溶液:_______________________ 。
(3)Al2O3是制备二甲醚(CH3OCH3)的反应中的重要催化剂。
已知由H2、CO制备二甲醚过程为:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出由H2、CO制备二甲醚的总的热化学方程式____________ 。
工业上以铝土矿(主要成分是氧化铝,含氧化铁、氧化镁、二氧化硅、氧化铜等杂质)为原料提取铝、氧化铝、氢氧化铝的无机化工流程如图:

[ 已知:该条件下 NaOH 溶液与二氧化硅反应非常缓慢,在工业生产时不必考虑 ]
(4)固体A为________________________________ 。
(5)写出反应②的离子方程式为___________________________ 。
(6)反应④所得的铝材中,往往含有少量的铁和硅等杂质,可用电解精炼法进一步提纯,该电解池中阳极的电极反应式为__________________ ,下列可作阴极材料的是 ______
A.铝材 B.石墨 C.纯铝 D.铅板
(7)铝土矿中Al2O3的含量为40.8%,要使1t铝土矿中的Al2O3全部溶解理论上至少需要NaOH的质量为________ t。
(1)用原子结构知识解释Al的金属性比Na弱:Al与Na在元素周期表中位于同一周期,
(2)结合化学用语,用化学平衡知识解释,氢氧化铝既溶于强酸溶液,又溶于强碱溶液:
(3)Al2O3是制备二甲醚(CH3OCH3)的反应中的重要催化剂。
已知由H2、CO制备二甲醚过程为:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出由H2、CO制备二甲醚的总的热化学方程式
工业上以铝土矿(主要成分是氧化铝,含氧化铁、氧化镁、二氧化硅、氧化铜等杂质)为原料提取铝、氧化铝、氢氧化铝的无机化工流程如图:

(4)固体A为
(5)写出反应②的离子方程式为
(6)反应④所得的铝材中,往往含有少量的铁和硅等杂质,可用电解精炼法进一步提纯,该电解池中阳极的电极反应式为
A.铝材 B.石墨 C.纯铝 D.铅板
(7)铝土矿中Al2O3的含量为40.8%,要使1t铝土矿中的Al2O3全部溶解理论上至少需要NaOH的质量为
您最近一年使用:0次
14-15高二上·北京·期中
名校
6 . 金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g) W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:
(1)上述反应的化学平衡常数表达式为____________________ 。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为___________ ;随温度的升高,H2与水蒸气的体积比减小,则该反应为______ 反应(填“吸热”或“放热”)。
(3)用H2还原WO2也可得到金属钨。已知:
WO2 (s) + 2H2 (g) W (s) + 2H2O (g) ΔH =+66.0 kJ·mol–1
W (s) + 2H2O (g) ΔH =+66.0 kJ·mol–1
WO2 (g) + 2H2 (g) W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
则WO2 (s) WO2 (g) 的ΔH =
WO2 (g) 的ΔH = ______________________ 。
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) WI4 (g)。下列说法正确的有
WI4 (g)。下列说法正确的有________ (填序号)。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
WO3 (s) + 3H2 (g)
 W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)用H2还原WO2也可得到金属钨。已知:
WO2 (s) + 2H2 (g)
 W (s) + 2H2O (g) ΔH =+66.0 kJ·mol–1
W (s) + 2H2O (g) ΔH =+66.0 kJ·mol–1WO2 (g) + 2H2 (g)
 W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1则WO2 (s)
 WO2 (g) 的ΔH =
WO2 (g) 的ΔH = (4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)
 WI4 (g)。下列说法正确的有
WI4 (g)。下列说法正确的有a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
您最近一年使用:0次
2016-12-09更新
|
1425次组卷
|
4卷引用:2013-2014北京四中高二上学期期中考试化学试卷
(已下线)2013-2014北京四中高二上学期期中考试化学试卷2015-2016学年吉林长春第十一中高一下期末考化学四川省什邡中学2017-2018学年高二春秋招班第三次月考化学试题新疆伊犁州霍城县江苏中学2023-2024学年高二上学期9月月考化学试卷



