解题方法
1 . 全国农村应当在“绿色生态・美丽多彩・低碳节能・循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。试回答下列问题:
(1)碳的单质及其部分化合物是人类生产生活的主要能源物质。
①有机物M经过太阳光光照可转化成N,转化过程如图
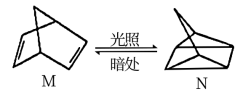
△H=+886kJ/mol,则M、N相比,较稳定的是___ 。
②将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s),△H=-1176kJ/mol,则反应过程中,每转移1mol电子放出的热量为___ 。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)⇌Fe(s)+CO2(g),△H>0。已知在1100℃时,该反应的平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__ (填“增大”、“减小”或“不变”)。
②1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应是否处于化学平衡状态?___ 。(填“是”或“否”),其判断依据是___ 。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),△H=-50.0kJ/mol。现向容积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
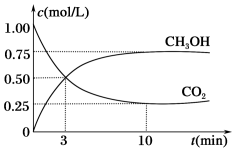
①该反应到达平衡后,H2的转化率α(H2)=____ 。
②下列措施能使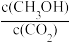 增大的是(填字母)
增大的是(填字母)___ 。
A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
③下列各项能作为判断该反应达到化学平衡状态依据的是___ (填字母)。
A.v正(CH3OH)=3v逆(H2)
B.平衡混合物中各组分的含量不再变化
C.CO2和H2的浓度比为1:2
D.混合气体的密度不再变化
(1)碳的单质及其部分化合物是人类生产生活的主要能源物质。
①有机物M经过太阳光光照可转化成N,转化过程如图

△H=+886kJ/mol,则M、N相比,较稳定的是
②将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s),△H=-1176kJ/mol,则反应过程中,每转移1mol电子放出的热量为
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)⇌Fe(s)+CO2(g),△H>0。已知在1100℃时,该反应的平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值
②1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应是否处于化学平衡状态?
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),△H=-50.0kJ/mol。现向容积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①该反应到达平衡后,H2的转化率α(H2)=
②下列措施能使
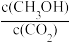 增大的是(填字母)
增大的是(填字母)A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
③下列各项能作为判断该反应达到化学平衡状态依据的是
A.v正(CH3OH)=3v逆(H2)
B.平衡混合物中各组分的含量不再变化
C.CO2和H2的浓度比为1:2
D.混合气体的密度不再变化
您最近一年使用:0次
名校
解题方法
2 . 科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____________________
(2)利用氧化氮氧化物的流程如下:
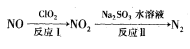
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_____ L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度_____ (填“增大”、“减小”或“不变”);请写出Na2SO3溶液中,c(Na+)、c(H2SO3)、c(SO32-)、c(HSO3-)的大小关系:_____ 。
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol•L﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入_____ ;为确保溶液中不出现浑浊,应调节溶液的pH不超过_____ 。(常温下,Ksp[Fe(OH) 2]=1.8×10﹣16)
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=
(2)利用氧化氮氧化物的流程如下:
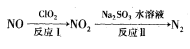
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol•L﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入
您最近一年使用:0次



