名校
解题方法
1 . 我国是世界上最早冶炼锌的国家之一,有独立的炼锌发展史。在现代工业中,锌在电池制造、合金生产等领域有着广泛的用途。
已知:锌的熔点420℃,沸点907℃。
Ⅰ.如图是古代以炉甘石(ZnCO3)为原料炼锌的示意图

i.

ii.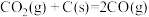

……
总反应:

(1)利用 和
和 计算
计算 时,还需要利用
时,还需要利用___________ 反应的 。
。
(2)c处收集到___________ (填“固”“液”或“气”)态金属锌。a和b两处小孔位于相反的位置,目的是___________ 。
(3)通过观察b处火焰可确定罐内反应状态。正常时,火焰应呈蓝色,燃烧的物质主要是___________ 。当火焰呈蓝绿色(Zn的焰色)时,可采取的措施是___________ 。
Ⅱ.现代炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2)为原料联合生产锌和高纯度二氧化锰的一种流程如下:
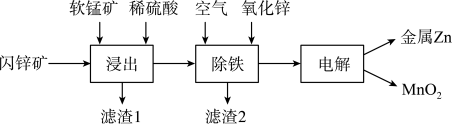
(4)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
i:
ii:……
①写出ii的离子方程式:___________ 。
②下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.___________ 。
(5)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是___________ 。
(6)电解:总反应(未配平): 。若不考虑副反应,为了使电解液中的Zn2+、Mn2+均恰好完全反应,理论上需要再添加哪种离子?
。若不考虑副反应,为了使电解液中的Zn2+、Mn2+均恰好完全反应,理论上需要再添加哪种离子?___________ 。(填“Zn2+”、“Mn2+”或“都不需要”)。
已知:锌的熔点420℃,沸点907℃。
Ⅰ.如图是古代以炉甘石(ZnCO3)为原料炼锌的示意图

i.


ii.
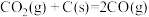

……
总反应:


(1)利用
 和
和 计算
计算 时,还需要利用
时,还需要利用 。
。(2)c处收集到
(3)通过观察b处火焰可确定罐内反应状态。正常时,火焰应呈蓝色,燃烧的物质主要是
Ⅱ.现代炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2)为原料联合生产锌和高纯度二氧化锰的一种流程如下:

(4)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
i:

ii:……
①写出ii的离子方程式:
②下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.
(5)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是
(6)电解:总反应(未配平):
 。若不考虑副反应,为了使电解液中的Zn2+、Mn2+均恰好完全反应,理论上需要再添加哪种离子?
。若不考虑副反应,为了使电解液中的Zn2+、Mn2+均恰好完全反应,理论上需要再添加哪种离子?
您最近一年使用:0次
名校
解题方法
2 . 合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
 kJ·mol
kJ·mol

 kJ·mol
kJ·mol


(1)
_______ kJ·mol-1(用含a、b的代数式表示)
(2)目前工业合成氨的主要方法是HaberBosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是_______ 。
②理论上,为了增大平衡时 的转化率,可采取的措施是
的转化率,可采取的措施是_______ (写出1条)。
③将物质的量之比为1∶3的 和
和 充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下 的转化率为
的转化率为_______ ,平衡常数
_______ (可用分数表示)。
④若按以下浓度投料,其它反应条件与③相同,起始时反应进行的方向为_______ (填“正向”、“逆向”或“无法判断”)。
(3)图1是某压强下 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是_______ 。
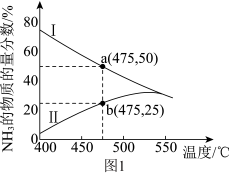
a.图中a点,容器内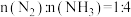
b.图中b点,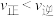
c.400~530℃,II中 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
(4)电化学气敏传感器可用于检测环境中 的含量,其工作原理如图2所示。
的含量,其工作原理如图2所示。

①反应消耗的 与
与 的物质的量之比为
的物质的量之比为_______ 。
②a极的电极反应式为_______ 。
已知:

 kJ·mol
kJ·mol

 kJ·mol
kJ·mol


(1)

(2)目前工业合成氨的主要方法是HaberBosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度,原因是
②理论上,为了增大平衡时
 的转化率,可采取的措施是
的转化率,可采取的措施是③将物质的量之比为1∶3的
 和
和 充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
充入2 L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:| 物质 |  |  |  |
平衡时物质的量 | 0.2 | 0.6 | 0.2 |
 的转化率为
的转化率为
④若按以下浓度投料,其它反应条件与③相同,起始时反应进行的方向为
| 物质 |  |  |  |
起始浓度(mol·L ) ) | 0.5 | 1.5 | 0.5 |
 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。I是平衡时的曲线,II是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
a.图中a点,容器内
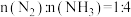
b.图中b点,
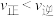
c.400~530℃,II中
 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大(4)电化学气敏传感器可用于检测环境中
 的含量,其工作原理如图2所示。
的含量,其工作原理如图2所示。
①反应消耗的
 与
与 的物质的量之比为
的物质的量之比为②a极的电极反应式为
您最近一年使用:0次
3 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)与H2-O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如下图所示:
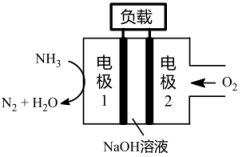
①电极1为_______ (填“正极”或“负极”),电极2的反应式为_______ 。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:i.2H2(g)+O2(g)=2H2O(g) ΔH1
ii.N2(g)+3H2(g)⇌2NH3(g) ΔH2
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=_______ 。
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是_______ 。
(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是_______ 。。
②列举一条既能提高速率又能提高原料转化率的措施_______ 。
(3)常温常压下电解法合成氨的原理如下图所示:
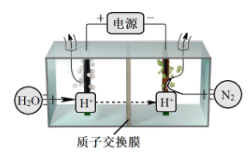
①阳极产生的气体是_______ 。
②阴极生成氨的电极反应式为_______ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式_______ 。
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有_______ 性。
(1)与H2-O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如下图所示:

①电极1为
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:i.2H2(g)+O2(g)=2H2O(g) ΔH1
ii.N2(g)+3H2(g)⇌2NH3(g) ΔH2
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是
(2)氨的合成是当前的研究热点,目前最主要的方法是Haber-Bosch法:通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
①该反应放热,但仍选择较高温度。其原因是
②列举一条既能提高速率又能提高原料转化率的措施
(3)常温常压下电解法合成氨的原理如下图所示:

①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
④为了尽可能避免副反应的发生,采用的方法是改进阴极表面的催化剂,这样设计是利用了催化剂具有
您最近一年使用:0次
2021-01-22更新
|
257次组卷
|
2卷引用:北京市丰台区2020-2021学年高二上学期期末考试化学试题
4 . CO2在工业中有重要的用途,请回答:
I.用CrO3作催化剂,CO2重整乙烷(C2H6)制乙烯(C2H4)的反应过程如下:
①C2H6(g) C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;
②3H2(g)+2CrO3(s) =3H2O(g)+Cr2O3(s) ΔH2;
③Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3;
(1)反应C2H6(g)+CO2(g) C2H4(g)+CO(g)+H2O(g)的反应热ΔH=
C2H4(g)+CO(g)+H2O(g)的反应热ΔH=____________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)向2L的恒容密闭容器中充入0.1molC2H6(g)和0.1molCO2(g),发生(1)中反应,C2H6(g)的平衡转化率[a(C2H6)]与温度(T)的关系如图所示。

①在相应温度下,A点的反应速v(正)____ v(逆)(填“>”、“<”或“=”)。
②若不考虑副反应的发生,为提高α(C2H6),除了将生成物及时从体系中分离出来外,还可采取的措施有___________ (任写一种)。
Ⅱ.在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
(3)该反应为_________ 反应(填“吸热”、“放热”),原因为_________________ 。
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内v(H2)=________ ,转化率α(CO2)=___________ 。
I.用CrO3作催化剂,CO2重整乙烷(C2H6)制乙烯(C2H4)的反应过程如下:
①C2H6(g)
 C2H4(g)+H2(g) ΔH1;
C2H4(g)+H2(g) ΔH1;②3H2(g)+2CrO3(s) =3H2O(g)+Cr2O3(s) ΔH2;
③Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) ΔH3;
(1)反应C2H6(g)+CO2(g)
 C2H4(g)+CO(g)+H2O(g)的反应热ΔH=
C2H4(g)+CO(g)+H2O(g)的反应热ΔH=(2)向2L的恒容密闭容器中充入0.1molC2H6(g)和0.1molCO2(g),发生(1)中反应,C2H6(g)的平衡转化率[a(C2H6)]与温度(T)的关系如图所示。

①在相应温度下,A点的反应速v(正)
②若不考虑副反应的发生,为提高α(C2H6),除了将生成物及时从体系中分离出来外,还可采取的措施有
Ⅱ.在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示。| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内v(H2)=
您最近一年使用:0次
2020-01-08更新
|
88次组卷
|
2卷引用:北京市昌平区新学道临川学校2019-2020学年高二上学期期末考试化学试题
5 . CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的分子结构决定了其性质和用途。
①CO2的电子式是_____ ,所含化学键类型为______ 共价键(填“非极性”或“极性”)。
②在温度高于31.26 ℃、压强高于7.29×106Pa时,CO2处于超临界状态,称为超临界CO2流体,它可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,用超临界CO2萃取的优点有:_____ (答出一点即可)。
(2)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。

上图中CO2转化为CO的反应为:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol
已知:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H=-128kJ/mol
①则图中CO转化为C2H4的热化学方程式是__________ 。
②按系统命名法,图中X的名称是__________ 。
③关于X与Y的说法正确的是__________ (填序号〕。
a.实验式相同 b.都有4种一氯代物 c.都易使酸性KMnO4溶液褪色
④催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在 60 ℃下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是_________ 。
(1)CO2的分子结构决定了其性质和用途。
①CO2的电子式是
②在温度高于31.26 ℃、压强高于7.29×106Pa时,CO2处于超临界状态,称为超临界CO2流体,它可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,用超临界CO2萃取的优点有:
(2)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。

上图中CO2转化为CO的反应为:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol
已知:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H=-128kJ/mol
①则图中CO转化为C2H4的热化学方程式是
②按系统命名法,图中X的名称是
③关于X与Y的说法正确的是
a.实验式相同 b.都有4种一氯代物 c.都易使酸性KMnO4溶液褪色
④催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在 60 ℃下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是
您最近一年使用:0次
2019-01-22更新
|
269次组卷
|
2卷引用:【区级联考】北京市东城区2019届高三第一学期期末教学统一检测化学试题
6 . 天然气是一种清洁能源,用途广泛。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:_______ 。
②有利于提高混合气中CH4含量的措施是:_______ 。
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。
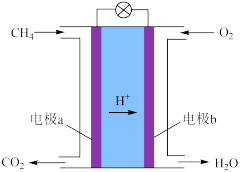
①电极b是_______ 极(填“正”或“负”)。
②a极的电极反应式是_______________ 。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:
②有利于提高混合气中CH4含量的措施是:
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。

①电极b是
②a极的电极反应式是
您最近一年使用:0次
13-14高三上·北京朝阳·期末
7 . 天然气(以甲烷计)在工业生产中用途广泛。
(1)Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸气转化法制H2的主要转化反应如下:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)ΔH=+206.2kJ/mol
CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)ΔH=+165.0kJ/mol
上述反应所得原料气中的CO能使合成氨催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是_______ 。
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如图所示:
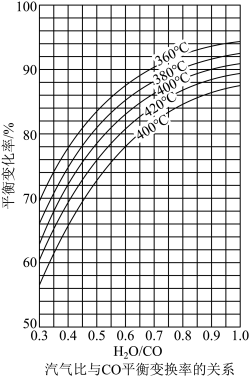
析图可知:
①相同温度时,CO平衡变换率与汽气比的关系是_______ 。
②汽气比相同时,CO平衡变换率与温度的关系是_______ 。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为Kp=_______ 。随温度的降低,该平衡常数_______ (填“增大”“减小”或“不变”)。
(4)Ⅱ.在熔融碳酸盐燃料电池中的应用以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如图:

①外电路电子流动方向:由_______ 流向_______ (填字母)。
②空气极发生反应的离子方程式是_______ 。
③以此燃料电池为电源电解精炼铜,当电路有0.6 mol e-转移,有_______ g 精铜析出。
(1)Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸气转化法制H2的主要转化反应如下:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)ΔH=+206.2kJ/mol
CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)ΔH=+165.0kJ/mol
上述反应所得原料气中的CO能使合成氨催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如图所示:

析图可知:
①相同温度时,CO平衡变换率与汽气比的关系是
②汽气比相同时,CO平衡变换率与温度的关系是
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为Kp=
(4)Ⅱ.在熔融碳酸盐燃料电池中的应用以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如图:

①外电路电子流动方向:由
②空气极发生反应的离子方程式是
③以此燃料电池为电源电解精炼铜,当电路有0.6 mol e-转移,有
您最近一年使用:0次



