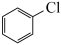
1 . 氯苯是工业废水中的常见污染物,将其降解或资源化转化在能源利用、环境保护等方面意义重大。通常,废水中氯苯的处理过程为:

资料:25℃、101kPa时,氯苯、邻苯二酚燃烧反应的热化学方程式如下:
 (l)
(l)
 (s)
(s)
(1)25℃、101kPa时,在催化剂作用下,氯苯与 、
、 反应生成邻苯二酚和
反应生成邻苯二酚和 的热化学方程式为
的热化学方程式为___________ 。
(2)可用于检验转化ii后是否有邻苯二酚剩余的试剂为___________ 。
(3)传统处理工艺常用空气将废水中的氯苯吹出,所得空气、氯苯的混合气体通过催化剂表面完成转化i,所得产物在实验条件下均为气态。其他条件不变时,增大通入废水的空气流速,废水中氯苯去除率提高;但i中氯苯的转化率降低。氯苯转化率降低的可能原因是___________ (填字母)。
a.单位时间内通过催化剂表面的混合气体变少
b.混合气体在催化剂表面反应的时间变短
c.i中转化反应的化学平衡常数变小
(4)我国科研人员开发了一种电化学装置(如图),可在更温和的条件下实现转化i、ii。
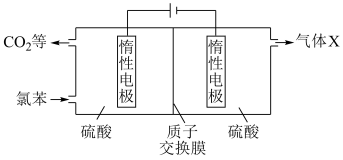
①阳极区发生的电极反应为:___________ 。(补充不完整的反应)

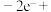 □___________=
□___________= +□___________+□___________
+□___________+□___________


②资料:电解效率
一定时间内,阴极共得到44.8L气体X(标准状况), 。若阳极区
。若阳极区 (
( )=5%,所有邻苯二酚完全转化为
)=5%,所有邻苯二酚完全转化为 ,则
,则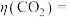
___________ 。
③一段时间后,阴极区溶液pH保持不变,结合化学用语解释其原因:___________ 。

资料:25℃、101kPa时,氯苯、邻苯二酚燃烧反应的热化学方程式如下:
 (l)
(l)
 (s)
(s)
(1)25℃、101kPa时,在催化剂作用下,氯苯与
 、
、 反应生成邻苯二酚和
反应生成邻苯二酚和 的热化学方程式为
的热化学方程式为(2)可用于检验转化ii后是否有邻苯二酚剩余的试剂为
(3)传统处理工艺常用空气将废水中的氯苯吹出,所得空气、氯苯的混合气体通过催化剂表面完成转化i,所得产物在实验条件下均为气态。其他条件不变时,增大通入废水的空气流速,废水中氯苯去除率提高;但i中氯苯的转化率降低。氯苯转化率降低的可能原因是
a.单位时间内通过催化剂表面的混合气体变少
b.混合气体在催化剂表面反应的时间变短
c.i中转化反应的化学平衡常数变小
(4)我国科研人员开发了一种电化学装置(如图),可在更温和的条件下实现转化i、ii。

①阳极区发生的电极反应为:

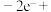 □___________=
□___________= +□___________+□___________
+□___________+□___________

②资料:电解效率

一定时间内,阴极共得到44.8L气体X(标准状况),
 。若阳极区
。若阳极区 (
( )=5%,所有邻苯二酚完全转化为
)=5%,所有邻苯二酚完全转化为 ,则
,则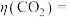
③一段时间后,阴极区溶液pH保持不变,结合化学用语解释其原因:
您最近半年使用:0次
名校
解题方法
2 .  与ICl的反应机理如下:
与ICl的反应机理如下:
反应①: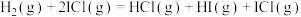 ;
;
反应②: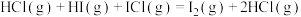 ,
,
其能量曲线如下图所示。不正确 的是
 与ICl的反应机理如下:
与ICl的反应机理如下:反应①:
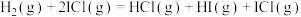 ;
;反应②:
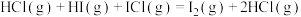 ,
,其能量曲线如下图所示。

A.反应①的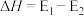 |
| B.反应①②均是放热反应 |
C. 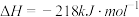 |
| D.该反应的反应速率主要取决于②的快慢 |
您最近半年使用:0次
2024-01-20更新
|
181次组卷
|
3卷引用:北京市顺义区2023-2024学年高二上学期期末质量监测化学试题
解题方法
3 . 甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇(CH3OH)。
(1)已知一定条件下,发生反应: ,
,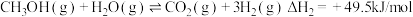 ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是________ 。
(2)在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。
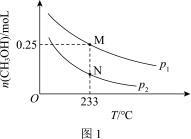
①p1____ p2(填“<”或“>”)。
②M点对应的平衡混合气体的体积为1 L,则233 ℃时,该反应的平衡常数K=_______ ,H2的转化率为______ (保留1位小数)。
③下列叙述能说明上述反应在p1条件下达到化学平衡状态的是_______ (填字母)。
a.单位时间内消耗1 mol CO的同时生成1 mol CH3OH
b.CH3OH的体积分数不再改变
c.密闭容器的体积不再改变
(3)工业上可利用甲醇羰基化法进一步制取甲酸甲酯: 。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
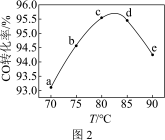
①b、c、d三点中,尚未达到化学平衡状态的点是________ 。
②该反应是_______ (填“放热”或“吸热”)反应。
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由:________ 。
(1)已知一定条件下,发生反应:
 ,
,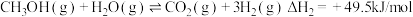 ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是(2)在体积可变的恒压密闭容器中投入0.5 mol CO和0.75 mol H2,不同条件下发生上述反应。实验测得平衡时CH3OH的物质的量(n)随温度(T)、压强(p)的变化如图1所示。

①p1
②M点对应的平衡混合气体的体积为1 L,则233 ℃时,该反应的平衡常数K=
③下列叙述能说明上述反应在p1条件下达到化学平衡状态的是
a.单位时间内消耗1 mol CO的同时生成1 mol CH3OH
b.CH3OH的体积分数不再改变
c.密闭容器的体积不再改变
(3)工业上可利用甲醇羰基化法进一步制取甲酸甲酯:
 。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
。在容积不变的密闭容器中,投入等物质的量的CH3OH和CO,相同时间内CO的转化率随温度变化如图2所示(不考虑其他副反应)。
①b、c、d三点中,尚未达到化学平衡状态的点是
②该反应是
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由:
您最近半年使用:0次
名校
解题方法
4 . 下列说法正确的是
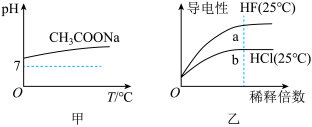



| A.由图甲可知,升高温度醋酸钠的水解程度减小 |
| B.由图乙可知,a点Kw的数值比b点Kw的数值大 |
| C.由图丙可知,反应A(g)+B(g)=2C(g)是吸热反应 |
| D.由图丁可知,反应C(金刚石,s)=C(石墨,s)的焓变ΔH=ΔH2-ΔH1 |
您最近半年使用:0次
名校
解题方法
5 . 我国科学家研发的“液态阳光”计划通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢制备甲醇。制备甲醇过程中主要存在以下反应:
主反应ⅰ:
(1)请结合反应: ,写出一个生成
,写出一个生成 的副反应ⅱ的热化学方程式:
的副反应ⅱ的热化学方程式:_______ 。
(2)将 和
和 按物质的量比
按物质的量比 混合,以固定流速通过盛放
混合,以固定流速通过盛放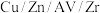 催化剂的反应器,在相同时间内,其中
催化剂的反应器,在相同时间内,其中 的平衡转化率
的平衡转化率 的选择性
的选择性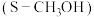 随温度、压强变化如图所示:
随温度、压强变化如图所示:

已知: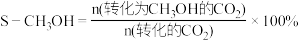
①请判断 的大小关系:
的大小关系:
_______  (填“>”或“<”)。
(填“>”或“<”)。
② 左右,体系发生的反应主要是
左右,体系发生的反应主要是_______ (填“i”或“ii”)。
③若只发生主反应ⅰ和副反应ⅱ,平衡时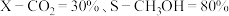 ,则
,则 的转化率为
的转化率为_______  。
。
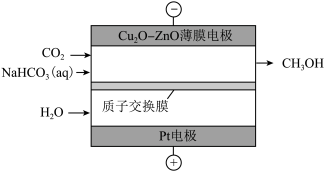
(3)使用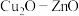 薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。
薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。
①将铜箔放入煮沸的饱和硫酸铜溶液中,制得 薄膜电极。反应的离子方程式为
薄膜电极。反应的离子方程式为_______ 。
②用 薄膜电极作阴极,
薄膜电极作阴极,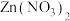 溶液作电解液,采用电沉积法制备
溶液作电解液,采用电沉积法制备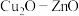 薄膜电极,制备完成后电解液中检测到了
薄膜电极,制备完成后电解液中检测到了 。制备
。制备 薄膜的电极反应式为
薄膜的电极反应式为_______ 。
③电催化法制备甲醇如图所示。若忽略电解液体积变化,电解过程中阴极室溶液的 基本不变,结合电极反应解释原因:
基本不变,结合电极反应解释原因:_______ 。
主反应ⅰ:

(1)请结合反应:
 ,写出一个生成
,写出一个生成 的副反应ⅱ的热化学方程式:
的副反应ⅱ的热化学方程式:(2)将
 和
和 按物质的量比
按物质的量比 混合,以固定流速通过盛放
混合,以固定流速通过盛放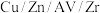 催化剂的反应器,在相同时间内,其中
催化剂的反应器,在相同时间内,其中 的平衡转化率
的平衡转化率 的选择性
的选择性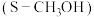 随温度、压强变化如图所示:
随温度、压强变化如图所示:
已知:
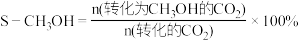
①请判断
 的大小关系:
的大小关系:
 (填“>”或“<”)。
(填“>”或“<”)。②
 左右,体系发生的反应主要是
左右,体系发生的反应主要是③若只发生主反应ⅰ和副反应ⅱ,平衡时
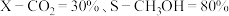 ,则
,则 的转化率为
的转化率为 。
。(3)使用
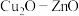 薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。
薄膜电极作阴极,通过电催化法可以将二氧化碳转化为甲醇。①将铜箔放入煮沸的饱和硫酸铜溶液中,制得
 薄膜电极。反应的离子方程式为
薄膜电极。反应的离子方程式为②用
 薄膜电极作阴极,
薄膜电极作阴极,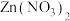 溶液作电解液,采用电沉积法制备
溶液作电解液,采用电沉积法制备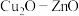 薄膜电极,制备完成后电解液中检测到了
薄膜电极,制备完成后电解液中检测到了 。制备
。制备 薄膜的电极反应式为
薄膜的电极反应式为③电催化法制备甲醇如图所示。若忽略电解液体积变化,电解过程中阴极室溶液的
 基本不变,结合电极反应解释原因:
基本不变,结合电极反应解释原因:
您最近半年使用:0次
名校
6 . 载人航天工程对科学研究及太空资源开发具有重要意义,载人航天器必须给航天员提供基本的生存条件,其中涉及氧气再生、二氧化碳清除、水处理以及食物供给等。
(1)氢氧燃料电池是短寿命载人航天器电源的一个合适的选择。下图是一种碱性氢氧燃料电池结构示意图。
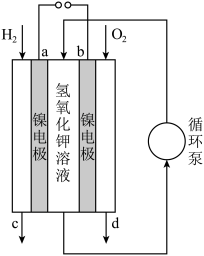
①电池的正极是___________ (填“a”或“b”),该电极上发生的电极反应是___________ 。
②电池工作时产生的水会以水蒸气的形式被反应物气体带出,在出口加装冷凝器可以将水回收。冷凝器应装在出口___________ (填“c”或“d”)处。
③电池工作时,电解质溶液会因稀释及吸收 而变质,此时电解质溶液的
而变质,此时电解质溶液的 将
将___________ (填“升高”或“降低”)。通过循环泵可及时浓缩或更换变质的溶液,维特电池的正常工作。
(2)我国自行研制的“神舟”飞船使用了镍镉蓄电池组,其充放电时发生的反应为: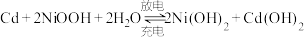 ,其电池装置如图所示,阴离子交换膜两侧均注入
,其电池装置如图所示,阴离子交换膜两侧均注入 溶液。
溶液。
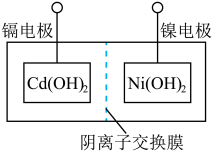
①下列对于该镍镉电池的分析中,正确的是___________ 。
A.图示中的电池应先充电后,再使用
B.充电时, 从镍电极区迁移进入镉电极区
从镍电极区迁移进入镉电极区
C.放电时,镍电极为电池的负极,镉电极为电池的正极
D.充电或放电一段时间后,两电极区溶液中 的物质的量均未改变
的物质的量均未改变
②镍镉电池在充电时,镉电极上发生的电极反应为___________ ;当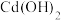 和
和 耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体
耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体___________ (填化学式);镍电极上则会发生反应___________ (填电极反应式)而产生 。
。
(3)载人航天器中氧气的再生是一个重要环节。利用萨巴蒂尔反应可将人呼出的二氧化碳转化为甲烷和水,配合太阳能电解水可以实现氧气的再生(大体流程如下图)。
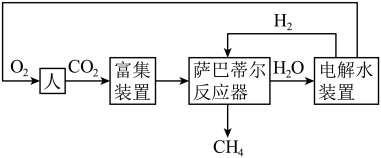
已知: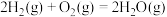

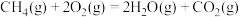
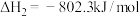
萨巴蒂尔反应: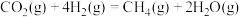

①萨巴蒂尔反应的焓变
___________ 。
②电解水装置中 产生于
产生于___________ (填“正”、“负”、“阴”或“阳”)极。
③通过巴萨尔反应器和电解水装置能否实现H2与 的完全再生?
的完全再生?___________ (填“能”或“否”)
(1)氢氧燃料电池是短寿命载人航天器电源的一个合适的选择。下图是一种碱性氢氧燃料电池结构示意图。

①电池的正极是
②电池工作时产生的水会以水蒸气的形式被反应物气体带出,在出口加装冷凝器可以将水回收。冷凝器应装在出口
③电池工作时,电解质溶液会因稀释及吸收
 而变质,此时电解质溶液的
而变质,此时电解质溶液的 将
将(2)我国自行研制的“神舟”飞船使用了镍镉蓄电池组,其充放电时发生的反应为:
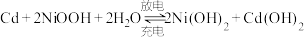 ,其电池装置如图所示,阴离子交换膜两侧均注入
,其电池装置如图所示,阴离子交换膜两侧均注入 溶液。
溶液。
①下列对于该镍镉电池的分析中,正确的是
A.图示中的电池应先充电后,再使用
B.充电时,
 从镍电极区迁移进入镉电极区
从镍电极区迁移进入镉电极区C.放电时,镍电极为电池的负极,镉电极为电池的正极
D.充电或放电一段时间后,两电极区溶液中
 的物质的量均未改变
的物质的量均未改变②镍镉电池在充电时,镉电极上发生的电极反应为
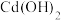 和
和 耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体
耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体 。
。(3)载人航天器中氧气的再生是一个重要环节。利用萨巴蒂尔反应可将人呼出的二氧化碳转化为甲烷和水,配合太阳能电解水可以实现氧气的再生(大体流程如下图)。

已知:
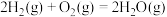

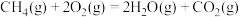
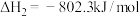
萨巴蒂尔反应:
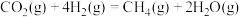

①萨巴蒂尔反应的焓变

②电解水装置中
 产生于
产生于③通过巴萨尔反应器和电解水装置能否实现H2与
 的完全再生?
的完全再生?
您最近半年使用:0次
名校
7 . 二甲醚( )是重要的化工原料,可用水煤气(主要成分为CO和
)是重要的化工原料,可用水煤气(主要成分为CO和 )合成。其主要反应原理如下(a、b、c均为正值):
)合成。其主要反应原理如下(a、b、c均为正值):
①
 kJ⋅mol
kJ⋅mol
②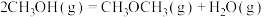
 kJ·mol
kJ·mol
③
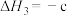 kJ⋅mol
kJ⋅mol
回答下列问题:
(1)总反应的热化学方程式: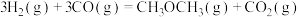

_______ kJ/mol。
(2)以下说法能说明反应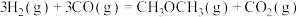 达到化学平衡状态的有
达到化学平衡状态的有_______ 。
a.恒温恒容条件下,气体的密度保持不变
b.恒温恒压条件下,气体的平均摩尔质量保持不变
c.绝热体系中,体系的温度保持不变
(3)生产二甲醚的过程中存在副反应: ,与甲醇脱水反应:
,与甲醇脱水反应: 形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
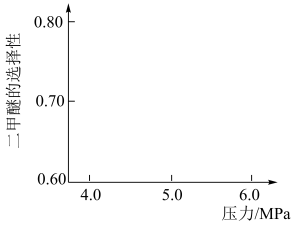
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
分析:温度一定,随压强增大,二甲醚选择性增大的原因是_______ 。
 )是重要的化工原料,可用水煤气(主要成分为CO和
)是重要的化工原料,可用水煤气(主要成分为CO和 )合成。其主要反应原理如下(a、b、c均为正值):
)合成。其主要反应原理如下(a、b、c均为正值):①

 kJ⋅mol
kJ⋅mol
②
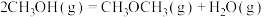
 kJ·mol
kJ·mol
③

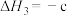 kJ⋅mol
kJ⋅mol
回答下列问题:
(1)总反应的热化学方程式:
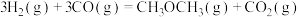

(2)以下说法能说明反应
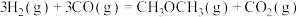 达到化学平衡状态的有
达到化学平衡状态的有a.恒温恒容条件下,气体的密度保持不变
b.恒温恒压条件下,气体的平均摩尔质量保持不变
c.绝热体系中,体系的温度保持不变
(3)生产二甲醚的过程中存在副反应:
 ,与甲醇脱水反应:
,与甲醇脱水反应: 形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
分析:温度一定,随压强增大,二甲醚选择性增大的原因是
您最近半年使用:0次
名校
8 . 中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=﹣49.4kJ/mol
CH3OH(g)+H2O(g) ΔH1=﹣49.4kJ/mol
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
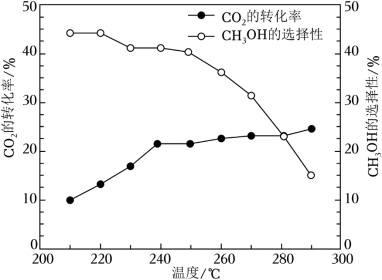
其他条件不变时,在相同时间内温度对CO2催化加氢的影响如图。下列说法不正确的是
【注】CH3OH的选择性= ×100%
×100%
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=﹣49.4kJ/mol
CH3OH(g)+H2O(g) ΔH1=﹣49.4kJ/mol②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol其他条件不变时,在相同时间内温度对CO2催化加氢的影响如图。下列说法不正确的是
【注】CH3OH的选择性=
 ×100%
×100%
A.CO(g)+2H2(g) CH3OH(g) ΔH=﹣90.6kJ/mol CH3OH(g) ΔH=﹣90.6kJ/mol |
| B.使用催化剂,能降低反应的活化能,增大活化分子百分数 |
| C.其他条件不变,增大压强,有利于反应向生成CH3OH的方向进行 |
| D.0~240℃,升高温度,对反应②速率的影响比对反应①的小 |
您最近半年使用:0次
名校
9 . 羟基自由基(·OH,电中性)是一种活性含氧粒子。常温下,利用·OH 处理含苯酚(C6H6O)废水, 可将其转化为无毒的氧化物。
(1)·OH 中氧元素的化合价为___________ 。
(2)pH=3时Fe2+催化H2O2的分解过程中产生·OH中间体,催化循环反应如下。将ii补充完整。
i.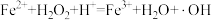
ii. ,
,__________________ 。
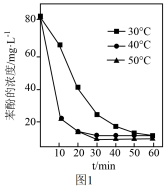
(3)已知:羟基自由基容易发生猝灭2·OH=H2O2。用H2O2分解产生的·OH脱除苯酚,当其他条件不变时,不同温度下,苯酚的浓度随时间的变化如图1所示。0~20min 时, 温度从40℃上升到50℃,反应速率基本不变的原因是___________ 。
(4)利用电化学高级氧化技术可以在电解槽中持续产生·OH,使处理含苯酚废水更加高效,装置如图2所示。已知 a 极主要发生的反应是(O2生成H2O2,然后在电解液中产生·OH,并迅速与苯酚(C6H6O)反应。

①b极连接电源的___________ 极。
②a极的电极反应式为___________ 。
③电解液中发生的主要反应的方程式是___________ 、___________ 。
(1)·OH 中氧元素的化合价为
(2)pH=3时Fe2+催化H2O2的分解过程中产生·OH中间体,催化循环反应如下。将ii补充完整。
i.
ii.
 ,
,(3)已知:羟基自由基容易发生猝灭2·OH=H2O2。用H2O2分解产生的·OH脱除苯酚,当其他条件不变时,不同温度下,苯酚的浓度随时间的变化如图1所示。0~20min 时, 温度从40℃上升到50℃,反应速率基本不变的原因是

(4)利用电化学高级氧化技术可以在电解槽中持续产生·OH,使处理含苯酚废水更加高效,装置如图2所示。已知 a 极主要发生的反应是(O2生成H2O2,然后在电解液中产生·OH,并迅速与苯酚(C6H6O)反应。

①b极连接电源的
②a极的电极反应式为
③电解液中发生的主要反应的方程式是
您最近半年使用:0次
名校
10 . 氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生 ,做出
,做出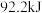 热量。
热量。
①该可逆反应,若起始时向容器内放入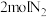 和
和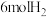 ,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)
,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)___________ 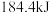 。
。
②在图中画出合成氨反应过程中焓(H)的变化示意图___________ 。
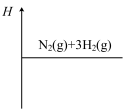
③已知:
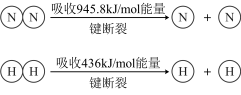
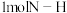 键断裂吸收的能量约等于
键断裂吸收的能量约等于___________ kJ。
(2)二甲醚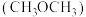 是重要的化工原料,可用
是重要的化工原料,可用 和
和 制得,总反应的热化学方程式如下:
制得,总反应的热化学方程式如下:
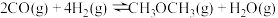
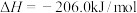
此反应工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行来完成:
i甲醇合成反应:___________ (请补全)
ii甲醇脱水反应: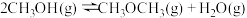 ,
,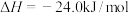
生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争: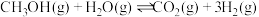 ;
;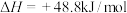
将反应物混合气按进料比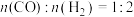 通入反应装置,选择合适的催化剂。
通入反应装置,选择合适的催化剂。
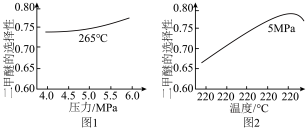
在不同温度和压强下,测得二甲醚的选择性分别如图1、图2所示。
资料:二甲醚的选择性是指转化为二甲醚的 在全部
在全部 反应物中所占的比例。
反应物中所占的比例。
①图1中,温度一定,压强增大,二甲醚选择性增大的原因是___________ 。
②图2中,温度高于265℃后,二甲醚选择性降低的原因有___________ 。
(1)合成氨工业中,合成塔中每产生
 ,做出
,做出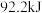 热量。
热量。①该可逆反应,若起始时向容器内放入
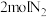 和
和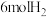 ,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)
,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)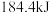 。
。②在图中画出合成氨反应过程中焓(H)的变化示意图

③已知:

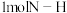 键断裂吸收的能量约等于
键断裂吸收的能量约等于(2)二甲醚
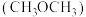 是重要的化工原料,可用
是重要的化工原料,可用 和
和 制得,总反应的热化学方程式如下:
制得,总反应的热化学方程式如下: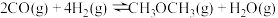
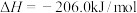
此反应工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行来完成:
i甲醇合成反应:
ii甲醇脱水反应:
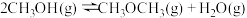 ,
,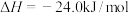
生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争:
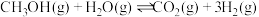 ;
;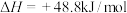
将反应物混合气按进料比
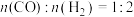 通入反应装置,选择合适的催化剂。
通入反应装置,选择合适的催化剂。在不同温度和压强下,测得二甲醚的选择性分别如图1、图2所示。

资料:二甲醚的选择性是指转化为二甲醚的
 在全部
在全部 反应物中所占的比例。
反应物中所占的比例。①图1中,温度一定,压强增大,二甲醚选择性增大的原因是
②图2中,温度高于265℃后,二甲醚选择性降低的原因有
您最近半年使用:0次
2024-01-08更新
|
83次组卷
|
2卷引用:北京市育才学校2023-2024学年高一上学期化学期中试题



