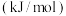1 .  与
与 能发生反应:
能发生反应: 。
。
已知:①该反应由两个基元反应分步完成,第一步为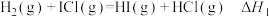
②两步反应的活化能分别为 、
、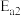 ,且
,且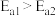
下列判断不正确 的是
 与
与 能发生反应:
能发生反应: 。
。已知:①该反应由两个基元反应分步完成,第一步为
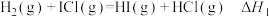
②两步反应的活化能分别为
 、
、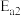 ,且
,且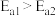
下列判断
| A.第一步为非氧化还原反应 |
| B.第一步的化学反应速率小于第二步的化学反应速率 |
C.已知键能: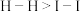 ,可推知键能: ,可推知键能: |
D.第二步的热化学方程式为 |
您最近半年使用:0次
名校
2 . 已知Fe2O2(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+
CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+ O2(g)=Fe2O3(s)的△H是
O2(g)=Fe2O3(s)的△H是
 C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+
CO2(g)+2Fe(s) △H=+234.1kJ·mol-1,C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,则2Fe(s)+ O2(g)=Fe2O3(s)的△H是
O2(g)=Fe2O3(s)的△H是| A.-824.4kJ·mol-1 | B.-627.6kJ·mol-1 |
| C.-744.7kJ·mol-1 | D.-169.4kJ·mol-1 |
您最近半年使用:0次
2024-03-18更新
|
355次组卷
|
4卷引用:北京市中国人民大学附属中学2023-2024学年高一下学期期中考试化学试题
3 . 我国力争于2030年前完成碳达峰,2060年前实现碳中和。 含量的控制和
含量的控制和 资源利用具有重要的研究价值和现实意义。
资源利用具有重要的研究价值和现实意义。
(1)燃煤烟气中的 捕集可通过如下所示的物质转化实现。
捕集可通过如下所示的物质转化实现。
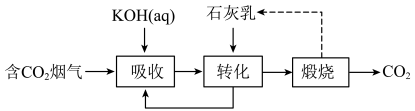
写出
充分 吸收 的化学方程式为
的化学方程式为________________ 。
(2)合成尿素 是利用
是利用 的途径之一。通过两步反应实现,其能量变化示意图所示:
的途径之一。通过两步反应实现,其能量变化示意图所示:
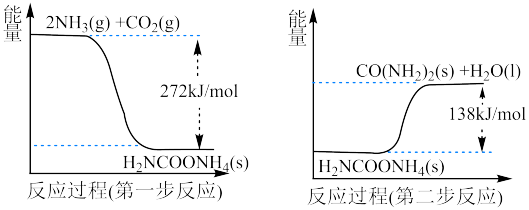
① 与
与 反应生成尿素的热化学方程式为
反应生成尿素的热化学方程式为________________ 。
②工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有________ .(填序号)
a.升高温度 b.加入催化剂
c.将尿素及时分离出去 d.增大反应体系的压强
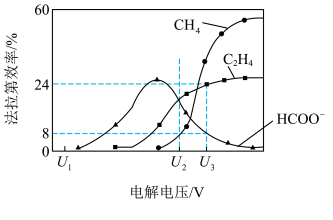
(3)用 充分吸收
充分吸收 后,将溶液进行电解,可实现
后,将溶液进行电解,可实现 转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的
转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率 (FE%)随电解电压的变化如图所示。
已知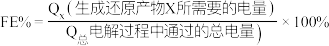
其中,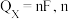 表示电解生成还原产物
表示电解生成还原产物 所转移电子的物质的量,
所转移电子的物质的量, 表示法拉第常数。
表示法拉第常数。
①当电解电压为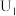 时,电解过程中含碳还原产物的
时,电解过程中含碳还原产物的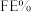 为0,阴极主要还原产物为
为0,阴极主要还原产物为________ (填化学式)。
②当电解电压为 时,阴极生成
时,阴极生成 的电极反应式为
的电极反应式为________________ .
③当电解电压为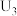 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为________ .
 含量的控制和
含量的控制和 资源利用具有重要的研究价值和现实意义。
资源利用具有重要的研究价值和现实意义。(1)燃煤烟气中的
 捕集可通过如下所示的物质转化实现。
捕集可通过如下所示的物质转化实现。
写出

 的化学方程式为
的化学方程式为(2)合成尿素
 是利用
是利用 的途径之一。通过两步反应实现,其能量变化示意图所示:
的途径之一。通过两步反应实现,其能量变化示意图所示:
①
 与
与 反应生成尿素的热化学方程式为
反应生成尿素的热化学方程式为②工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有
a.升高温度 b.加入催化剂
c.将尿素及时分离出去 d.增大反应体系的压强
(3)用
 充分吸收
充分吸收 后,将溶液进行电解,可实现
后,将溶液进行电解,可实现 转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的
转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的
已知
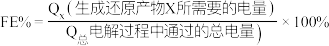
其中,
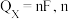 表示电解生成还原产物
表示电解生成还原产物 所转移电子的物质的量,
所转移电子的物质的量, 表示法拉第常数。
表示法拉第常数。①当电解电压为
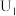 时,电解过程中含碳还原产物的
时,电解过程中含碳还原产物的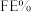 为0,阴极主要还原产物为
为0,阴极主要还原产物为②当电解电压为
 时,阴极生成
时,阴极生成 的电极反应式为
的电极反应式为③当电解电压为
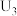 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为
您最近半年使用:0次
名校
4 . 完成下列问题
(1)消除汽车尾气中的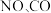 ,有利于减少
,有利于减少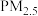 的排放。已知如下信息:
的排放。已知如下信息:
Ⅰ.
Ⅱ.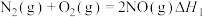

①
___________ 。
②在催化剂作用下 和
和 转化为无毒气体,写出反应的热化学方程式
转化为无毒气体,写出反应的热化学方程式___________ 。
(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中 传感器的工作原理如图所示,则工作电极的电极反应式为
传感器的工作原理如图所示,则工作电极的电极反应式为___________ 。
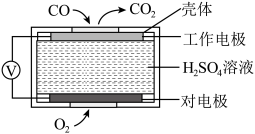
②方法2:氧化还原滴定法。用 溶液吸收尾气,将氮氧化物转化为硝酸,用酸碱中和滴定法测定硝酸浓度。写出
溶液吸收尾气,将氮氧化物转化为硝酸,用酸碱中和滴定法测定硝酸浓度。写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(3)中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分 )可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。查文献得知,可以从硫化砷(As2S3)废渣中提取
)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。查文献得知,可以从硫化砷(As2S3)废渣中提取 ,提取的工艺流程简图如下:
,提取的工艺流程简图如下:

①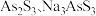 中的S均为-2价,碱浸过程中发生的反应
中的S均为-2价,碱浸过程中发生的反应___________ (填“是”或“是”)氧化还原反应。
②写出过程Ⅲ的离子方程式___________ 。
(4)亚砷酸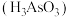 也可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液
也可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液 关系如下图所示。
关系如下图所示。
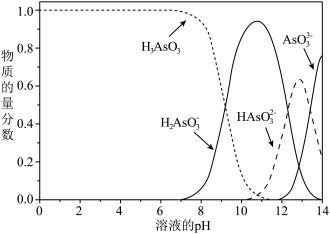
①人体血液的 在
在 之间,用药后人体中含砷元素的主要微粒是
之间,用药后人体中含砷元素的主要微粒是___________ 。
②将 溶液滴入亚砷酸溶液,当
溶液滴入亚砷酸溶液,当 调至11时发生反应的离子方程式是
调至11时发生反应的离子方程式是___________ 。
(1)消除汽车尾气中的
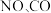 ,有利于减少
,有利于减少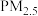 的排放。已知如下信息:
的排放。已知如下信息:Ⅰ.

Ⅱ.
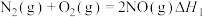

①

②在催化剂作用下
 和
和 转化为无毒气体,写出反应的热化学方程式
转化为无毒气体,写出反应的热化学方程式(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中
 传感器的工作原理如图所示,则工作电极的电极反应式为
传感器的工作原理如图所示,则工作电极的电极反应式为
②方法2:氧化还原滴定法。用
 溶液吸收尾气,将氮氧化物转化为硝酸,用酸碱中和滴定法测定硝酸浓度。写出
溶液吸收尾气,将氮氧化物转化为硝酸,用酸碱中和滴定法测定硝酸浓度。写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式(3)中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分
 )可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。查文献得知,可以从硫化砷(As2S3)废渣中提取
)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。查文献得知,可以从硫化砷(As2S3)废渣中提取 ,提取的工艺流程简图如下:
,提取的工艺流程简图如下:
①
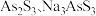 中的S均为-2价,碱浸过程中发生的反应
中的S均为-2价,碱浸过程中发生的反应②写出过程Ⅲ的离子方程式
(4)亚砷酸
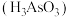 也可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液
也可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液 关系如下图所示。
关系如下图所示。
①人体血液的
 在
在 之间,用药后人体中含砷元素的主要微粒是
之间,用药后人体中含砷元素的主要微粒是②将
 溶液滴入亚砷酸溶液,当
溶液滴入亚砷酸溶液,当 调至11时发生反应的离子方程式是
调至11时发生反应的离子方程式是
您最近半年使用:0次
名校
5 .  还原重整
还原重整 既能减少二氧化碳排放,又能生产增值化学品,是实现“双碳”经济的有效途径之一、
既能减少二氧化碳排放,又能生产增值化学品,是实现“双碳”经济的有效途径之一、
(1)甲烷干法重整(1000℃)
ⅰ.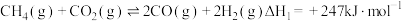
ⅱ.
①反应ⅰ的平衡常数表达式为______ 。
②对于反应ⅰ,既能加快反应速率又能提高 平衡转化率的措施是
平衡转化率的措施是_______ 。(写2条)反应ⅱ为副反应,生产中要尽可能控制该反应,减少水的生成。
(2)甲烷超干重整(750℃)


①
_______  。
。
② 的转化原理如下图所示:恒压、750℃时,将混合气
的转化原理如下图所示:恒压、750℃时,将混合气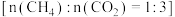 通入反应器
通入反应器 ,充分反应;待反应平衡后,改通
,充分反应;待反应平衡后,改通 气,吹出反应器
气,吹出反应器 内气体;如此往复切换通入的气体,实现
内气体;如此往复切换通入的气体,实现 的高效转化。
的高效转化。
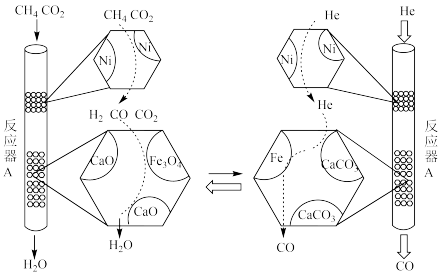
ⅰ.基态 原子
原子 轨道能活化
轨道能活化 的简化电子排布式是
的简化电子排布式是________ 。
ⅱ.结合有关反应方程式,说明 对
对 氧化
氧化 反应的影响
反应的影响________ 。
ⅲ.反应达平衡后,改通 气,测得一段时间内
气,测得一段时间内 物质的量上升,解释
物质的量上升,解释 物质的量上升的原因
物质的量上升的原因___________ 。
(3)从能源利用的角度,分析甲烷超干重整法的优点:_______ 。
 还原重整
还原重整 既能减少二氧化碳排放,又能生产增值化学品,是实现“双碳”经济的有效途径之一、
既能减少二氧化碳排放,又能生产增值化学品,是实现“双碳”经济的有效途径之一、(1)甲烷干法重整(1000℃)
ⅰ.
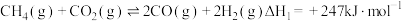
ⅱ.

①反应ⅰ的平衡常数表达式为
②对于反应ⅰ,既能加快反应速率又能提高
 平衡转化率的措施是
平衡转化率的措施是(2)甲烷超干重整(750℃)


①

 。
。②
 的转化原理如下图所示:恒压、750℃时,将混合气
的转化原理如下图所示:恒压、750℃时,将混合气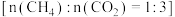 通入反应器
通入反应器 ,充分反应;待反应平衡后,改通
,充分反应;待反应平衡后,改通 气,吹出反应器
气,吹出反应器 内气体;如此往复切换通入的气体,实现
内气体;如此往复切换通入的气体,实现 的高效转化。
的高效转化。
ⅰ.基态
 原子
原子 轨道能活化
轨道能活化 的简化电子排布式是
的简化电子排布式是ⅱ.结合有关反应方程式,说明
 对
对 氧化
氧化 反应的影响
反应的影响ⅲ.反应达平衡后,改通
 气,测得一段时间内
气,测得一段时间内 物质的量上升,解释
物质的量上升,解释 物质的量上升的原因
物质的量上升的原因(3)从能源利用的角度,分析甲烷超干重整法的优点:
您最近半年使用:0次
名校
解题方法
6 . 肼(N2H4)有较强的还原性,与N2O4等可组成火箭推进剂。
(1)已知:I.N2(g)+2O2(g)=2NO2(g) ΔH1=-67.7kJ·mol-1
Ⅱ.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.0kJ·mol-1
Ⅲ.NO2(g)
 N2O4(g) ΔH3=-26.4kJ·mol-1
N2O4(g) ΔH3=-26.4kJ·mol-1
火箭发射时N2H4与N2O4反应生成N2和H2O。该反应的热化学方程式是___________ 。
(2)肼的传统生产工艺为Raschig法,两步反应分别在不同容器的水溶液环境中进行:
i.NH3+NaClO=NH2Cl+NaOH (快)
ii.NH2Cl+NH3+NaOH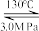 N2H4·H2O+NaCl (慢)
N2H4·H2O+NaCl (慢)
已知电负性N>Cl。下列说法正确的是___________ (填序号)。
a.反应i中NaClO做氧化剂
b.适当提高反应i温度,可显著提高相同时间内N2H4·H2O的产量
c.采用3.0MPa压强可以增大NH3的溶解度,提高反应ii中NH2Cl的利用率
(3)采用Raschig法制得肼后,可采用分步蒸馏的方法将其从反应混合液中分离出来。蒸馏过程中首先馏出的物质是___________ (填序号)。
a.NH3 b.N2H4·H2O c.NaCl
(4)产品中肼含量的测定方法如下。
取0.50g产品加20mL水稀释,滴入2滴淀粉溶液,用0.500mol·L-1 溶液滴定3次,平均每次消耗
溶液滴定3次,平均每次消耗 溶液20.00 mL。
溶液20.00 mL。
已知:N2H4+2 =4HI+N2。
=4HI+N2。
①样品中肼(以N2H4计)的质量分数为___________ 。
②若滴定过程中操作过于缓慢,则测定结果___________ (填“偏大”“偏小”“不受影响”)。
(5)肼除做火箭推进剂外还可用于燃料电池中。某种碱性肼-空气燃料电池(电解质为KOH溶液)具有高效、无污染的特点,装置如图所示。
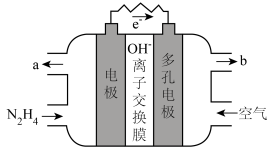
① 负极的电极反应式是___________ 。
② 电池工作一段时间后正极区KOH溶液pH基本保持不变,结合电极反应式解释原因___________ 。
(1)已知:I.N2(g)+2O2(g)=2NO2(g) ΔH1=-67.7kJ·mol-1
Ⅱ.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.0kJ·mol-1
Ⅲ.NO2(g)

 N2O4(g) ΔH3=-26.4kJ·mol-1
N2O4(g) ΔH3=-26.4kJ·mol-1火箭发射时N2H4与N2O4反应生成N2和H2O。该反应的热化学方程式是
(2)肼的传统生产工艺为Raschig法,两步反应分别在不同容器的水溶液环境中进行:
i.NH3+NaClO=NH2Cl+NaOH (快)
ii.NH2Cl+NH3+NaOH
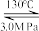 N2H4·H2O+NaCl (慢)
N2H4·H2O+NaCl (慢)已知电负性N>Cl。下列说法正确的是
a.反应i中NaClO做氧化剂
b.适当提高反应i温度,可显著提高相同时间内N2H4·H2O的产量
c.采用3.0MPa压强可以增大NH3的溶解度,提高反应ii中NH2Cl的利用率
(3)采用Raschig法制得肼后,可采用分步蒸馏的方法将其从反应混合液中分离出来。蒸馏过程中首先馏出的物质是
a.NH3 b.N2H4·H2O c.NaCl
(4)产品中肼含量的测定方法如下。
取0.50g产品加20mL水稀释,滴入2滴淀粉溶液,用0.500mol·L-1
 溶液滴定3次,平均每次消耗
溶液滴定3次,平均每次消耗 溶液20.00 mL。
溶液20.00 mL。已知:N2H4+2
 =4HI+N2。
=4HI+N2。①样品中肼(以N2H4计)的质量分数为
②若滴定过程中操作过于缓慢,则测定结果
(5)肼除做火箭推进剂外还可用于燃料电池中。某种碱性肼-空气燃料电池(电解质为KOH溶液)具有高效、无污染的特点,装置如图所示。

① 负极的电极反应式是
② 电池工作一段时间后正极区KOH溶液pH基本保持不变,结合电极反应式解释原因
您最近半年使用:0次
名校
7 . 甲醇氧化为甲醛和水的反应可看作以下两个连续反应:
ⅰ.
ⅱ.H2(g)+ O2(g)=H2O(g) ΔH2=-247.8kJ/mol
O2(g)=H2O(g) ΔH2=-247.8kJ/mol
已知: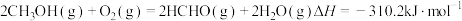
(1)
___________ 。
(2)要提高反应ⅰ中甲醇平衡转化率,可采取的措施有___________ (写出两条)
(3)应用负载银催化时反应ⅰ会发生以下副反应:
ⅲ.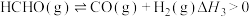
ⅳ.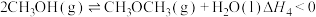
其他条件相同时,以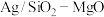 为催化剂,研究银负载量对催化剂活性的影响,实验数据如图所示:
为催化剂,研究银负载量对催化剂活性的影响,实验数据如图所示:

①依据实验数据应选择的最佳反应条件是___________ 。
②温度由650℃至700℃甲醛收率下降的可能原因是___________ 。
(4)通过电催化法可将甲醇转化为甲醛,装置如图所示(电极均为惰性电极)
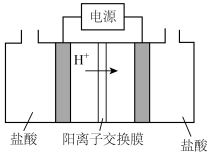
①电极 连接电源的
连接电源的___________ 极(填“正”或“负”)。
②阳极室产生 后发生的反应有:
后发生的反应有:___________ 、
(5)电解后甲醛含量测定方法如下:(溶液中无 、
、 剩余)
剩余)
已知:


若滴定过程中消耗 碘V1L,消耗
碘V1L,消耗 标准
标准 溶液V2L,则电解后甲醛的含量为
溶液V2L,则电解后甲醛的含量为___________  。
。
ⅰ.

ⅱ.H2(g)+
 O2(g)=H2O(g) ΔH2=-247.8kJ/mol
O2(g)=H2O(g) ΔH2=-247.8kJ/mol已知:
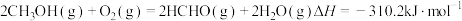
(1)

(2)要提高反应ⅰ中甲醇平衡转化率,可采取的措施有
(3)应用负载银催化时反应ⅰ会发生以下副反应:
ⅲ.
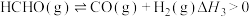
ⅳ.
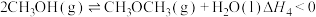
其他条件相同时,以
 为催化剂,研究银负载量对催化剂活性的影响,实验数据如图所示:
为催化剂,研究银负载量对催化剂活性的影响,实验数据如图所示:
①依据实验数据应选择的最佳反应条件是
②温度由650℃至700℃甲醛收率下降的可能原因是
(4)通过电催化法可将甲醇转化为甲醛,装置如图所示(电极均为惰性电极)

①电极
 连接电源的
连接电源的②阳极室产生
 后发生的反应有:
后发生的反应有:
(5)电解后甲醛含量测定方法如下:(溶液中无
 、
、 剩余)
剩余)已知:



若滴定过程中消耗
 碘V1L,消耗
碘V1L,消耗 标准
标准 溶液V2L,则电解后甲醛的含量为
溶液V2L,则电解后甲醛的含量为 。
。
您最近半年使用:0次
名校
解题方法
8 .  相关转化的研究,对解决环境、能源问题意义重大。
相关转化的研究,对解决环境、能源问题意义重大。
(1) 催化加氢制取汽油,
催化加氢制取汽油, 转化过程示意图如图:
转化过程示意图如图:
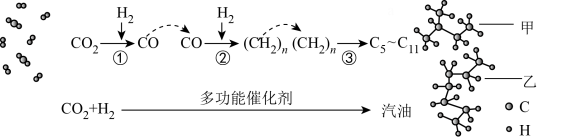
下列说法不正确的是___________ 。
a.反应①的产物中含有水 b.图中甲与乙互为同系物
c.反应②中只有碳碳键形成 d.汽油主要是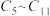 的烃类混合物
的烃类混合物
(2) 与
与 经催化重整可制得合成气:
经催化重整可制得合成气:

已知: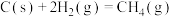
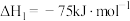
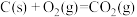



该催化重整反应的
___________  。
。
(3) 与
与 反应制取中醇
反应制取中醇 。
。
已知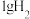 与
与 反应生成
反应生成 气体和水蒸气放出
气体和水蒸气放出 的热量。
的热量。
写出 与
与 制取
制取 的热化学方程式
的热化学方程式___________ 。
(4)制取化工原料草酸铝 。
。
利用 电池,能有效地将
电池,能有效地将 转化成草酸铝,工作原理如图所示。
转化成草酸铝,工作原理如图所示。
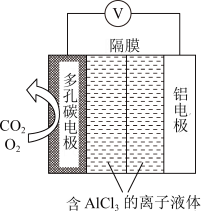
①电池的负极反应式是:___________ 。
②电池的正极反应式: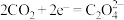 (草酸根)。
(草酸根)。
正极反应过程中, 起催化作用,催化过程可表示为:
起催化作用,催化过程可表示为:
I.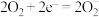
Ⅱ.
写出Ⅱ的离子方程式:___________ 。
 相关转化的研究,对解决环境、能源问题意义重大。
相关转化的研究,对解决环境、能源问题意义重大。(1)
 催化加氢制取汽油,
催化加氢制取汽油, 转化过程示意图如图:
转化过程示意图如图:
下列说法不正确的是
a.反应①的产物中含有水 b.图中甲与乙互为同系物
c.反应②中只有碳碳键形成 d.汽油主要是
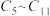 的烃类混合物
的烃类混合物(2)
 与
与 经催化重整可制得合成气:
经催化重整可制得合成气:

已知:
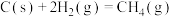
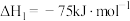
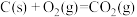



该催化重整反应的

 。
。(3)
 与
与 反应制取中醇
反应制取中醇 。
。已知
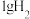 与
与 反应生成
反应生成 气体和水蒸气放出
气体和水蒸气放出 的热量。
的热量。写出
 与
与 制取
制取 的热化学方程式
的热化学方程式(4)制取化工原料草酸铝
 。
。利用
 电池,能有效地将
电池,能有效地将 转化成草酸铝,工作原理如图所示。
转化成草酸铝,工作原理如图所示。
①电池的负极反应式是:
②电池的正极反应式:
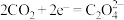 (草酸根)。
(草酸根)。正极反应过程中,
 起催化作用,催化过程可表示为:
起催化作用,催化过程可表示为:I.
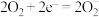
Ⅱ.

写出Ⅱ的离子方程式:
您最近半年使用:0次
名校
解题方法
9 . 将 作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、
作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、 资源化利用等显著优势。
资源化利用等显著优势。
(1)①查阅资料,计算 氧化
氧化 脱氢反应的反应热
脱氢反应的反应热
i.查阅______ 的燃烧热数据(填化学式)。
ii.查阅水的汽化热:
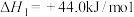 。
。
利用上述数据,得如下热化学方程式:
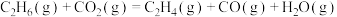
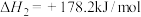
②检验产物有乙烯生成的操作和现象______ 。
(2)结合键能数据分析 氧化
氧化 脱氢反应的挑战和难点
脱氢反应的挑战和难点______ 。
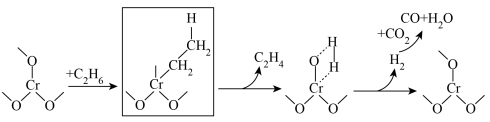
(3)推测 催化
催化 氧化
氧化 脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
(4)分析投料体积比对反应的影响(650℃,0.1MPa,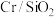 催化剂)
催化剂)
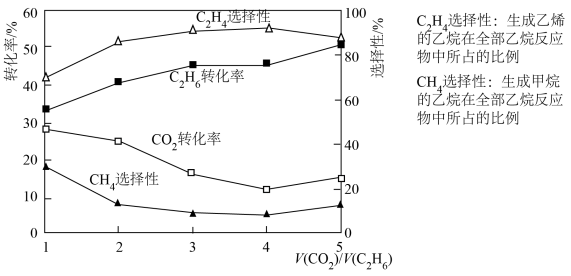
①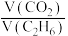 从1提高到5,
从1提高到5, 转化率从33.3%增加到50.5%,简述
转化率从33.3%增加到50.5%,简述 转化率增加的原因
转化率增加的原因______ 。(体积比为3和4时乙烷转化率基本相同)
②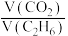 从4提高到5,副反应的化学方程式可能是
从4提高到5,副反应的化学方程式可能是______ 。
 作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、
作为弱氧化剂用于乙烷脱氢制备乙烯,具有避免乙烷深度氧化、 资源化利用等显著优势。
资源化利用等显著优势。(1)①查阅资料,计算
 氧化
氧化 脱氢反应的反应热
脱氢反应的反应热i.查阅
ii.查阅水的汽化热:

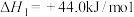 。
。利用上述数据,得如下热化学方程式:
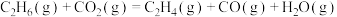
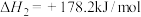
②检验产物有乙烯生成的操作和现象
(2)结合键能数据分析
 氧化
氧化 脱氢反应的挑战和难点
脱氢反应的挑战和难点键 |
|
|
|
键能 | 347.7 | 413.4 | 745 |
(3)推测
 催化
催化 氧化
氧化 脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
脱氢反应过程示意图如下,补全示意图中画框部分(示意图中未使用键线式)。
(4)分析投料体积比对反应的影响(650℃,0.1MPa,
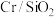 催化剂)
催化剂)
①
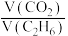 从1提高到5,
从1提高到5, 转化率从33.3%增加到50.5%,简述
转化率从33.3%增加到50.5%,简述 转化率增加的原因
转化率增加的原因②
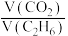 从4提高到5,副反应的化学方程式可能是
从4提高到5,副反应的化学方程式可能是
您最近半年使用:0次
名校
解题方法
10 . 利用 合成尿素是
合成尿素是 资源化的重要途径,可产生巨大的经济价值。
资源化的重要途径,可产生巨大的经济价值。
(1)20世纪初,工业上以 和
和 为原料在一定温度压强下合成尿素,反应过程中能量变化如图。
为原料在一定温度压强下合成尿素,反应过程中能量变化如图。
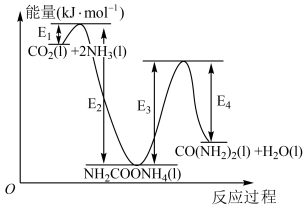
①反应物液氨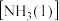 分子间除存在范德华力外,还存在
分子间除存在范德华力外,还存在___________ (填作用力名称)。
②写出在该条件下由 和
和 合成尿素的热化学方程式:
合成尿素的热化学方程式:___________ 。
(2)近年研究发现,电催化 和含氮物质可合成尿素,同时可解决含氮废水污染问题。常温常压下,向一定浓度的
和含氮物质可合成尿素,同时可解决含氮废水污染问题。常温常压下,向一定浓度的 溶液通入
溶液通入 至饱和,经电解获得尿素,其原理如图所示。
至饱和,经电解获得尿素,其原理如图所示。
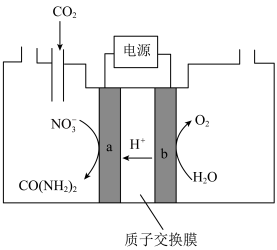
①电解过程中生成尿素的电极反应式为___________ 。
②目前以 和
和 为原料的电化学尿素合成可达到
为原料的电化学尿素合成可达到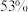 的法拉第效率
的法拉第效率 。已知:
。已知: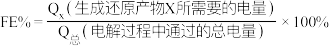 ,其中,
,其中,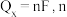 表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。则电解时阳极每产生标况下
表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。则电解时阳极每产生标况下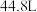 的
的 ,可获得尿素的质量为
,可获得尿素的质量为___________ 。(尿素的相对分子质量:60)
(3)尿素样品含氮量的测定方法如下。
已知:溶液中 不能直接用
不能直接用 溶液准确滴定。
溶液准确滴定。

①消化液中的含氮粒子是___________ 。
②步骤ⅳ中标准 溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有
溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有___________ 。
 合成尿素是
合成尿素是 资源化的重要途径,可产生巨大的经济价值。
资源化的重要途径,可产生巨大的经济价值。(1)20世纪初,工业上以
 和
和 为原料在一定温度压强下合成尿素,反应过程中能量变化如图。
为原料在一定温度压强下合成尿素,反应过程中能量变化如图。
①反应物液氨
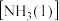 分子间除存在范德华力外,还存在
分子间除存在范德华力外,还存在②写出在该条件下由
 和
和 合成尿素的热化学方程式:
合成尿素的热化学方程式:(2)近年研究发现,电催化
 和含氮物质可合成尿素,同时可解决含氮废水污染问题。常温常压下,向一定浓度的
和含氮物质可合成尿素,同时可解决含氮废水污染问题。常温常压下,向一定浓度的 溶液通入
溶液通入 至饱和,经电解获得尿素,其原理如图所示。
至饱和,经电解获得尿素,其原理如图所示。
①电解过程中生成尿素的电极反应式为
②目前以
 和
和 为原料的电化学尿素合成可达到
为原料的电化学尿素合成可达到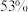 的法拉第效率
的法拉第效率 。已知:
。已知: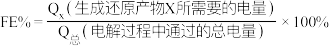 ,其中,
,其中,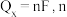 表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。则电解时阳极每产生标况下
表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。则电解时阳极每产生标况下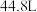 的
的 ,可获得尿素的质量为
,可获得尿素的质量为(3)尿素样品含氮量的测定方法如下。
已知:溶液中
 不能直接用
不能直接用 溶液准确滴定。
溶液准确滴定。
①消化液中的含氮粒子是
②步骤ⅳ中标准
 溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有
溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有
您最近半年使用:0次