名校
解题方法
1 . CO2催化加氢制取甲醇、乙醇等低碳醇的研究,对于环境问题和能源文体都具有非常重要的意义。已知一定条件下的如下反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H=﹣49.0kJ•mol-1
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g) △H=﹣173.6kJ•mol-1
下列说法不正确的是
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H=﹣49.0kJ•mol-1
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g) △H=﹣173.6kJ•mol-1
下列说法不正确的是
| A.CH3OH(g)+CO2(g)+3H2(g)⇌CH3CH2OH(g)+2H2O(g) △H<0 |
| B.增大压强,有利于反应向生成低碳醇的方向移动,平衡常数增大 |
| C.升高温度,可加快生成低碳醇的速率,但反应限度减小 |
| D.增大氢气浓度可以提高二氧化碳的转化率 |
您最近半年使用:0次
2021-11-07更新
|
372次组卷
|
9卷引用:北京市2020普通高中学业水平考试等级性抽样测试化学试题
2 . 第十三届全国人大第一次会议的政府工作报告中,对大气污染物的治理提出了更高要求。治理NO2污染的一种方法是将其转化成N2。
已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol
②N2(g)+2O2(g)=2NO2(g) ΔH=+133.0kJ/mol
(1)反应①属于___ (填“吸热”或“放热”)反应。
(2)反应①消耗1molO2(g)时,热量变化是____ kJ。
(3)反应②的热量变化为133.0kJ时,需消耗N2(g)的质量是___ g。
(4)治理NO2的反应:4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=______ kJ/mol。
已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol
②N2(g)+2O2(g)=2NO2(g) ΔH=+133.0kJ/mol
(1)反应①属于
(2)反应①消耗1molO2(g)时,热量变化是
(3)反应②的热量变化为133.0kJ时,需消耗N2(g)的质量是
(4)治理NO2的反应:4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=
您最近半年使用:0次
3 . 肼(N2H4)是一种应用广泛的化工原料,可作为火箭发动机的燃料。
已知:①N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ/mol。
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol。
请回答:
(1)反应①属于_______ (填“吸热”或“放热”)反应。
(2)反应①消耗28gN2(g)时,∆H=____ kJ/mol。
(3)反应②生成1molN2(g)时,∆H=____ kJ/mol。
(4)反应2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),∆H=____ kJ/mol。
已知:①N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ/mol。
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ/mol。
请回答:
(1)反应①属于
(2)反应①消耗28gN2(g)时,∆H=
(3)反应②生成1molN2(g)时,∆H=
(4)反应2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),∆H=
您最近半年使用:0次
解题方法
4 . 载人航天器中,利用萨巴蒂尔反应将航天员呼出的 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。已知:
的再生。已知:
①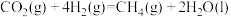 △H= -252.9kJ/mol
△H= -252.9kJ/mol
②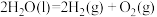 △H= 571.6.kJ/mol
△H= 571.6.kJ/mol
请回答下列问题:
(1)反应①属于______ (填“吸热”或“放热”)反应。
(2)反应①消耗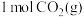 时,热量变化为
时,热量变化为______  。
。
(3)反应②的热量变化为吸热571.6.kJ时,生成 的质量是
的质量是_______ g。
(4)反应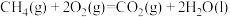 ,△H=
,△H=______  。
。
 转化为
转化为 ,再通过电解
,再通过电解 获得
获得 ,实现
,实现 的再生。已知:
的再生。已知:①
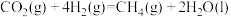 △H= -252.9kJ/mol
△H= -252.9kJ/mol②
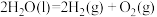 △H= 571.6.kJ/mol
△H= 571.6.kJ/mol请回答下列问题:
(1)反应①属于
(2)反应①消耗
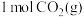 时,热量变化为
时,热量变化为 。
。(3)反应②的热量变化为吸热571.6.kJ时,生成
 的质量是
的质量是(4)反应
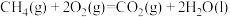 ,△H=
,△H= 。
。
您最近半年使用:0次
2020-09-16更新
|
204次组卷
|
3卷引用:北京市2018年春季普通高中会考化学试题
5 . 用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是_______________________________________________ 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______ (填字母)。
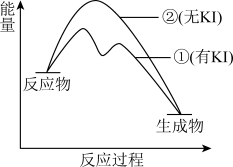
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I = H2O + IO
= H2O + IO 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________ ,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________ 。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________ 。
(4)资料4:I + I
+ I
 I
I K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
① a =____________________ 。
② 该平衡体系中除了含有I 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是_____________________ 。
(1)资料1:KI在该反应中的作用:H2O2 + I
 = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是

a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I
 = H2O + IO
= H2O + IO 是放热反应
是放热反应(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ.
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是
(4)资料4:I
 + I
+ I
 I
I K= 640。
K= 640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
| 微粒 | I | I | I |
| 浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
② 该平衡体系中除了含有I
 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是
您最近半年使用:0次
2020-01-23更新
|
356次组卷
|
11卷引用:北京市2020普通高中学业水平考试等级性抽样测试化学试题
北京市2020普通高中学业水平考试等级性抽样测试化学试题北京师范大学附中2019-2020学年高二上学期期中考试化学试题2020年北京新高考试测化学试题北京市海淀区清华大学附属中学2020届高三下学期统一测试化学试题北京市第十四中学2021-2022学年高二上学期期中考试化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练(已下线)易错11 影响化学反应速率的因素-备战2021年高考化学一轮复习易错题内蒙古赤峰二中2021-2022学年高三上学期第一次月考化学试题(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题(已下线)第七章 化学反应速率与化学平衡 第40练 化学反应速率
名校
解题方法
6 . AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________ 。
Ⅱ.上述反应适宜的温度范围是______ ℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________ 、_________ 和2Al + N2  2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________ 。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
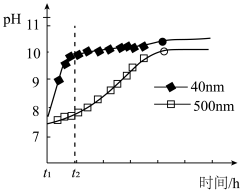
① AlN粉末水解的化学方程式是____________________________________ 。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________ 。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________ 。
相关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
| Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是
Ⅱ.上述反应适宜的温度范围是
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:
 2AlN。
2AlN。③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。

① AlN粉末水解的化学方程式是
② 解释t1-t2时间内两条曲线差异的可能原因:
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是
您最近半年使用:0次
2020-01-23更新
|
325次组卷
|
4卷引用:北京市2020普通高中学业水平考试等级性抽样测试化学试题



