用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是_______________________________________________ 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______ (填字母)。
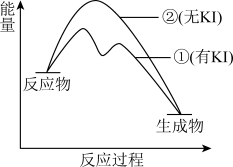
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I = H2O + IO
= H2O + IO 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________ ,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________ 。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________ 。
(4)资料4:I + I
+ I
 I
I K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
① a =____________________ 。
② 该平衡体系中除了含有I 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是_____________________ 。
(1)资料1:KI在该反应中的作用:H2O2 + I
 = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是

a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I
 = H2O + IO
= H2O + IO 是放热反应
是放热反应(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ.
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是
(4)资料4:I
 + I
+ I
 I
I K= 640。
K= 640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
| 微粒 | I | I | I |
| 浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
② 该平衡体系中除了含有I
 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是
19-20高二上·北京西城·期中 查看更多[11]
(已下线)第七章 化学反应速率与化学平衡 第40练 化学反应速率浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)北京市第十四中学2021-2022学年高二上学期期中考试化学试题内蒙古赤峰二中2021-2022学年高三上学期第一次月考化学试题(已下线)易错11 影响化学反应速率的因素-备战2021年高考化学一轮复习易错题北京市2020普通高中学业水平考试等级性抽样测试化学试题北京市海淀区清华大学附属中学2020届高三下学期统一测试化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练2020年北京新高考试测化学试题北京师范大学附中2019-2020学年高二上学期期中考试化学试题
更新时间:2020-01-23 12:13:41
|
相似题推荐
【推荐1】碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H1=-566kJ⋅mol-1
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ⋅mol-1
CO(g)+2H2(g)=CH3OH(g) △H3=-107kJ⋅mol-1
则2CO2(g)+4H2O(g)=2CH3OH(g)+3O2(g) △H=___________ kJ⋅mol-1
(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
①在0~5min内容器中v(H2)=___________ 。
②反应过程中,下列各项指标能表明A容器中反应的v正<v逆的是___________ (填标号)。
a、体系内的压强增大
b、气体的平均相对分子质量减小
c、H2O(g)的物质的量增加
d、v正(CO2)=v逆(H2)
(3)T℃时,通入1.0molCO和3.0molH2于恒压容器(带可移动活塞)中,起始容积为2L,发生反应:CO(g)+2H2(g) CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
①该温度下上述反应的平衡常数K=___________ ;平衡时H2的转化率是___________ 。
②若达平衡后,再充入1.0molCO、4.0molH2、1.0molCH3OH,平衡___________ (填“向正反应方向”、“向逆反应方向”或“不”)移动。新平衡时H2的转化率___________ (填“增大”、“不变”或“减小”)
(1)已知:2CO(g)+O2(g)=2CO2(g) △H1=-566kJ⋅mol-1
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ⋅mol-1
CO(g)+2H2(g)=CH3OH(g) △H3=-107kJ⋅mol-1
则2CO2(g)+4H2O(g)=2CH3OH(g)+3O2(g) △H=
(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:①在0~5min内容器中v(H2)=
②反应过程中,下列各项指标能表明A容器中反应的v正<v逆的是
a、体系内的压强增大
b、气体的平均相对分子质量减小
c、H2O(g)的物质的量增加
d、v正(CO2)=v逆(H2)
(3)T℃时,通入1.0molCO和3.0molH2于恒压容器(带可移动活塞)中,起始容积为2L,发生反应:CO(g)+2H2(g)
 CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:①该温度下上述反应的平衡常数K=
②若达平衡后,再充入1.0molCO、4.0molH2、1.0molCH3OH,平衡
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】目前世界上广泛采用氨和二氧化碳高温高压下制备尿素,主要反应为两步:
(1)写出制备尿素的总反应化学方程式:____________________________ ,该反应热为 ,则
,则
______________ (“大于”“小于”或“等于”) 。
。
(2)下列说法正确的是________________ 。
A.利用二氧化碳制备尿素是减缓温室效应的有效方法
B.第二步反应高温条件下自发进行
C.提高投料中的水碳比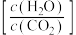 有利于尿素的生成
有利于尿素的生成
D.第一步反应的活化能大于第二步反应
(3)尿素生产过程中转化率通常用二氧化碳转化率来表示,当二氧化碳起始浓度为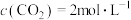 时(
时( ,水碳比=0.5),尿素平衡转化率随氨碳比
,水碳比=0.5),尿素平衡转化率随氨碳比 的变化如表所示:
的变化如表所示:
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于反应正向移动;二是_____________ 。氨碳比为3.50时,求该状态下的制备尿素总反应平衡常数K=___________ .
(4)一定条件下,在图中绘制氨基甲酸铵( )在反应过程中物质的量与时间的关系图。
)在反应过程中物质的量与时间的关系图。

_______________
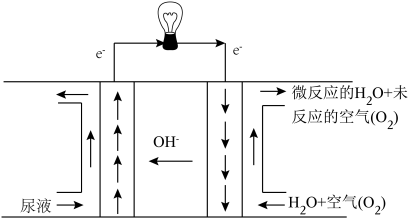
(5)通过直接尿素燃料电池装置,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:____________________________ .
| 第一步:生成氨基甲酸铵 | 第二步:氨基甲酸铵脱水生成尿素 |
2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) H2NCOONH4(氨基甲酸铵) (l)  H1 H1 | H2NCOONH4(l) H2O(l)+H2NCONH2(l) H2O(l)+H2NCONH2(l) H2 H2 |
| 快速放热 | 慢速吸热 |
(1)写出制备尿素的总反应化学方程式:
 ,则
,则
 。
。(2)下列说法正确的是
A.利用二氧化碳制备尿素是减缓温室效应的有效方法
B.第二步反应高温条件下自发进行
C.提高投料中的水碳比
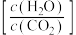 有利于尿素的生成
有利于尿素的生成D.第一步反应的活化能大于第二步反应
(3)尿素生产过程中转化率通常用二氧化碳转化率来表示,当二氧化碳起始浓度为
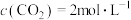 时(
时(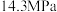 ,水碳比=0.5),尿素平衡转化率随氨碳比
,水碳比=0.5),尿素平衡转化率随氨碳比 的变化如表所示:
的变化如表所示:| 氨碳比/浓度比 | 2.95 | 3.10 | 3.20 | 3.50 |
| 尿素平衡转化率/% | 56.4 | 57.5 | 57.9 | 60.0 |
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于反应正向移动;二是
(4)一定条件下,在图中绘制氨基甲酸铵(
 )在反应过程中物质的量与时间的关系图。
)在反应过程中物质的量与时间的关系图。
(5)通过直接尿素燃料电池装置,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】温室气体的利用是当前环境和能源领域的研究热点,合理利用燃料废气中的CO2,也是实现“碳中和”的途径之一。
I.温室气体CO2转化为重要的工业原料甲酸是目前科学研究的热点。回答下列问题:
(1)已知:①CO(g)+H2O(g) HCOOH(g) △H1=−72.6kJ·mol−1
HCOOH(g) △H1=−72.6kJ·mol−1
②2CO(g)+O2(g) 2CO2(g) △H2=−566.0kJ·mol−1
2CO2(g) △H2=−566.0kJ·mol−1
则反应③的平衡常数表达式K=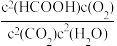 ,写出反应③的热化学方程式
,写出反应③的热化学方程式_______ 。
(2)刚性绝热密闭容器中,等物质的量的CO2(g)和H2O(g)发生反应③,下列可判断反应达到平衡的是_______(填标号)。
Ⅱ.CO2−CH4催化重整对减少温室气体的排放、改善大气环境具有重要的意义。
(3)在密闭容器中通入物质的量均为0.2mol的CH4和CO2,在一定条件下发生反应CH4(g)+CO2(g) ⇌2CO(g)+2H2(g),CH4的平衡转化率与温度及压强的关系如图所示。

①由如图可知:压强p1_______ p2(填“>”、“<”或“=”)。
②Y点:υ(正)_______ υ(逆)(填“>”、“<”或“=”)。
I.温室气体CO2转化为重要的工业原料甲酸是目前科学研究的热点。回答下列问题:
(1)已知:①CO(g)+H2O(g)
 HCOOH(g) △H1=−72.6kJ·mol−1
HCOOH(g) △H1=−72.6kJ·mol−1②2CO(g)+O2(g)
 2CO2(g) △H2=−566.0kJ·mol−1
2CO2(g) △H2=−566.0kJ·mol−1则反应③的平衡常数表达式K=
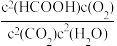 ,写出反应③的热化学方程式
,写出反应③的热化学方程式(2)刚性绝热密闭容器中,等物质的量的CO2(g)和H2O(g)发生反应③,下列可判断反应达到平衡的是_______(填标号)。
| A.CO2(g)和H2O(g)的物质的量之比不变 | B.容器中气体平均摩尔质量不变 |
| C.2υ正(CO2)= υ逆(O2) | D.容器内温度不变 |
Ⅱ.CO2−CH4催化重整对减少温室气体的排放、改善大气环境具有重要的意义。
(3)在密闭容器中通入物质的量均为0.2mol的CH4和CO2,在一定条件下发生反应CH4(g)+CO2(g) ⇌2CO(g)+2H2(g),CH4的平衡转化率与温度及压强的关系如图所示。

①由如图可知:压强p1
②Y点:υ(正)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
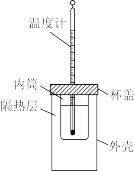
【推荐1】Ⅰ.用如图所示的装置测定中和反应反应热。 盐酸、
盐酸、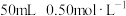 溶液、
溶液、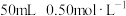 氨水。
氨水。
实验步骤:略。
已知弱碱电离时吸热。
回答下列问题。
(1)从实验装置上看,还缺少___________ ,其能否用铜质材料替代?___________ (填“能”或“不能”),理由是___________ 。
(2)装置中隔热层的作用是___________ 。
(3)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容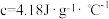 ,测得温度如下:
,测得温度如下:
①两组实验结果存在差异的原因是___________ 。
②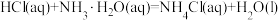 的
的 =
=___________ (保留一位小数)。
③某同学利用上述装置重新做甲组实验,测得反应热 偏大,则可能的原因是
偏大,则可能的原因是___________ (填序号)。
A.测完盐酸的温度直接测NaOH溶液温度
B.做该实验时室温较高
C.杯盖未盖严
D.NaOH溶液一次性迅速倒入
II.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(4)如图是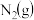 和
和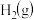 反应生成
反应生成 过程中能量的变化示意图,请写出1mol
过程中能量的变化示意图,请写出1mol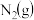 和
和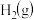 反应的热化学方程式:
反应的热化学方程式:___________ 。 催化还原NO,还可以消除氮氧化物的污染。已知:
催化还原NO,还可以消除氮氧化物的污染。已知:
 ①
①
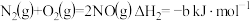 ②
②
若1mol 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热 =
=___________  (用含a、b的式子表示)。
(用含a、b的式子表示)。
III.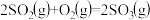 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。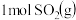 氧化为
氧化为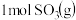 的
的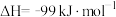 。请回答下列问题:
。请回答下列问题:
(6)图中A表示___________ 。E的大小对该反应的反应热___________ (填“有”或“无”)影响。该反应通常用 作催化剂,加
作催化剂,加 会使图中B点
会使图中B点___________ (填“升高”还是“降低”),ΔH___________ (填“变大”、“变小”或“不变”)。
(7)图中ΔH=___________  。
。
 盐酸、
盐酸、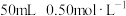 溶液、
溶液、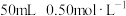 氨水。
氨水。实验步骤:略。
已知弱碱电离时吸热。
回答下列问题。
(1)从实验装置上看,还缺少
(2)装置中隔热层的作用是
(3)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容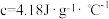 ,测得温度如下:
,测得温度如下:| 反应物 | 起始温度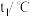 | 最高温度 |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
乙组 | 15.0 | 18.1 |
②
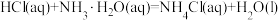 的
的 =
=③某同学利用上述装置重新做甲组实验,测得反应热
 偏大,则可能的原因是
偏大,则可能的原因是A.测完盐酸的温度直接测NaOH溶液温度
B.做该实验时室温较高
C.杯盖未盖严
D.NaOH溶液一次性迅速倒入
II.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(4)如图是
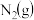 和
和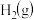 反应生成
反应生成 过程中能量的变化示意图,请写出1mol
过程中能量的变化示意图,请写出1mol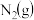 和
和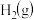 反应的热化学方程式:
反应的热化学方程式: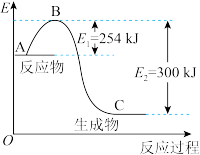
 催化还原NO,还可以消除氮氧化物的污染。已知:
催化还原NO,还可以消除氮氧化物的污染。已知: ①
①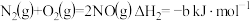 ②
②若1mol
 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热 =
= (用含a、b的式子表示)。
(用含a、b的式子表示)。III.
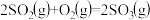 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。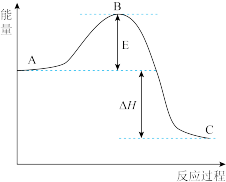
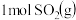 氧化为
氧化为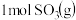 的
的 。请回答下列问题:
。请回答下列问题:(6)图中A表示
 作催化剂,加
作催化剂,加 会使图中B点
会使图中B点(7)图中ΔH=
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】氨气在工农业生产中有着重要的用途,研究合成氨反应具有重要意义。
(1)直接常压电化学合成氨以纳米 作催化剂,
作催化剂, 和
和 为原料制备
为原料制备 。其工作原理如图-1所示:
。其工作原理如图-1所示:
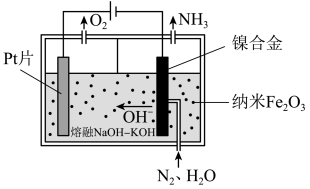
图-1
①阴极的电极反应式为___________ 。
②电解过程中,由于发生副反应,使得阴极制得的 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是
中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是___________ 。
(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如图-2所示。合成氨反应的热化学方程式为___________ 。生成 的历程中,速率最慢的反应的化学方程式为
的历程中,速率最慢的反应的化学方程式为___________ 。
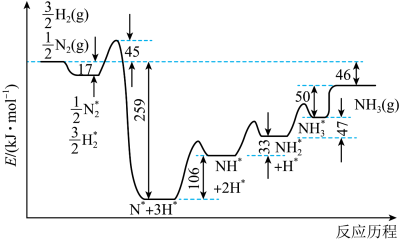
图-2
(3) 催化释氢可提供哈伯-博施合成氨反应所需的
催化释氢可提供哈伯-博施合成氨反应所需的 。在催化剂作用下,
。在催化剂作用下, 与水反应生成
与水反应生成 ,可能的反应机理如图-3所示。
,可能的反应机理如图-3所示。
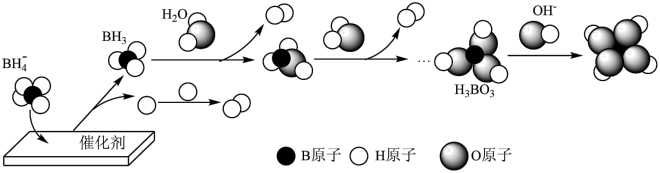
图-3
①其他条件不变时,以 代替
代替 催化释氢,所得气体的分子式为
催化释氢,所得气体的分子式为___________ 。
②已知: 为一元弱酸,
为一元弱酸, 水溶液呈酸性的原因是
水溶液呈酸性的原因是___________ (用离子方程式表示)。
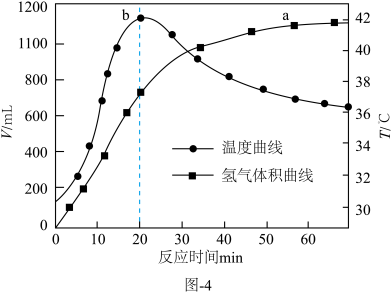
③在催化剂的作用下, 与水反应。释氢体积及温度随反应时间的变化如图-4所示。
与水反应。释氢体积及温度随反应时间的变化如图-4所示。 内,温度随时间快速升高的原因是
内,温度随时间快速升高的原因是___________ 。 后,氢气体积在增加,面温度却下降的原因是
后,氢气体积在增加,面温度却下降的原因是___________ 。
(1)直接常压电化学合成氨以纳米
 作催化剂,
作催化剂, 和
和 为原料制备
为原料制备 。其工作原理如图-1所示:
。其工作原理如图-1所示:
图-1
①阴极的电极反应式为
②电解过程中,由于发生副反应,使得阴极制得的
 中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是
中混有少量气体单质,则理论上阳极和阴极生成气体的物质的量之比的范围是(2)一定条件下,哈伯-博施合成氨反应历程中的能量变化如图-2所示。合成氨反应的热化学方程式为
 的历程中,速率最慢的反应的化学方程式为
的历程中,速率最慢的反应的化学方程式为
图-2
(3)
 催化释氢可提供哈伯-博施合成氨反应所需的
催化释氢可提供哈伯-博施合成氨反应所需的 。在催化剂作用下,
。在催化剂作用下, 与水反应生成
与水反应生成 ,可能的反应机理如图-3所示。
,可能的反应机理如图-3所示。
图-3
①其他条件不变时,以
 代替
代替 催化释氢,所得气体的分子式为
催化释氢,所得气体的分子式为②已知:
 为一元弱酸,
为一元弱酸, 水溶液呈酸性的原因是
水溶液呈酸性的原因是③在催化剂的作用下,
 与水反应。释氢体积及温度随反应时间的变化如图-4所示。
与水反应。释氢体积及温度随反应时间的变化如图-4所示。 内,温度随时间快速升高的原因是
内,温度随时间快速升高的原因是 后,氢气体积在增加,面温度却下降的原因是
后,氢气体积在增加,面温度却下降的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】Ⅰ.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)催化剂能增大化学反应速率的原因是___________ 。
(2)实验①和②的目的是探究___________ 对反应速率的影响。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是___________ 。
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。
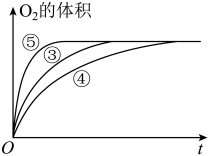
分析下图能够得出的实验结论:
①___________ 环境能增大H2O2分解的速率;
②___________ 环境能减小H2O2分解的速率。
(4)设计实验进一步探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2mL5%的H2O2溶液,再向其中分别滴入1mL浓度均为0.1mol/L的FeCl3溶液和CuSO4溶液。有同学建议将CuSO4改为CuCl2溶液,理由是___________ ;还有同学认为即使改用了CuCl2溶液,仍不严谨,建议补做对比实验:向2mL5%的H2O2溶液中滴入的试剂及其用量是___________ 。
Ⅱ.为进一步研究浓度对反应速率的影响,该实验小组又涉及了如下实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
(5)写出上述反应的离子方程式:___________ 。
(6)实验1中tmin时溶液褪色,用草酸表示的反应速率v(H2C2O4)=___________ mol·L-1·min-1。联系实验1、2,预期结论是___________ 。
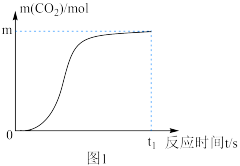
(7)n(CO2)随时间的变化如下图1所示,其变化的原因是___________ 。
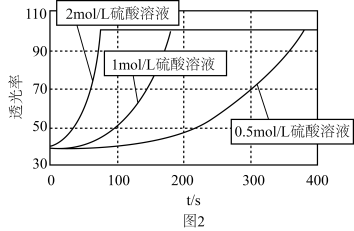
(8)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是___________ 。
| 分组实验 | 催化剂 | |
| ① | 10mL5%H2O2溶液 | 无 |
| ② | 10mL2%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量稀盐酸 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(2)实验①和②的目的是探究
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。

分析下图能够得出的实验结论:
①
②
(4)设计实验进一步探究Fe3+和Cu2+对H2O2分解的催化效果:在两支试管中各加入2mL5%的H2O2溶液,再向其中分别滴入1mL浓度均为0.1mol/L的FeCl3溶液和CuSO4溶液。有同学建议将CuSO4改为CuCl2溶液,理由是
Ⅱ.为进一步研究浓度对反应速率的影响,该实验小组又涉及了如下实验方案:混合试剂1和试剂2,记录溶液褪色所需的时间。
| 实验1 | 实验2 | |
| 试剂1 | 2mL0.1mol/L的草酸溶液 | 2mL0.2mol/L的草酸溶液 |
| 试剂2 | 4mL0.01mol/L的高锰酸钾酸性溶液 | 4mL0.01mol/L的高锰酸钾酸性溶液 |
(6)实验1中tmin时溶液褪色,用草酸表示的反应速率v(H2C2O4)=
(7)n(CO2)随时间的变化如下图1所示,其变化的原因是

(8)研究发现KMnO4溶液的酸化程度对反应的速率也有较大影响,用不同浓度的硫酸进行酸化,其余条件均相同时,测得反应溶液的透光率(溶液颜色越浅,透光率越高)随时间变化如图2所示,由此得出的结论是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮元素有多种化合物。生产生活中氨及铵盐有重要用途,而汽车尾气中含有的 NO、NO2因有害则应降低其排放。回答下列问题:
(1)在 20℃ 时,已知:
①N2(g)+O2(g)⇌2NO(g) 正、逆反应活化能分别为 akJ•mol-1、bkJ•mol-1
②4NH3(g)+5O2(g)⇌4NO(g)+6H2O(l) 正、逆反应活化能分别为 ckJ•mol-1、dkJ•mol-1
则 4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)的△H 为__________________ 。
(2)10.0L 的密闭容器中,按物质的量比 1:3 投入氮气和氢气,发生反应:N2(g)+3H2(g)⇌2NH3(g) △H <0,用传感器测得温度为 T1、T2时容器中 n(N2)随时间变化如下表:
①T1 时,该反应的平衡常数为_________ (用最简分数表示);
②x_______________ 0.06(填“>”、“<”或“=”),原因是____________________ 。
(3)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除 CO、NO 等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I NO+Pt(s)=NO* II CO+Pt(s)=CO*
III NO*=N*+O* IV CO*+O*=CO2+Pt(s)
V N*+N*=N2+Pt(s) VI NO*+N*=N2O+Pt(s)
经测定汽车尾气中反应物及生成物浓度随温度变化的关系如图一和图二所示。
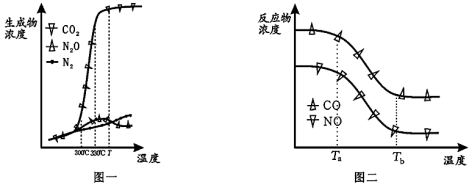
①图一中,温度为330℃时发生的主要反应为____ (填“IV”、“V”或“VI”);反应VI为____ 反应(填“放热”或“吸热”)。
②图二中,温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是___ 。
③已知气体在固体催化剂表面反应中,吸附和解吸过程同时影响总反应速率。温度一定时,反应2NO+2CO N2+2CO2的总反应速率随压强的变化如图所示。
N2+2CO2的总反应速率随压强的变化如图所示。
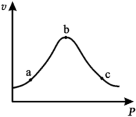
结合(3)中反应机理,解释 bc 段化学反应速率下降的原因____ 。
(1)在 20℃ 时,已知:
①N2(g)+O2(g)⇌2NO(g) 正、逆反应活化能分别为 akJ•mol-1、bkJ•mol-1
②4NH3(g)+5O2(g)⇌4NO(g)+6H2O(l) 正、逆反应活化能分别为 ckJ•mol-1、dkJ•mol-1
则 4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)的△H 为
(2)10.0L 的密闭容器中,按物质的量比 1:3 投入氮气和氢气,发生反应:N2(g)+3H2(g)⇌2NH3(g) △H <0,用传感器测得温度为 T1、T2时容器中 n(N2)随时间变化如下表:
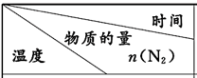 | 0 | 5 min | 10 min | 15 min | 20min |
T1 | 0.1mol | 0.08 mol | 0.062 mol | 0.05 mol | 0.05 mol |
T2 | 0.1 mol | 0.07 mol | - | x mol | 0.06 mol |
②x
(3)汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除 CO、NO 等污染物。反应机理如下[Pt(s)表示催化剂,右上角带“*”表示吸附状态]:
I NO+Pt(s)=NO* II CO+Pt(s)=CO*
III NO*=N*+O* IV CO*+O*=CO2+Pt(s)
V N*+N*=N2+Pt(s) VI NO*+N*=N2O+Pt(s)
经测定汽车尾气中反应物及生成物浓度随温度变化的关系如图一和图二所示。

①图一中,温度为330℃时发生的主要反应为
②图二中,温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是
③已知气体在固体催化剂表面反应中,吸附和解吸过程同时影响总反应速率。温度一定时,反应2NO+2CO
 N2+2CO2的总反应速率随压强的变化如图所示。
N2+2CO2的总反应速率随压强的变化如图所示。
结合(3)中反应机理,解释 bc 段化学反应速率下降的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】开发 催化加氢合成二甲醚技术是有效利用
催化加氢合成二甲醚技术是有效利用 资源,实现碳达峰、碳中和目标的重要途径。
资源,实现碳达峰、碳中和目标的重要途径。
(1)已知:①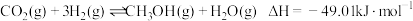
②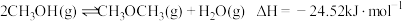
则 催化加氢直接合成二甲醚反应的热化学方程式为
催化加氢直接合成二甲醚反应的热化学方程式为_______ 。
(2)以 与
与 为原料可合成尿素
为原料可合成尿素 回收
回收 并为农业服务。
并为农业服务。
已知:反应I.
反应II.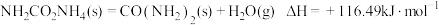
在相同条件下,反应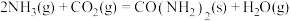 的正反应的活化能
的正反应的活化能 为
为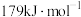 ,则逆反应的活化能
,则逆反应的活化能 为
为_______ 。
(3)工业上也可利用 溶液捕获
溶液捕获 。
。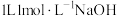 溶液捕获标准状况下
溶液捕获标准状况下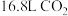 所得的溶液中,所有离子浓度由大到小的顺序为
所得的溶液中,所有离子浓度由大到小的顺序为_______ 。
(4)一定条件下,发生反应 ,反应体系中
,反应体系中 平衡转化率
平衡转化率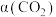 与L和X的关系如图1所示,L和X表示温度或压强。
与L和X的关系如图1所示,L和X表示温度或压强。
①X表示的物理量是_______ 。
②
_______ (填“<”或“>”) 。
。
(5)一定量的 与足量的C在恒压密闭容器中发生反应:
与足量的C在恒压密闭容器中发生反应: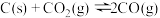 ,平衡时体系中气体体积分数与温度的关系如图2所示,回答下列问题:
,平衡时体系中气体体积分数与温度的关系如图2所示,回答下列问题:

① 时
时 的平衡转化率为
的平衡转化率为_______ 。
② 时反应达到平衡状态,若再充入等物质的量的
时反应达到平衡状态,若再充入等物质的量的 和
和 气体,则平衡
气体,则平衡_______ (填“正向”、“逆向”或“不”)移动。
 催化加氢合成二甲醚技术是有效利用
催化加氢合成二甲醚技术是有效利用 资源,实现碳达峰、碳中和目标的重要途径。
资源,实现碳达峰、碳中和目标的重要途径。(1)已知:①
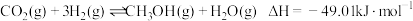
②
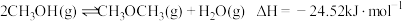
则
 催化加氢直接合成二甲醚反应的热化学方程式为
催化加氢直接合成二甲醚反应的热化学方程式为(2)以
 与
与 为原料可合成尿素
为原料可合成尿素 回收
回收 并为农业服务。
并为农业服务。已知:反应I.

反应II.
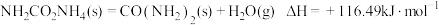
在相同条件下,反应
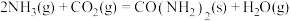 的正反应的活化能
的正反应的活化能 为
为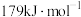 ,则逆反应的活化能
,则逆反应的活化能 为
为(3)工业上也可利用
 溶液捕获
溶液捕获 。
。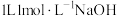 溶液捕获标准状况下
溶液捕获标准状况下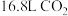 所得的溶液中,所有离子浓度由大到小的顺序为
所得的溶液中,所有离子浓度由大到小的顺序为(4)一定条件下,发生反应
 ,反应体系中
,反应体系中 平衡转化率
平衡转化率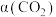 与L和X的关系如图1所示,L和X表示温度或压强。
与L和X的关系如图1所示,L和X表示温度或压强。
①X表示的物理量是
②

 。
。(5)一定量的
 与足量的C在恒压密闭容器中发生反应:
与足量的C在恒压密闭容器中发生反应: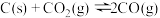 ,平衡时体系中气体体积分数与温度的关系如图2所示,回答下列问题:
,平衡时体系中气体体积分数与温度的关系如图2所示,回答下列问题:
①
 时
时 的平衡转化率为
的平衡转化率为②
 时反应达到平衡状态,若再充入等物质的量的
时反应达到平衡状态,若再充入等物质的量的 和
和 气体,则平衡
气体,则平衡
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲醇是重要的化工基础原料和清洁燃料。已知制备甲醇的有关化学反应以及在不同温度下的平衡常数如表所示。
回答下列问题:
(1)
_______ (填“>”或“<”)0。
(2)
_______ (用 和
和 表示),300℃时
表示),300℃时
_______ 。
(3)300℃时测得反应③在某时刻 、
、 、
、 、
、 的浓度相等,且均为
的浓度相等,且均为 ,则此时
,则此时 (浓度商)
(浓度商)_______ (填“>”或“<”) ,反应
,反应_______ (填“正向”或“逆向”)进行。
(4)某温度下在2L恒容密闭容器中加入 发生反应
发生反应 ,测得有关数据如表。
,测得有关数据如表。
①反应在2min内以 表示的化学反应速率为
表示的化学反应速率为_______  。
。
②该温度下反应的平衡常数为_______ (结果保留两位小数)。
| 化学反应 | 平衡常数 | 温度/℃ | |
| 300 | 500 | ||
①  |  | 2.5 | 0.15 |
②  |  | 1.0 | 2.5 |
③  |  | ||
(1)

(2)

 和
和 表示),300℃时
表示),300℃时
(3)300℃时测得反应③在某时刻
 、
、 、
、 、
、 的浓度相等,且均为
的浓度相等,且均为 ,则此时
,则此时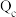 (浓度商)
(浓度商) ,反应
,反应(4)某温度下在2L恒容密闭容器中加入
 发生反应
发生反应 ,测得有关数据如表。
,测得有关数据如表。| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
 | 1.0 | 0.6 | 0.4 | 0.3 | 0.3 |
 表示的化学反应速率为
表示的化学反应速率为 。
。②该温度下反应的平衡常数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】Mg能在NO2中燃烧,产物为Mg3N2、MgO和N2。某科学小组通过实验验证反应产物并探究产物的比例关系。资料信息:
2NO2+2NaOH=NaNO3+NaNO2+H2O,Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,
限用如下装置实验(夹持装置省略,部分仪器可重复使用):
(1)装置连接的顺序为_____________ (填字母序号);
(2)连接好仪器,装入药品前检验装置气密性的方法是:____________________ ;
(3)装置A中盛装的干燥剂是_________________ ;装置F的作用___________ ;
(4)验证产物中存在Mg3N2的具体实验操作为___________________ ;确定产物中有N2生成的实验现象为____________________ ;
(5)已知装置E中初始加入Mg粉质量为13.2 g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0 g,产生N2的体积为1120 mL(标准状况)。写出玻璃管中发生反应的化学方程式:________________________ 。
2NO2+2NaOH=NaNO3+NaNO2+H2O,Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,
限用如下装置实验(夹持装置省略,部分仪器可重复使用):

(1)装置连接的顺序为
(2)连接好仪器,装入药品前检验装置气密性的方法是:
(3)装置A中盛装的干燥剂是
(4)验证产物中存在Mg3N2的具体实验操作为
(5)已知装置E中初始加入Mg粉质量为13.2 g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0 g,产生N2的体积为1120 mL(标准状况)。写出玻璃管中发生反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室可用下列装置(部分夹持仪器略去)制取SO2并验证其性质。___________ ,则气密性良好。
(2)装置A中滴加硫酸的仪器名称为___________ 。
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有___________ (填“还原性”、“氧化性”或“漂白性”)。
(4)试管D中反应的离子方程式为___________ 。
(5)用下图所示装置验证H2SO3酸性比H2CO3强。
a.品红溶液 b.酸性KMnO4溶液 c.饱和NaHCO3溶液 d.饱和NaHSO3溶液
X为___________ ,Y为___________ ,Z为___________ 。
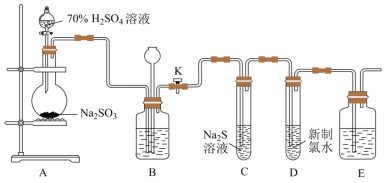
(2)装置A中滴加硫酸的仪器名称为
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有
(4)试管D中反应的离子方程式为
(5)用下图所示装置验证H2SO3酸性比H2CO3强。
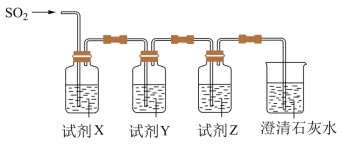
a.品红溶液 b.酸性KMnO4溶液 c.饱和NaHCO3溶液 d.饱和NaHSO3溶液
X为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是SO2,而乙同学认为除SO2外,还可能产生H2.为验证结果,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去).试回答:
(1)上述反应中生成SO2的化学方程式为_____________ .
(2)乙同学认为还可能产生H2的理由是_____________ .
(3)A中加入的试剂是____ ,作用是_______ ;B中加入的试剂是_____ ,作用是______ ;E中加入的试剂是____ ,作用是_________
(4)可以证明气体X中含有氢气的实验现象是:C中:______ ,D中:_______ .
该小组同学将收集的SO2气体通入0.1mol•L﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的硝酸根离子,假设二:溶液中溶解的O2
(5)该小组设计实验验证了假设一,请在下表空白处填写相关实验现象
为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图,实验1中溶液pH变小的原因是__________________________________ ;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)__________________ .
(6)丁同学以实验1为参照,补充设计了实验3来验证假设二,请完善他的设计
(7)若假设二成立,请预测:在相同条件下,分别加入足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者_______ (填“>”或“<”)后者,理由是_________________________________ 。
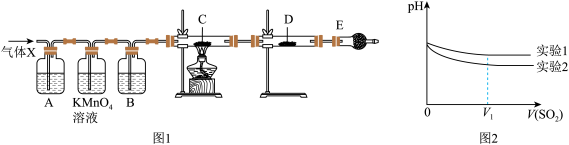
(1)上述反应中生成SO2的化学方程式为
(2)乙同学认为还可能产生H2的理由是
(3)A中加入的试剂是
(4)可以证明气体X中含有氢气的实验现象是:C中:
该小组同学将收集的SO2气体通入0.1mol•L﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的硝酸根离子,假设二:溶液中溶解的O2
(5)该小组设计实验验证了假设一,请在下表空白处填写相关实验现象
实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(6)丁同学以实验1为参照,补充设计了实验3来验证假设二,请完善他的设计
实验步骤 | 实验现象 | 结论 |
| 实验3: | 有白色沉淀产生 | 假设二成立 |
(7)若假设二成立,请预测:在相同条件下,分别加入足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者
您最近一年使用:0次



