名校
1 . 电催化还原CO2是当今资源化利用二氧化碳的重点课题。
(1)利用CO2合成淀粉
①
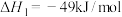
②
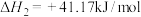
③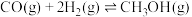

___________ (填“高温自发”“低温自发”或“任何温度下都自发”)。
(2)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示.控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示.___________ 。
②控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
③科研小组利用13CO2代替原有的CO2进行研究,其目的是___________ 。
(3)一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液呈蓝色.写出Cu2O还原HAuCl4的离子方程式:___________ 。
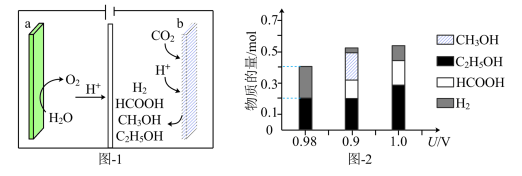
(4)金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图4所示。___________ 。
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是___________ 。
(1)利用CO2合成淀粉
①

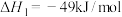
②

③
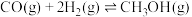

(2)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示.控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示.
②控制电压为0.8V,电解时转移电子的物质的量为
③科研小组利用13CO2代替原有的CO2进行研究,其目的是
(3)一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液呈蓝色.写出Cu2O还原HAuCl4的离子方程式:
(4)金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图4所示。
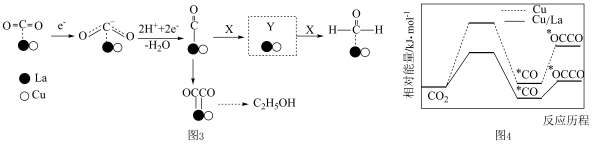
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是
您最近半年使用:0次
名校
2 . 尿素[CO(NH2)2]的生产具有重要意义。
(1)尿素的催化合成
已知:2H2(g)+O2(g)=2H2O(l) ΔH1=-286.0 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH2=-92.2 kJ·mol-1
2NH3(g)+CO2(g)=CO(NH2)2(aq)+H2O(l) ΔH3=-101.5 kJ·mol-1
则反应2CO2+2N2+4H2O=2CO(NH2)2+3O2的 ΔH=___________ kJ·mol-1
(2)尿素的电化学合成
①电催化CO2和 合成尿素的装置如下图所示,生成尿素的电极反应式为
合成尿素的装置如下图所示,生成尿素的电极反应式为___________ 。
已知:CO2在阴极还能被还原为CH4,其生成CH4的趋势比生成CO的趋势更大。但实验数据说明,一定时间内,阴极产物中CO的物质的量大于CH4,可能的原因为___________ 。
(3)尿素的应用
尿素将烟气中氮氧化物还原为N2以达到消除污染的目的。控制其他条件相同,将混有NO、NO2、SO2、N2和O2的模拟烟气匀速通过装有尿素溶液的装置,在装置出口处检测NO、NO2的脱除率α(α= ×100%)。
×100%)。
①当烟气中有少量SO2时,有利于NO2脱除,其可能的原因是___________ 。
②当烟气中无SO2存在时,且 超过一定数值时,测得α(NO)变为负值,其可能的原因是
超过一定数值时,测得α(NO)变为负值,其可能的原因是___________ 。
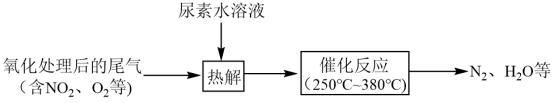
③尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如下:___________ 。
(1)尿素的催化合成
已知:2H2(g)+O2(g)=2H2O(l) ΔH1=-286.0 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH2=-92.2 kJ·mol-1
2NH3(g)+CO2(g)=CO(NH2)2(aq)+H2O(l) ΔH3=-101.5 kJ·mol-1
则反应2CO2+2N2+4H2O=2CO(NH2)2+3O2的 ΔH=
(2)尿素的电化学合成
①电催化CO2和
 合成尿素的装置如下图所示,生成尿素的电极反应式为
合成尿素的装置如下图所示,生成尿素的电极反应式为
已知:CO2在阴极还能被还原为CH4,其生成CH4的趋势比生成CO的趋势更大。但实验数据说明,一定时间内,阴极产物中CO的物质的量大于CH4,可能的原因为
(3)尿素的应用
尿素将烟气中氮氧化物还原为N2以达到消除污染的目的。控制其他条件相同,将混有NO、NO2、SO2、N2和O2的模拟烟气匀速通过装有尿素溶液的装置,在装置出口处检测NO、NO2的脱除率α(α=
 ×100%)。
×100%)。①当烟气中有少量SO2时,有利于NO2脱除,其可能的原因是
②当烟气中无SO2存在时,且
 超过一定数值时,测得α(NO)变为负值,其可能的原因是
超过一定数值时,测得α(NO)变为负值,其可能的原因是③尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
您最近半年使用:0次
解题方法
3 . 硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①
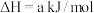
②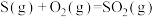
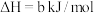
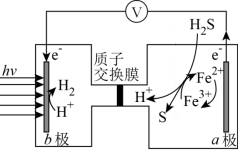
写出H2S(g)完全燃烧的热化学方程式_______ 。
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是_______ 。_______ ;
②若无能量损失,相同条件下,SO2和NO的体积比为_______ 时,两种气体都能被完全处理。
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。_______ 7(填“<”或“>”或“=”)。
②Na2HPO3其水解平衡常数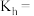
_______ (填数值)。
(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为_______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①

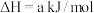
②
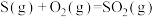
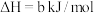
写出H2S(g)完全燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是


②若无能量损失,相同条件下,SO2和NO的体积比为
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数(
 )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
②Na2HPO3其水解平衡常数
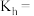
(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为
您最近半年使用:0次
4 . 天然气、石油钻探过程会释放出 、
、 等气体。
等气体。
Ⅰ.某种将 和
和 共活化的工艺涉及反应如下:
共活化的工艺涉及反应如下:
①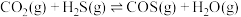

②

③
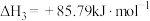
④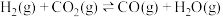
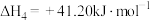
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:ⅰ. 和
和 的初始物质的量相等;
的初始物质的量相等;
ⅱ.COS的选择性 ,
, 的选择性
的选择性 ;
;
ⅲ.产率=转化率×选择性。
(1)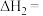
_______ 。
(2)温度高于 时,
时, 的转化率大于
的转化率大于 ,原因是
,原因是_______ 。
(3) 达到平衡时,反应体系中
达到平衡时,反应体系中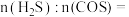
_______ 。
(4)催化剂 对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。
对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。请在答题纸对应区域绘出 过渡态 的示意图
的示意图_______ 。 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,其中电极分别为
的高效去除,其中电极分别为 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的 )和石墨烯。过程如图所示:
)和石墨烯。过程如图所示:_______ 。
(6)阳极区发生反应为:
①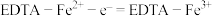 ;
;
②_______ 。
(7)工作时, 石墨烯电极区的
石墨烯电极区的 基本保持不变,原因是
基本保持不变,原因是_______ 。
 、
、 等气体。
等气体。Ⅰ.某种将
 和
和 共活化的工艺涉及反应如下:
共活化的工艺涉及反应如下:①
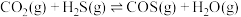

②


③

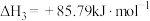
④
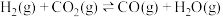
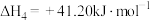
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:ⅰ.
 和
和 的初始物质的量相等;
的初始物质的量相等;ⅱ.COS的选择性
 ,
, 的选择性
的选择性 ;
;ⅲ.产率=转化率×选择性。
(1)
(2)温度高于
 时,
时, 的转化率大于
的转化率大于 ,原因是
,原因是(3)
 达到平衡时,反应体系中
达到平衡时,反应体系中
(4)催化剂
 对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。
对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。 的示意图
的示意图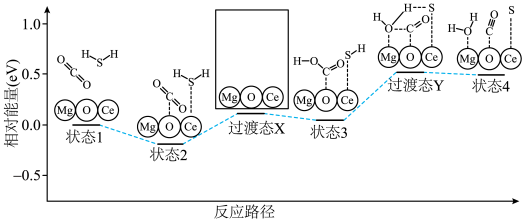
 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,其中电极分别为
的高效去除,其中电极分别为 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的 )和石墨烯。过程如图所示:
)和石墨烯。过程如图所示: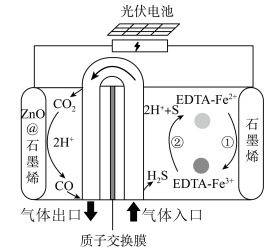
(6)阳极区发生反应为:
①
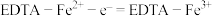 ;
;②
(7)工作时,
 石墨烯电极区的
石墨烯电极区的 基本保持不变,原因是
基本保持不变,原因是
您最近半年使用:0次
名校
解题方法
5 . 已知氮元素及其化合物的转化关系如下图所示,回答下列问题。_______ 。
(2)反应④的离子方程式为_______ 。理论上如图N2合成1mol硝酸,至少需要氧气共_______ mol。
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为_______ 。
①根据上图得知_______ (填字母)。
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是_______ 。

(2)反应④的离子方程式为
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为
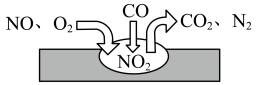

①根据上图得知
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是
您最近半年使用:0次
名校
6 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: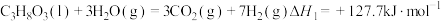
反应Ⅱ: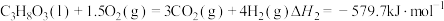
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠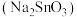 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积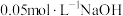 溶液和
溶液和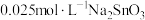 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为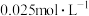 时,氢气产率接近
时,氢气产率接近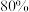 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。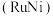 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用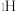 、
、 和
和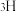 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
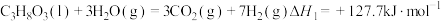
反应Ⅱ:
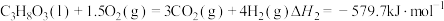
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠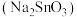 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积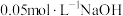 溶液和
溶液和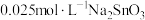 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是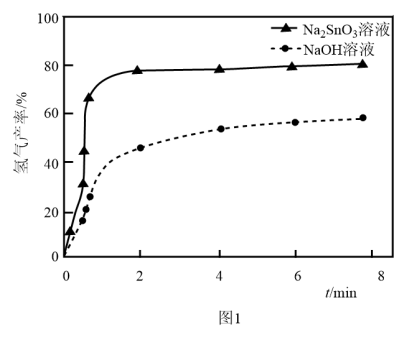
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为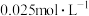 时,氢气产率接近
时,氢气产率接近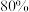 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是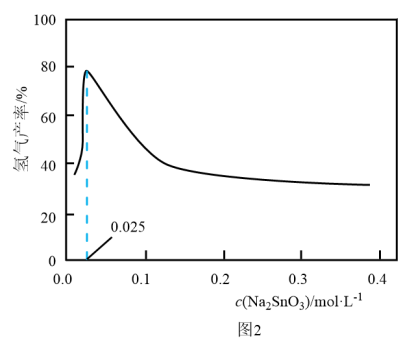
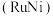 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用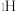 、
、 和
和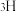 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为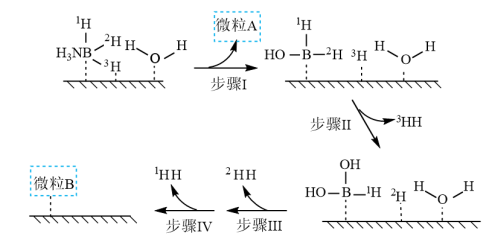
您最近半年使用:0次
名校
解题方法
7 . 处理、回收和利用CO和CO2既能实现资源的综合利用,也是环境科学研究的热点课题。请回答下列问题:
(1)CO处理大气污染物 的相关原理为
的相关原理为 ,
,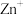 为该反应的催化剂,过程如下:
为该反应的催化剂,过程如下:



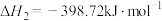
若反应 的正反应的活化能为
的正反应的活化能为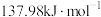 ,则逆反应的活化能为
,则逆反应的活化能为_______  。
。
(2)在容积相同的密闭容器A(起始温度为450℃,恒温)、B(起始温度为450℃,绝热)中分别加入等量的 、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。
、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。_______ (填“m”或“n”)曲线。
(3)已知反应 的速率方程为
的速率方程为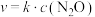 ,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。
,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。
(4)根据阿伦尼乌斯经验公式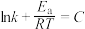 (其中k为速率常数,R、C均为常数,
(其中k为速率常数,R、C均为常数, 为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是
为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是_______ (填“x”或“y”),原因是_______ 。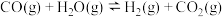 中CO的平衡转化率随
中CO的平衡转化率随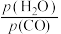 及温度变化关系如下图所示:
及温度变化关系如下图所示: )代替物质的量浓度(
)代替物质的量浓度(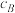 )也可以表示平衡常数(记作
)也可以表示平衡常数(记作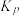 ),则该反应的
),则该反应的
_______ (填表达式,不必代数计算);如果提高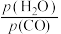 ,则
,则
_______ (填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400℃左右、 ,采用此条件的原因可能是
,采用此条件的原因可能是_______ 。
(1)CO处理大气污染物
 的相关原理为
的相关原理为 ,
,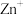 为该反应的催化剂,过程如下:
为该反应的催化剂,过程如下:


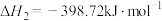
若反应
 的正反应的活化能为
的正反应的活化能为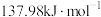 ,则逆反应的活化能为
,则逆反应的活化能为 。
。(2)在容积相同的密闭容器A(起始温度为450℃,恒温)、B(起始温度为450℃,绝热)中分别加入等量的
 、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。
、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。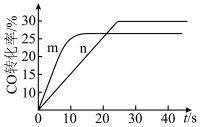
(3)已知反应
 的速率方程为
的速率方程为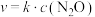 ,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。
,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。A.恒压条件下,通入 | B.恒容条件下,通入CO |
| C.降温 | D.缩小容器体积 |
(4)根据阿伦尼乌斯经验公式
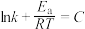 (其中k为速率常数,R、C均为常数,
(其中k为速率常数,R、C均为常数, 为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是
为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是
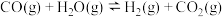 中CO的平衡转化率随
中CO的平衡转化率随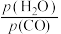 及温度变化关系如下图所示:
及温度变化关系如下图所示: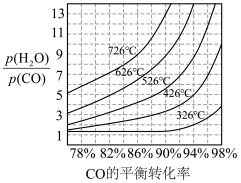
 )代替物质的量浓度(
)代替物质的量浓度(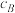 )也可以表示平衡常数(记作
)也可以表示平衡常数(记作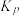 ),则该反应的
),则该反应的
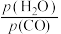 ,则
,则
 ,采用此条件的原因可能是
,采用此条件的原因可能是
您最近半年使用:0次
名校
解题方法
8 . 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①
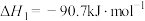

②
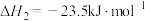

③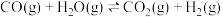
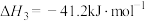

回答下列问题:
(1)反应 的平衡常数K=
的平衡常数K=________ (用 、
、 、
、 表示)。
表示)。
(2)在保持反应物投料不变的情况下,请写出一条提高甲醇产率的措施________ 。
(3)一定温度下,将0.2molCO和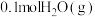 通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得
通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5min内
的体积分数为0.1。则0~5min内
________ ,CO的转化率为________ 。
(4)将合成气以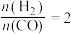 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应:
 ,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是________ (填字母)。 B.
B.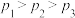 C.若在
C.若在 和316℃时,起始时
和316℃时,起始时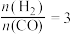 ,则平衡时,α(CO)小于50%
,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和 制备二甲醚(DME)。观察图2,当
制备二甲醚(DME)。观察图2,当 约为
约为________ 时最有利于二甲醚的合成。
①

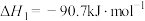

②

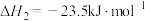

③
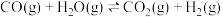
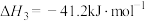

回答下列问题:
(1)反应
 的平衡常数K=
的平衡常数K= 、
、 、
、 表示)。
表示)。(2)在保持反应物投料不变的情况下,请写出一条提高甲醇产率的措施
(3)一定温度下,将0.2molCO和
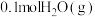 通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得
通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5min内
的体积分数为0.1。则0~5min内
(4)将合成气以
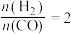 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应:
 ,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图1所示。下列说法正确的是
图1
A. B.
B.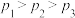 C.若在
C.若在 和316℃时,起始时
和316℃时,起始时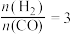 ,则平衡时,α(CO)小于50%
,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和
 制备二甲醚(DME)。观察图2,当
制备二甲醚(DME)。观察图2,当 约为
约为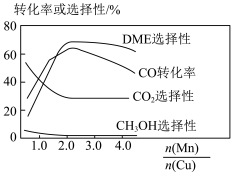
图2
您最近半年使用:0次
名校
解题方法
9 . 化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
(1)汽车排气管内的催化转化器可实现尾气无毒处理。
已知: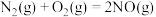


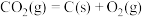
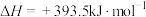 ,则:
,则:
①反应 的
的
________  。
。
②在600K时,将3.0molNO、3.6molCO通入固定容积3L的密闭容器中,20min后,反应达平衡,测得 的浓度为
的浓度为 ,则NO的转化率α=
,则NO的转化率α=________ 。
③若改变下列条件之一,达新平衡时NO的体积分数一定减小的是________ (填序号)。
a.增加CO的量 b.加入催化剂 c.降低温度 d.扩大容器体积
(2)某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
①探究浓度对平衡的影响
已知四氯合钴(Ⅱ)离子(蓝色)与六水合钴(Ⅱ)离子(粉红色)之间存在如下平衡: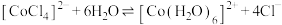 。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为
。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为________ 色;乙同学向溶液中加水,平衡移动方向为________ (填“向右”、“向左”或“不移动”),说明原因________ 。
②运用数字化实验探究压强对平衡的影响
将一收集满干燥 的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。________ 。
(1)汽车排气管内的催化转化器可实现尾气无毒处理。
已知:
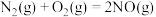


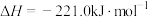
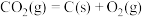
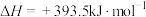 ,则:
,则:①反应
 的
的
 。
。②在600K时,将3.0molNO、3.6molCO通入固定容积3L的密闭容器中,20min后,反应达平衡,测得
 的浓度为
的浓度为 ,则NO的转化率α=
,则NO的转化率α=③若改变下列条件之一,达新平衡时NO的体积分数一定减小的是
a.增加CO的量 b.加入催化剂 c.降低温度 d.扩大容器体积
(2)某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
①探究浓度对平衡的影响
已知四氯合钴(Ⅱ)离子(蓝色)与六水合钴(Ⅱ)离子(粉红色)之间存在如下平衡:
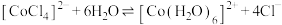 。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为
。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为②运用数字化实验探究压强对平衡的影响
将一收集满干燥
 的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
您最近半年使用:0次
名校
解题方法
10 . 过渡金属氧化物离子(以MO+表示)在烃类的选择性氧化等方面应用广泛。MO+与CH4反应的过程如下图所示。不正确 的是
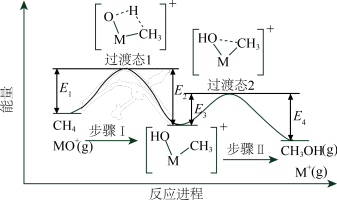
| A.反应速率:步骤I<步骤II |
| B.CH3OH分子中,键角:H—C—H>H—O—C |
| C.若MO+与CH3D反应,生成的氘代甲醇有2种 |
D.CH4(g) + MO+(g)=CH3OH(g) + M+(g)  = E2+E4-E1-E3 = E2+E4-E1-E3 |
您最近半年使用:0次
7日内更新
|
315次组卷
|
3卷引用:江苏省常州市第一中学2023-2024学年高二下学期4月期中考试化学试题
江苏省常州市第一中学2023-2024学年高二下学期4月期中考试化学试题北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(已下线)通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)



