名校
解题方法
1 . 有效去除大气中的NOx和水体中的氮是环境保护的重要课题。
(1)已知:①2CO(g)+O2(g)=2CO2(g);ΔH1=-566.0kJ·mol-1
②N2(g)+2O2(g)=2NO2(g);ΔH2=+64kJ·mol-1
反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g);ΔH3=________ 。
(2)近年研究发现,电催化CO2和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。________ 。
(3)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(NH 和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH
和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH ),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
①生成磷酸铵镁沉淀的离子反应方程式为________ 。
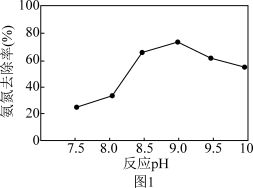
②测得反应pH对氨氮去除率的影响如下图1所示,当pH从7.5增至9.0的过程中,水中氨氮的去除率明显增加,原因是________ 。
①NZVI/BC和(CuPd)/BC复合材料还原硝酸盐的反应机理如下图2所示, 转化为N2或
转化为N2或 的过程可描述为
的过程可描述为________ 。 去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是
去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是________ 。
(1)已知:①2CO(g)+O2(g)=2CO2(g);ΔH1=-566.0kJ·mol-1
②N2(g)+2O2(g)=2NO2(g);ΔH2=+64kJ·mol-1
反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g);ΔH3=
(2)近年研究发现,电催化CO2和含氮物质(
 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。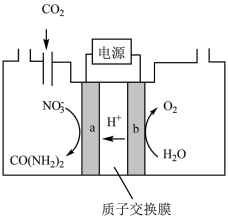
(3)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(NH
 和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH
和NH3)。实验室中模拟氨氮处理:1L的模拟氨氮废水(主要含NH ),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。
),置于搅拌器上,设定反应温度为25℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30min后,取液面下2cm处清液测定氨氮质量浓度。①生成磷酸铵镁沉淀的离子反应方程式为
②测得反应pH对氨氮去除率的影响如下图1所示,当pH从7.5增至9.0的过程中,水中氨氮的去除率明显增加,原因是
①NZVI/BC和(CuPd)/BC复合材料还原硝酸盐的反应机理如下图2所示,
 转化为N2或
转化为N2或 的过程可描述为
的过程可描述为 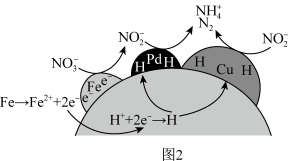
 去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是
去除率的影响如上图3,前200min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是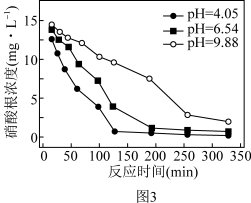
您最近半年使用:0次
2 . 利用化学知识可以合成物质、消除大气污染。
Ⅰ.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物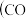 、
、 合成二甲醚。
合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:
①
②
③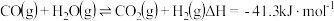
总反应: 的
的
_______ ;一定条件下的密闭容器中,该总反应达到平衡,要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是 _______  填字母代号
填字母代号 。
。
a.高温高压 b.加入催化剂 c.分离出二甲醚 d.增加 的浓度
的浓度
(2)已知反应 某温度下的平衡常数为
某温度下的平衡常数为 ,此温度下,在密闭容器中加入
,此温度下,在密闭容器中加入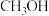 ,反应到某时刻测得各组分的浓度如下:
,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:
_____  填“
填“ ”、“
”、“ ”或“
”或“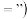 。
。
②若加入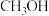 后,经
后,经 反应达到平衡,此时
反应达到平衡,此时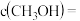
_______ ;该时间内反应速率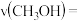
______ 。
Ⅱ.在有氧条件下,新型催化剂 能催化
能催化 与
与 反应生成
反应生成 ,消除烟气中的
,消除烟气中的 污染。
污染。
(3)① 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为_____ 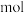 。
。
②将一定比例 、
、 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应
的反应器中反应 装置图
装置图 。
。  的去除率随反应温度的变化曲线如图
的去除率随反应温度的变化曲线如图 所示,在
所示,在 范围内随着温度的升高,
范围内随着温度的升高, 的去除率迅速上升的主要原因是
的去除率迅速上升的主要原因是 ______ ;当反应温度高于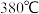 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是 _______ 。
Ⅰ.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物
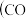 、
、 合成二甲醚。
合成二甲醚。(1)利用水煤气合成二甲醚的三步反应如下:
①

②

③
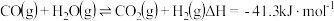
总反应:
 的
的
 的转化率,可以采取的措施是
的转化率,可以采取的措施是  填字母代号
填字母代号 。
。 a.高温高压 b.加入催化剂 c.分离出二甲醚 d.增加
 的浓度
的浓度(2)已知反应
 某温度下的平衡常数为
某温度下的平衡常数为 ,此温度下,在密闭容器中加入
,此温度下,在密闭容器中加入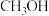 ,反应到某时刻测得各组分的浓度如下:
,反应到某时刻测得各组分的浓度如下: | 物质 | 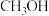 | 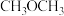 |  |
浓度 |  | 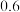 | 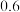 |

 填“
填“ ”、“
”、“ ”或“
”或“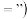 。
。 ②若加入
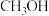 后,经
后,经 反应达到平衡,此时
反应达到平衡,此时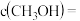
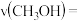
Ⅱ.在有氧条件下,新型催化剂
 能催化
能催化 与
与 反应生成
反应生成 ,消除烟气中的
,消除烟气中的 污染。
污染。 (3)①
 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为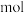 。
。 ②将一定比例
 、
、 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应
的反应器中反应 装置图
装置图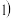 。
。 
 的去除率随反应温度的变化曲线如图
的去除率随反应温度的变化曲线如图 所示,在
所示,在 范围内随着温度的升高,
范围内随着温度的升高, 的去除率迅速上升的主要原因是
的去除率迅速上升的主要原因是 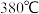 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是 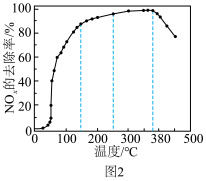
您最近半年使用:0次
3 . 逆水煤气变换反应是一种 转化和利用的重要途径,发生的反应有
转化和利用的重要途径,发生的反应有
反应Ⅰ:
 kJ·mol
kJ·mol
反应Ⅱ:
 kJ⋅mol
kJ⋅mol
反应Ⅲ: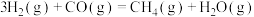

常压下,向密闭容器中投入1 mol 和2 mol
和2 mol  ,达平衡时
,达平衡时 和含碳物质的物质的量随温度的变化如题图所示。下列说法正确的是
和含碳物质的物质的量随温度的变化如题图所示。下列说法正确的是
 转化和利用的重要途径,发生的反应有
转化和利用的重要途径,发生的反应有反应Ⅰ:

 kJ·mol
kJ·mol
反应Ⅱ:

 kJ⋅mol
kJ⋅mol
反应Ⅲ:
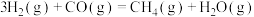

常压下,向密闭容器中投入1 mol
 和2 mol
和2 mol  ,达平衡时
,达平衡时 和含碳物质的物质的量随温度的变化如题图所示。下列说法正确的是
和含碳物质的物质的量随温度的变化如题图所示。下列说法正确的是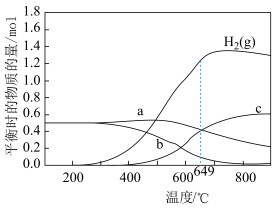
A. kJ⋅mol kJ⋅mol |
B.649℃时,反应Ⅰ的平衡常数 |
C.其他条件不变,在250℃~900℃范围内,随着温度的升高,平衡时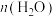 不断增大 不断增大 |
D.800℃时,适当增大体系压强,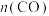 保持不变 保持不变 |
您最近半年使用:0次
名校
4 . 工业及汽车尾气已成为城市空气的主要污染源,研究其反应机理对于环境治理有重要意义。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=___________ kJ/mol。
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。___________ 。
②反应过程图中,虚线方框里的过程可描述为___________ 。
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是___________ 。
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和___________ 。(填化学式)
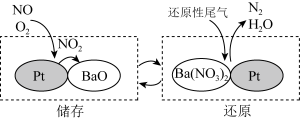
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。___________ 。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。
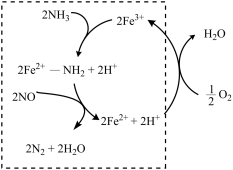
②反应过程图中,虚线方框里的过程可描述为
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当
 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是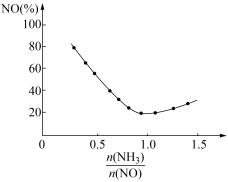
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。
您最近半年使用:0次
名校
5 . 完成下列填空:
(1) 气态高能燃料乙硼烷
气态高能燃料乙硼烷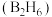 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:___________ ;
(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应:
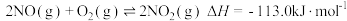 ①
①
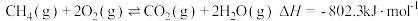 ②
②
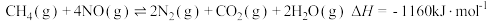 ③
③
则反应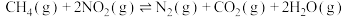 的
的
___________ 。
(3)天然气的一个重要用途是制取 ,其原理为:
,其原理为: 。
。
①该反应的平衡常数表达式为___________ 。
②在密闭容器中通入物质的量浓度均为 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1_______ P2(填"大于”或“小于”);压强为 时,在
时,在 点:v(正)
点:v(正)______ v(逆)(填“大于”、“小于”或“等于”)。 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明, 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是___________ 。240℃以后,随着温度的升高, 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是___________ 。 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:
Ⅰ:
Ⅱ:
当 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是___________ 。
(1)
 气态高能燃料乙硼烷
气态高能燃料乙硼烷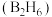 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为
 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应: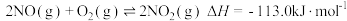 ①
①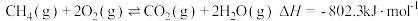 ②
②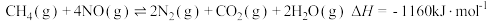 ③
③则反应
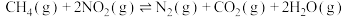 的
的
(3)天然气的一个重要用途是制取
 ,其原理为:
,其原理为: 。
。①该反应的平衡常数表达式为
②在密闭容器中通入物质的量浓度均为
 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1 时,在
时,在 点:v(正)
点:v(正)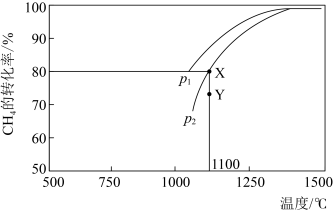
 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明, 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是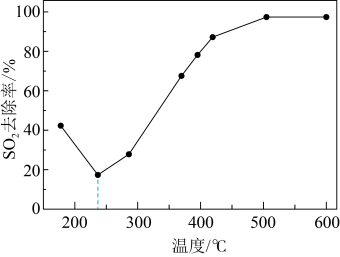
 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:Ⅰ:

Ⅱ:

当
 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是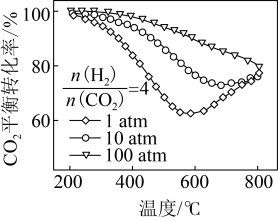
您最近半年使用:0次
6 . 合成是转化的一种应用,甲醇作为一种可再生能源,工业上一般采用下列两种反应合成甲醇:
反应一:CO(g)+2H2(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
反应二:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
(1)相同条件下,反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3,则ΔH3=
CO(g)+H2O(g) ΔH3,则ΔH3=___________ (用ΔH1和ΔH2表示)。
(2)下表所列数据是反应CO(g)+2H2(g) CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
①此反应的ΔH1___________ 0,ΔS___________ 0.(填“>”“=”或“<”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率是___________ ,此时的温度是___________ 。
③要提高CO的转化率,可以采取的措施是___________ 。
A.升温 B.恒容充入CO C.恒容充入H2 D.恒压充入惰性气体 E.分离出甲醇
(3)在水溶液中电解CO2生成甲醇的原理如图所示。___________ 。
②A极生成1mol甲醇时,B极生成气体在标准状况下的体积是___________ 。
反应一:CO(g)+2H2(g)
 CH3OH(g)ΔH1
CH3OH(g)ΔH1反应二:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2(1)相同条件下,反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3,则ΔH3=
CO(g)+H2O(g) ΔH3,则ΔH3=(2)下表所列数据是反应CO(g)+2H2(g)
 CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。| 温度/℃ | 250 | 300 | 350 |
| 平衡常数(K) | 2.04 | 0.27 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率是
③要提高CO的转化率,可以采取的措施是
A.升温 B.恒容充入CO C.恒容充入H2 D.恒压充入惰性气体 E.分离出甲醇
(3)在水溶液中电解CO2生成甲醇的原理如图所示。

②A极生成1mol甲醇时,B极生成气体在标准状况下的体积是
您最近半年使用:0次
名校
7 . 乙苯被吸附在催化剂表面发生脱氢可生成苯乙烯、苯甲醛等,生成苯乙烯的相关反应如下。
反应1: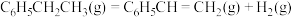
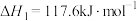
反应2:

反应3:
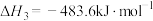
(1)反应4:
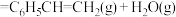

___________  。
。
(2)较低温度下,向乙苯脱氢的反应体系中加入少量 ,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是
,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是___________ 。
(3)向乙苯脱氢反应体系中加入 ,乙苯转化率与体系中
,乙苯转化率与体系中 分压强的关系如图1所示。随
分压强的关系如图1所示。随 的增加,乙苯转化率先增大后减小的可能原因为
的增加,乙苯转化率先增大后减小的可能原因为___________ 。 ,MgO催化剂表面进行
,MgO催化剂表面进行 的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。
的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。___________ ,反应一段时间后,催化剂活性有所下降,原因可能有反应过程产生的积碳覆盖在活性中心表面和___________ 。
②简述转化II的作用___________ 。
反应1:
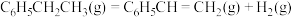
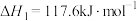
反应2:


反应3:

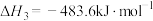
(1)反应4:

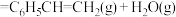

 。
。(2)较低温度下,向乙苯脱氢的反应体系中加入少量
 ,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是
,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是(3)向乙苯脱氢反应体系中加入
 ,乙苯转化率与体系中
,乙苯转化率与体系中 分压强的关系如图1所示。随
分压强的关系如图1所示。随 的增加,乙苯转化率先增大后减小的可能原因为
的增加,乙苯转化率先增大后减小的可能原因为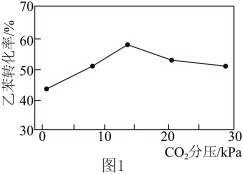
 ,MgO催化剂表面进行
,MgO催化剂表面进行 的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。
的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。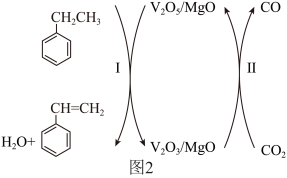
②简述转化II的作用
您最近半年使用:0次
名校
解题方法
8 . 在一定条件下CO2催化加氢生成CH3OH,主要发生三个竞争反应:
反应I:
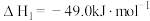
反应Ⅱ:
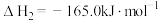
反应ⅡI: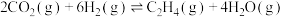
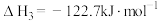
为分析催化剂对反应的选择性,在1L恒容密闭容器中充入一定量的CO2和H2,测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示,下列说法不正确的是
反应I:

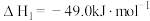
反应Ⅱ:

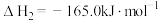
反应ⅡI:
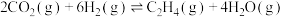
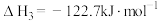
为分析催化剂对反应的选择性,在1L恒容密闭容器中充入一定量的CO2和H2,测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示,下列说法不正确的是

A.  |
| B.其他条件不变,增大H2用量,反应I速率增大,平衡常数增大 |
| C.一定温度下,当容器中的气体压强不再改变时,体系达到平衡 |
| D.温度过高,三种含碳产物的物质的量会迅速降低,可能原因是催化剂活性降低 |
您最近半年使用:0次
解题方法
9 .  是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
(1)实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为:
,其实验过程可表示为:

在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成
气体,生成 ,反应为
,反应为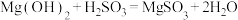 ,其平衡常数K与
,其平衡常数K与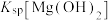 、
、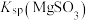 、
、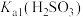 、
、 的代数关系式为
的代数关系式为
______ ;下列实验操作一定能提高氧化镁浆料吸收 效率的有
效率的有______ (填序号)。
A.水浴加热氧化镁浆料 B.加快搅拌速率
C.降低通入 气体的速率 D.通过多孔球泡向氧化镁浆料中通
气体的速率 D.通过多孔球泡向氧化镁浆料中通
(2)烟气中 可以用“亚硫酸铵吸收法”处理。
可以用“亚硫酸铵吸收法”处理。
①吸收时发生反应的化学方程式为______ 。
②测得25℃时溶液pH与各组份物质的量分数的变化关系如下左图所示,b点时溶液pH=7,则
______ 。

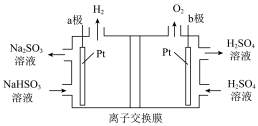
(3)电解法脱硫:用 溶液吸收
溶液吸收 气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂
气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂_______ 的循环利用。
(4)①图中a由极要连接电源的填______ (“正”或“负”)极。
②电解装置中使用______ (阳离子或阴离子)交换膜。
 是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。(1)实验室模拟“镁法工业烟气脱硫”并制备
 ,其实验过程可表示为:
,其实验过程可表示为:
在搅拌下向氧化镁浆料中匀速缓慢通入
 气体,生成
气体,生成 ,反应为
,反应为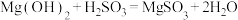 ,其平衡常数K与
,其平衡常数K与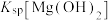 、
、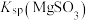 、
、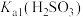 、
、 的代数关系式为
的代数关系式为
 效率的有
效率的有A.水浴加热氧化镁浆料 B.加快搅拌速率
C.降低通入
 气体的速率 D.通过多孔球泡向氧化镁浆料中通
气体的速率 D.通过多孔球泡向氧化镁浆料中通
(2)烟气中
 可以用“亚硫酸铵吸收法”处理。
可以用“亚硫酸铵吸收法”处理。①吸收时发生反应的化学方程式为
②测得25℃时溶液pH与各组份物质的量分数的变化关系如下左图所示,b点时溶液pH=7,则



(3)电解法脱硫:用
 溶液吸收
溶液吸收 气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂
气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂(4)①图中a由极要连接电源的填
②电解装置中使用
您最近半年使用:0次
名校
10 . 我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将 转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用
转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用 发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.

Ⅱ.

回答下列问题:
(1)已知:
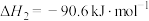 ,则
,则 为
为_________ 。
(2)向密闭容器中加入 (g)和
(g)和 (g)合成
(g)合成 (g)。已知反应Ⅰ的正反应速率可表示为
(g)。已知反应Ⅰ的正反应速率可表示为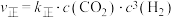 ,逆反应速率可表示为
,逆反应速率可表示为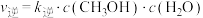 ,其中
,其中 、
、 为速率常数。
为速率常数。
①如图中能够代表 的曲线为
的曲线为_________ 。(填“ ”、“
”、“ ”、“
”、“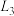 ”或“
”或“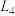 ”)。
”)。
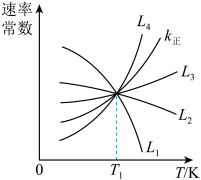
②温度为 时,反应Ⅰ的化学平衡常数K=
时,反应Ⅰ的化学平衡常数K=_________ 。
③对于上述反应体系,下列说法正确的是_________ 。
A.增大 的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂, 的平衡转化率不变
的平衡转化率不变
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
D.将水液化分离出来,既可以加快反应速率,又能提高 的转化率
的转化率
(3)不同条件下,按照 投料,
投料, 的平衡转化率如下图所示。
的平衡转化率如下图所示。
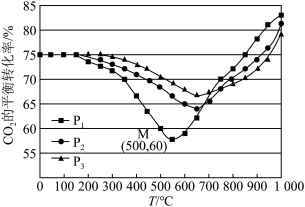
①压强 、
、 、
、 由大到小的顺序是
由大到小的顺序是_________ ,在 压强下,200℃~550℃时反应以
压强下,200℃~550℃时反应以_________ (填“Ⅰ”或“Ⅱ”)为主。
②压强为 时,温度高于660℃之后,随着温度升高
时,温度高于660℃之后,随着温度升高 平衡转化率增大的原因
平衡转化率增大的原因_____________ 。
 转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用
转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用 发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。Ⅰ.


Ⅱ.


回答下列问题:
(1)已知:

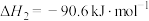 ,则
,则 为
为(2)向密闭容器中加入
 (g)和
(g)和 (g)合成
(g)合成 (g)。已知反应Ⅰ的正反应速率可表示为
(g)。已知反应Ⅰ的正反应速率可表示为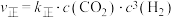 ,逆反应速率可表示为
,逆反应速率可表示为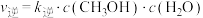 ,其中
,其中 、
、 为速率常数。
为速率常数。①如图中能够代表
 的曲线为
的曲线为 ”、“
”、“ ”、“
”、“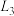 ”或“
”或“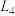 ”)。
”)。
②温度为
 时,反应Ⅰ的化学平衡常数K=
时,反应Ⅰ的化学平衡常数K=③对于上述反应体系,下列说法正确的是
A.增大
 的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
的浓度,反应Ⅰ、Ⅱ的正反应速率均增加B.加入催化剂,
 的平衡转化率不变
的平衡转化率不变C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
D.将水液化分离出来,既可以加快反应速率,又能提高
 的转化率
的转化率(3)不同条件下,按照
 投料,
投料, 的平衡转化率如下图所示。
的平衡转化率如下图所示。
①压强
 、
、 、
、 由大到小的顺序是
由大到小的顺序是 压强下,200℃~550℃时反应以
压强下,200℃~550℃时反应以②压强为
 时,温度高于660℃之后,随着温度升高
时,温度高于660℃之后,随着温度升高 平衡转化率增大的原因
平衡转化率增大的原因
您最近半年使用:0次



