在一定条件下CO2催化加氢生成CH3OH,主要发生三个竞争反应:
反应I:
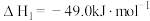
反应Ⅱ:
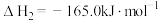
反应ⅡI: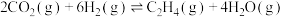
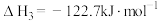
为分析催化剂对反应的选择性,在1L恒容密闭容器中充入一定量的CO2和H2,测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示,下列说法不正确的是
反应I:

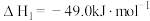
反应Ⅱ:

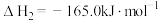
反应ⅡI:
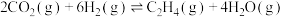
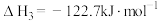
为分析催化剂对反应的选择性,在1L恒容密闭容器中充入一定量的CO2和H2,测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示,下列说法不正确的是

A.  |
| B.其他条件不变,增大H2用量,反应I速率增大,平衡常数增大 |
| C.一定温度下,当容器中的气体压强不再改变时,体系达到平衡 |
| D.温度过高,三种含碳产物的物质的量会迅速降低,可能原因是催化剂活性降低 |
更新时间:2024-04-10 12:17:54
|
相似题推荐
【推荐1】我国利用合成气直接制取烯烃获重大突破,其原理是
反应①:

反应②: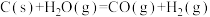

反应③:
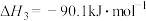
反应④:
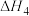
能量变化如图所示
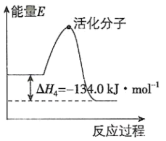
反应⑤:

下列说法正确的是
反应①:


反应②:
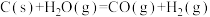

反应③:

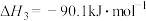
反应④:

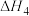
能量变化如图所示

反应⑤:


下列说法正确的是
A.反应③使用催化剂, 减小 减小 |
B. |
| C.反应④中正反应的活化能(反应物转化为活化分子所吸收的能量)大于逆反应的活化能 |
D.  |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知热化学方程式:
①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )
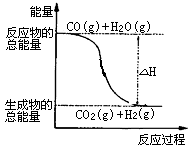
①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )

| A.H2的燃烧热为241.8kJ·mol-1 |
| B.由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1 |
| C.H2(g)转变成H2O(g)的化学反应一定要放出能量 |
| D.根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】已知:①2CO(g)+O2(g)=2CO2(g) ΔH= —566 kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH= —226 kJ/mol
O2(g) ΔH= —226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
②Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) ΔH= —226 kJ/mol
O2(g) ΔH= —226 kJ/mol根据以上热化学方程式判断,下列说法正确的是
| A.CO的燃烧热为283 kJ |
| B.反应②一定能自发进行 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH > —452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】偶联反应是合成芳胺的重要方法,反应机理如图(图中Ar表示芳香烃基,……→表示为副反应)。下列说法正确的是
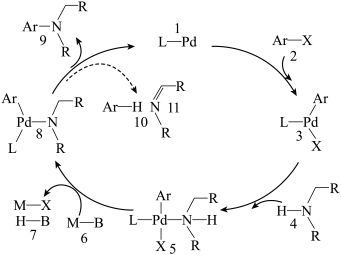
| A.该体系中1、3、5和8都是中间体 |
B.理论上1mol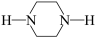 最多能消耗1mol 最多能消耗1mol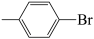 |
| C.该变化过程中涉及到的有机反应类型仅限于取代反应 |
D.若原料用 和 和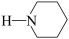 ,则可能得到的产物为 ,则可能得到的产物为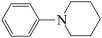 、 、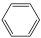 和 和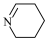 |
您最近一年使用:0次
【推荐2】一种以沸石笼为载体对NO进行催化还原的原理如图所示。下列说法正确的是
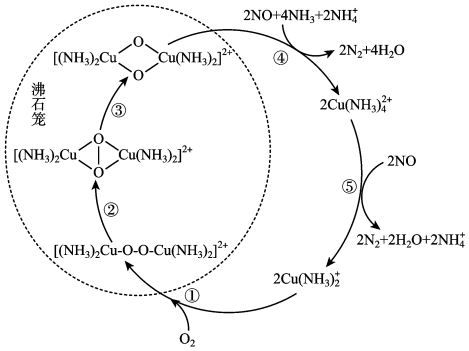

| A.反应③为氧化还原反应 |
| B.反应④中涉及非极性键的断裂和生成 |
| C.反应⑤中转移2mol电子时,有1molNO参与反应 |
D.总反应的化学方程式可表示为4NH3+4NO+O2 4N2+6H2O 4N2+6H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】根据下列图示所得出的结论正确的是
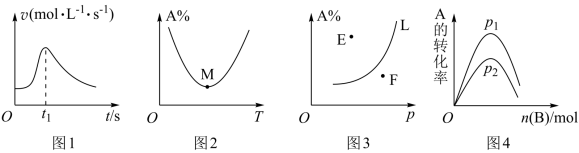

| A.图1是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高 |
| B.图2是A+B⇌C中A的百分含量随温度变化的曲线,说明该反应是放热反应 |
| C.图3是对于反应mA(g)+nB(g)⇌pC(g),当其他条件一定时A的百分含量随压强变化的图象,其中E点v正<v逆 |
| D.图4是对于反应A(g)+B(g)⇌2C(g)达平衡时,在一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点,研究表明,二氧化碳与氢气在某催化剂作用下可以合成甲醇,该反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H,恒压下,CO2和H2的起始物质的量之比为1:3时,甲醇平衡产率与温度的关系如图所示。下列说法错误的是
CH3OH(g)+H2O(g) △H,恒压下,CO2和H2的起始物质的量之比为1:3时,甲醇平衡产率与温度的关系如图所示。下列说法错误的是
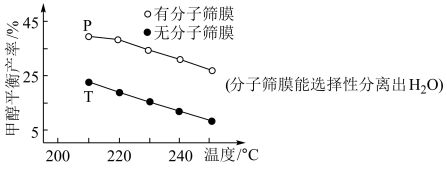
 CH3OH(g)+H2O(g) △H,恒压下,CO2和H2的起始物质的量之比为1:3时,甲醇平衡产率与温度的关系如图所示。下列说法错误的是
CH3OH(g)+H2O(g) △H,恒压下,CO2和H2的起始物质的量之比为1:3时,甲醇平衡产率与温度的关系如图所示。下列说法错误的是
| A.△H<0 |
| B.加入催化剂有利于提高二氧化碳的平衡转化率 |
| C.增大二氧化碳和氢气的初始投料比,可提高氢气的平衡转化率 |
| D.甲醇的产率P点高于T点的原因是P点有水分子筛膜,分离出水,有利于平衡正向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】图像是学习化学的重要工具,下列有关图像的分析正确的是
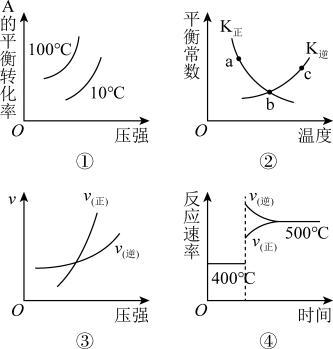

A.图①可以表示反应  |
B.图②表示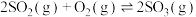  ,a、b、c中只有b点达到化学平衡状态 ,a、b、c中只有b点达到化学平衡状态 |
C.图③可以表示反应  的反应速率随压强变化的关系 的反应速率随压强变化的关系 |
D.图④可以表示反应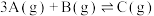  ,平衡后升高温度,反应速率随时间变化的图像 ,平衡后升高温度,反应速率随时间变化的图像 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
| A.反应达平衡时,X的转化率为50% |
B.反应可表示为:X+3Y 2Z,其平衡常数为1 600 2Z,其平衡常数为1 600 |
| C.改变压强可以改变此反应的平衡常数 |
| D.改变温度可以改变此反应的平衡常数 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在0.1mol·L-1的HA溶液中存在如下电离平衡: 。下列叙述正确的是
。下列叙述正确的是
 。下列叙述正确的是
。下列叙述正确的是| A.向HA溶液中通入少量HCl气体,平衡逆向移动,溶液中c(H+)减小 |
| B.c(H+)相同,体积相同的HA溶液和盐酸,分别与等浓度的氢氧化钠溶液反应,消耗的氢氧化钠溶液一样多 |
| C.等浓度的HA溶液与盐酸分别与质量大小、形状相同的锌片反应,盐酸与Zn反应的初始速率快 |
| D.向HA溶液中加入少量NaA固体,c(A-)增大,Ka增大 |
您最近一年使用:0次

 2Z(g)的平衡状态下,保持恒温恒容向容器中加入一定量的Y,下列说法正确的是(K为平衡常数,Q为浓度熵)
2Z(g)的平衡状态下,保持恒温恒容向容器中加入一定量的Y,下列说法正确的是(K为平衡常数,Q为浓度熵)

