解题方法
1 .  是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
(1)实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为:
,其实验过程可表示为:

在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成
气体,生成 ,反应为
,反应为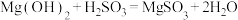 ,其平衡常数K与
,其平衡常数K与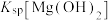 、
、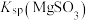 、
、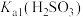 、
、 的代数关系式为
的代数关系式为
______ ;下列实验操作一定能提高氧化镁浆料吸收 效率的有
效率的有______ (填序号)。
A.水浴加热氧化镁浆料 B.加快搅拌速率
C.降低通入 气体的速率 D.通过多孔球泡向氧化镁浆料中通
气体的速率 D.通过多孔球泡向氧化镁浆料中通
(2)烟气中 可以用“亚硫酸铵吸收法”处理。
可以用“亚硫酸铵吸收法”处理。
①吸收时发生反应的化学方程式为______ 。
②测得25℃时溶液pH与各组份物质的量分数的变化关系如下左图所示,b点时溶液pH=7,则
______ 。

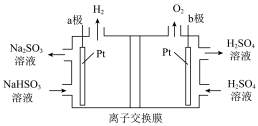
(3)电解法脱硫:用 溶液吸收
溶液吸收 气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂
气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂_______ 的循环利用。
(4)①图中a由极要连接电源的填______ (“正”或“负”)极。
②电解装置中使用______ (阳离子或阴离子)交换膜。
 是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。(1)实验室模拟“镁法工业烟气脱硫”并制备
 ,其实验过程可表示为:
,其实验过程可表示为:
在搅拌下向氧化镁浆料中匀速缓慢通入
 气体,生成
气体,生成 ,反应为
,反应为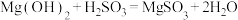 ,其平衡常数K与
,其平衡常数K与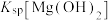 、
、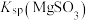 、
、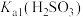 、
、 的代数关系式为
的代数关系式为
 效率的有
效率的有A.水浴加热氧化镁浆料 B.加快搅拌速率
C.降低通入
 气体的速率 D.通过多孔球泡向氧化镁浆料中通
气体的速率 D.通过多孔球泡向氧化镁浆料中通
(2)烟气中
 可以用“亚硫酸铵吸收法”处理。
可以用“亚硫酸铵吸收法”处理。①吸收时发生反应的化学方程式为
②测得25℃时溶液pH与各组份物质的量分数的变化关系如下左图所示,b点时溶液pH=7,则



(3)电解法脱硫:用
 溶液吸收
溶液吸收 气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂
气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂(4)①图中a由极要连接电源的填
②电解装置中使用
您最近半年使用:0次
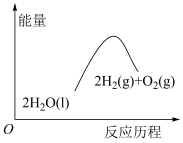
2 . 下列与t℃时反应: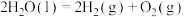
 相关的说法,正确的是
相关的说法,正确的是
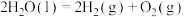
 相关的说法,正确的是
相关的说法,正确的是
A. |
B.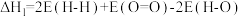 (E表示键能) (E表示键能) |
| C.上图能表示反应物与生成物总能量的相对关系 |
D.t℃时, 的燃烧热 的燃烧热 |
您最近半年使用:0次
3 . 化学与社会、生产密切相关,下列说法不正确 的是
| A.对于一个化学反应,反应的途径有可能不同,但其焓变一定相同 |
| B.氧化还原反应所释放的化学能,是化学电源的主要能量来源 |
| C.标准燃烧热的数值与该物质燃烧时的热化学方程式中的计量数成正比 |
| D.新能源汽车的使用和推广,将有助于促进我国的“碳达峰”“碳中和”任务的完成 |
您最近半年使用:0次
名校
4 . 工业上常采用氨氧化法制硝酸,其流程是将氨和空气混合后通入灼热的铂铑合金网,反应生成NO(g),生成的一氧化氮与残余的氧气继续反应生成二氧化氮:2NO(g)+O2(g) = 2NO2(g);ΔH = -116.4 kJ·mol-1。随后将二氧化氮通入水中制取硝酸。对于反应2NO(g)+O2(g)  2NO2(g),下列说法正确的是
2NO2(g),下列说法正确的是
 2NO2(g),下列说法正确的是
2NO2(g),下列说法正确的是| A.该反应能够自发的原因是ΔS > 0 |
| B.工业上使用合适的催化剂可提高NO2的生产效率 |
| C.升高温度,该反应V(逆)减小,V(正)增大,平衡向逆反应方向移动 |
| D.2 mol NO(g)和1 mol O2(g)中所含化学键能总和比2 mol NO2(g)中大116.4 kJ·mol-1 |
您最近半年使用:0次
解题方法
5 . 我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用CO2发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
回答下列问题:
(1)①已知:CO(g)+2H2(g) CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为
CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为___________ 。
②一定条件下反应Ⅱ能自发进行原因是___________ 。
(2)向密闭容器中加入CO2(g)和H2(g)合成CH3OH(g)。已知反应Ⅰ的正反应速率可表示为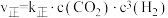 ,逆反应速率可表示为
,逆反应速率可表示为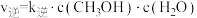 ,其中K正、K逆为速率常数。
,其中K正、K逆为速率常数。
①如图中能够代表k逆的曲线为___________ 。(填“L1”、“L2”、“L3”或“L4”)。
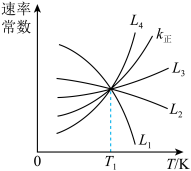
②温度为T1时,反应Ⅰ的化学平衡常数K=___________ 。
③对于上述反应体系,下列说法正确的是___________ 。
A.增大CO2的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂,H2的平衡转化率不变
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
(3)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如下图所示。
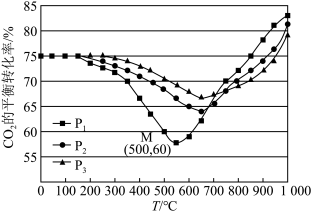
①压强P1、P2、P3由大到小的顺序是___________ ,在P1压强下,200℃~550℃时反应以___________ (填“Ⅰ”或“Ⅱ”)为主,原因是___________ 。
②压强为P2时,温度高于660℃之后,随着温度升高CO2平衡转化率增大的原因___________ 。
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1回答下列问题:
(1)①已知:CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为
CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为②一定条件下反应Ⅱ能自发进行原因是
(2)向密闭容器中加入CO2(g)和H2(g)合成CH3OH(g)。已知反应Ⅰ的正反应速率可表示为
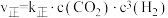 ,逆反应速率可表示为
,逆反应速率可表示为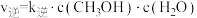 ,其中K正、K逆为速率常数。
,其中K正、K逆为速率常数。①如图中能够代表k逆的曲线为

②温度为T1时,反应Ⅰ的化学平衡常数K=
③对于上述反应体系,下列说法正确的是
A.增大CO2的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂,H2的平衡转化率不变
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
(3)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如下图所示。

①压强P1、P2、P3由大到小的顺序是
②压强为P2时,温度高于660℃之后,随着温度升高CO2平衡转化率增大的原因
您最近半年使用:0次
6 . 下列实验方案不能达到实验目的的是
| 选项 | A | B | C | D |
| 实验方案 | 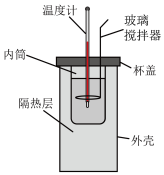 | 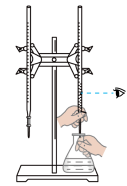 | 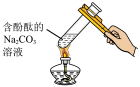 加热后溶液红色加深 | 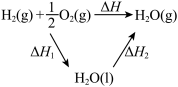 测得ΔH为ΔH1、ΔH2的和 |
| 实验目的 | 用于在实验室测定中和反应的反应热 | 用已知浓度的HCl溶液滴定未知浓度的NaOH溶液 | 验证温度对水解平衡的影响 | 验证ΔH与物质的始末状态有关,与反应过程无关 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
7 . 吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。
(1)纯碱法。以纯碱为原料吸收SO2可制备无水NaHSO3,主要流程如下:

室温下,已知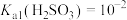 ,
,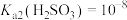 ,
, ,
,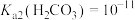 。向Na2CO3溶液通入SO2的过程中,溶液中有关组分的质量分数变化如图所示。
。向Na2CO3溶液通入SO2的过程中,溶液中有关组分的质量分数变化如图所示。
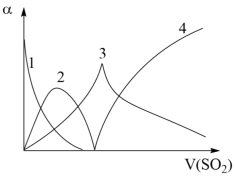
①曲线3代表的组分化学式为___________ 。
②室温下,纯碱溶液和母液恰好中和所得混合溶液的pH___________ (填“<”、“=”、“>”)7。
③“吸收”过程中发生反应的离子方程式为___________ 、___________ 。
(2)石灰石法:其中涉及的主要反应如下:
Ⅰ. ;
;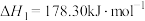
Ⅱ.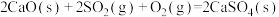 ;
;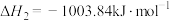
Ⅲ.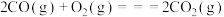 ;
;
Ⅳ. ;
;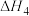
①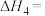
___________ 。
②在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),分析其原因:___________ 。
③利用 和浓氨水的混合溶液浸取CaSO4可回收得到CaCO3。浸取时:向
和浓氨水的混合溶液浸取CaSO4可回收得到CaCO3。浸取时:向 中加入适量浓氨水的目的是
中加入适量浓氨水的目的是___________ ;浸取温度控制在60∼70℃的原因是___________ 。
(1)纯碱法。以纯碱为原料吸收SO2可制备无水NaHSO3,主要流程如下:

室温下,已知
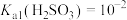 ,
,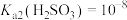 ,
, ,
,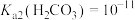 。向Na2CO3溶液通入SO2的过程中,溶液中有关组分的质量分数变化如图所示。
。向Na2CO3溶液通入SO2的过程中,溶液中有关组分的质量分数变化如图所示。
①曲线3代表的组分化学式为
②室温下,纯碱溶液和母液恰好中和所得混合溶液的pH
③“吸收”过程中发生反应的离子方程式为
(2)石灰石法:其中涉及的主要反应如下:
Ⅰ.
 ;
;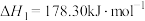
Ⅱ.
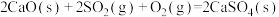 ;
;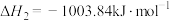
Ⅲ.
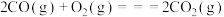 ;
;
Ⅳ.
 ;
;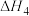
①
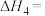
②在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),分析其原因:
③利用
 和浓氨水的混合溶液浸取CaSO4可回收得到CaCO3。浸取时:向
和浓氨水的混合溶液浸取CaSO4可回收得到CaCO3。浸取时:向 中加入适量浓氨水的目的是
中加入适量浓氨水的目的是
您最近半年使用:0次
名校
解题方法
8 . 完成下列问题
(1)工厂烟气(主要污染物 、
、 )直接排放会造成空气污染,需处理后才能排放。用
)直接排放会造成空气污染,需处理后才能排放。用 氧化。
氧化。 氧化过程中部分反应的能量变化如图所示。
氧化过程中部分反应的能量变化如图所示。
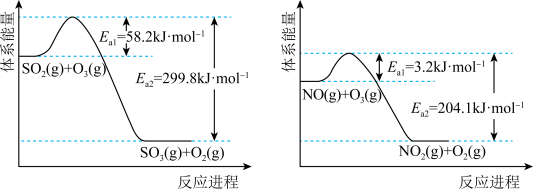
①已知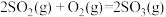
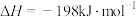 。则
。则 转化为
转化为 的热化学方程式为
的热化学方程式为___________ 。
②其他条件不变时,反应过渡态所需能量越高,反应越难进行,速率越慢。增加 ,
, 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是_______ 。
(2)利用如图1装置可将 转化为
转化为 ,变废为宝,分别在两极通入
,变废为宝,分别在两极通入 和
和 ,溶液中
,溶液中 向
向______ 极(填“A”或“B”)移动,请写出正极的电极反应式为_______ ,该电池总反应方程式为_______ 。
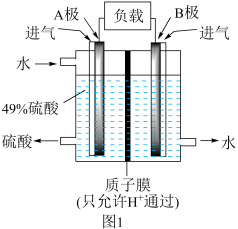
(3)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图2所示(均为石墨电极),电解过程中NO转化为硝酸,请写出阳极的电极反应式为_______ ;电解总反应方程式为______ 。
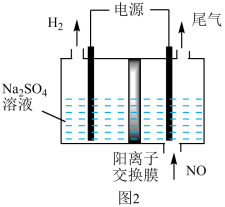
(4)电解产生的氢气在标准状况下的体积为33.6L,生成的稀硝酸和足量的硫酸混合最多可溶解的铜的质量为______ 。(写出计算过程)
(1)工厂烟气(主要污染物
 、
、 )直接排放会造成空气污染,需处理后才能排放。用
)直接排放会造成空气污染,需处理后才能排放。用 氧化。
氧化。 氧化过程中部分反应的能量变化如图所示。
氧化过程中部分反应的能量变化如图所示。
①已知
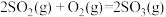
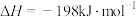 。则
。则 转化为
转化为 的热化学方程式为
的热化学方程式为②其他条件不变时,反应过渡态所需能量越高,反应越难进行,速率越慢。增加
 ,
, 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是(2)利用如图1装置可将
 转化为
转化为 ,变废为宝,分别在两极通入
,变废为宝,分别在两极通入 和
和 ,溶液中
,溶液中 向
向
(3)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图2所示(均为石墨电极),电解过程中NO转化为硝酸,请写出阳极的电极反应式为

(4)电解产生的氢气在标准状况下的体积为33.6L,生成的稀硝酸和足量的硫酸混合最多可溶解的铜的质量为
您最近半年使用:0次
名校
9 . 完成下列问题
(1)已知:①

②

则

___________ 。
(2)已知:①

②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

 ,则a=
,则a=___________ 。
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(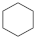 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是___________ ;反应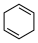 (l)=
(l)=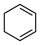 (l)的
(l)的
___________ 。

(1)已知:①


②


则


(2)已知:①


②


则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)= (l)的
(l)的

您最近半年使用:0次
10 . 研发二氧化碳的利用技术具有重要意义。
(1) 还原
还原 是实现“双碳”经济的有效途径之一,相关反应有:
是实现“双碳”经济的有效途径之一,相关反应有:
反应Ⅰ:


反应Ⅱ:


反应Ⅲ:


则反应 的
的
___________ 。
(2)利用电解法在碱性或酸性条件下将 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示:
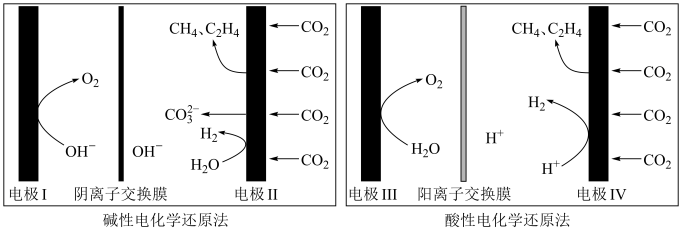
已知:选择性(S)和法拉第效率(FE)的定义(X代表 或
或 )如下:
)如下:
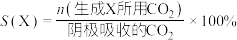
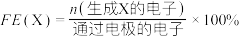
①写出碱性条件下 生成
生成 的电极反应式:
的电极反应式:___________ 。
②实验测得,碱性条件生成 、
、 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是___________ 。
③实验测得,酸性条件生成 、
、 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是___________ 。
④碱性条件下反应一段时间,实验测得 、
、 的选择性及
的选择性及 的法拉第效率如下表所示。则
的法拉第效率如下表所示。则 的法拉第效率
的法拉第效率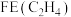 为
为___________ 。
(1)
 还原
还原 是实现“双碳”经济的有效途径之一,相关反应有:
是实现“双碳”经济的有效途径之一,相关反应有:反应Ⅰ:



反应Ⅱ:



反应Ⅲ:



则反应
 的
的
(2)利用电解法在碱性或酸性条件下将
 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示:
已知:选择性(S)和法拉第效率(FE)的定义(X代表
 或
或 )如下:
)如下: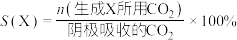
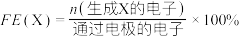
①写出碱性条件下
 生成
生成 的电极反应式:
的电极反应式:②实验测得,碱性条件生成
 、
、 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是③实验测得,酸性条件生成
 、
、 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是④碱性条件下反应一段时间,实验测得
 、
、 的选择性及
的选择性及 的法拉第效率如下表所示。则
的法拉第效率如下表所示。则 的法拉第效率
的法拉第效率 为
为 |  | |
 | 2% | 8% |
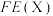 | 12.5% |
您最近半年使用:0次
2024-02-24更新
|
243次组卷
|
2卷引用:江苏省 徐州市第七中学2023-2024学年高三上学期12月月考化学试题



