名校
1 . 回答下列问题:
(1)实验测得16 g甲醇气体(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.5 kJ的热量,试写出甲醇标准燃烧热的热化学方程式:_______ 。
(2)已知:
已知反应:N2(g)+3H2(g)⇌2NH3(g) ΔH=a kJ·mol-1。试根据表中所列键能数据估算a的值为_______ 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时2C(s,石墨) + H2(g)= C2H2(g) ΔH=_______ kJ·mol-1
(4)电化学技术是有效解决 CO、SO2、NOx等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :

①电解质溶液中SO 向
向_______ (填“A极”或“B极” )移动。
②请写出负极反应式:_______ 。
③用该原电池做电源,石墨做电极电解2L AgNO3溶液,写出阳极的电极反应式:_______ 。通电一段时间,两极均产生2.24 L(标准状况)气体,则电解过程中共转移电子_______ mol。
(5)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。2Mn(OH)2 + O2=2MnO(OH)2
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O +I2=2I-+S4O
+I2=2I-+S4O )。
)。
回答下列问题:
①固氧后的水样酸化时发生反应的离子方程式为_______ 。
②取100.00 mL水样经固氧、酸化后,用a mol·L-1 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为_______ ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_______ mg·L-1。
(1)实验测得16 g甲醇气体(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.5 kJ的热量,试写出甲醇标准燃烧热的热化学方程式:
(2)已知:
| 化学键 | H—H | N—H | N≡N |
| 键能/(kJ·mol-1) | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时2C(s,石墨) + H2(g)= C2H2(g) ΔH=
(4)电化学技术是有效解决 CO、SO2、NOx等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :

①电解质溶液中SO
 向
向②请写出负极反应式:
③用该原电池做电源,石墨做电极电解2L AgNO3溶液,写出阳极的电极反应式:
(5)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。2Mn(OH)2 + O2=2MnO(OH)2
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O
 +I2=2I-+S4O
+I2=2I-+S4O )。
)。回答下列问题:
①固氧后的水样酸化时发生反应的离子方程式为
②取100.00 mL水样经固氧、酸化后,用a mol·L-1 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为
您最近一年使用:0次
解题方法
2 . CO2与人类息息相关。近年来,CO2的资源化利用是化学研究热点之一。
(1)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ∆H1=-127.4kJ/mol
②NaOH(s)+CO2(g)=NaHCO3(s) ∆H2=-131.5kJ/mol
则:反应2NaHCO3(s)=Na2CO3(s)+H2O(g)+CO2(g) ∆H=_________________ kJ/mol。
(2)25℃时,H2CO3的K1=4×10-7;K2=5×10-11。0.1mol/L的NaHCO3溶液中相关微粒的物质的量浓度关系为:c(H2CO3)____________ c( )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
(3)人体血液中存在平衡CO2+H2O⇌H2CO3⇌H++ ,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。适用平衡移动原理解释上述现象:
,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。适用平衡移动原理解释上述现象:_____________________________ 。
(4)科学家利用电化学装置实现CH4和CO2的耦合转化,原理如图:

①电极A的电极反应式为________________ 。
②固体电解质中O2-传导方向是向________________ 极(填“A”或“B”)移动。
③若生成的乙烯和乙烷的物质的量之比为3:1,则消耗的CH4和CO2的物质的量之比为________________ 。
④电催化CO2被还原为CO的具体应用价值是__________________ 。
(1)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ∆H1=-127.4kJ/mol
②NaOH(s)+CO2(g)=NaHCO3(s) ∆H2=-131.5kJ/mol
则:反应2NaHCO3(s)=Na2CO3(s)+H2O(g)+CO2(g) ∆H=
(2)25℃时,H2CO3的K1=4×10-7;K2=5×10-11。0.1mol/L的NaHCO3溶液中相关微粒的物质的量浓度关系为:c(H2CO3)
 )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。(3)人体血液中存在平衡CO2+H2O⇌H2CO3⇌H++
 ,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。适用平衡移动原理解释上述现象:
,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。适用平衡移动原理解释上述现象:(4)科学家利用电化学装置实现CH4和CO2的耦合转化,原理如图:

①电极A的电极反应式为
②固体电解质中O2-传导方向是向
③若生成的乙烯和乙烷的物质的量之比为3:1,则消耗的CH4和CO2的物质的量之比为
④电催化CO2被还原为CO的具体应用价值是
您最近一年使用:0次
名校
3 . 环氧乙烷(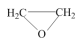 ,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。
,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。
(1)一定条件下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)的过程中部分物料与能量变化如图所示。
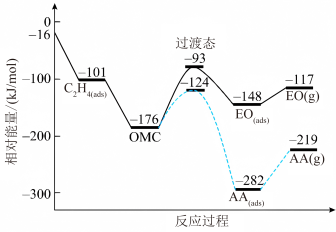
①中间体OMC生成吸附态EO(ads)的活化能为_______ kJ/mol。
②由EO(g)生成AA(g)的热化学方程式为_______ 。
(2)一定条件下,用Ag作催化剂,氧气直接氧化乙烯制环氧乙烷(部分机理未配平)。
主反应:2CH2=CH2(g)+O2(g)=2EO(g) ΔH=-213.8kJ/mol
副反应:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH=-1323kJ/mol
催化机理:O2+Ag(助剂)→ (ads)+Ag+
(ads)+Ag+
 (ads)+ CH2=CH2+Ag+→EO+ O(ads)+Ag
(ads)+ CH2=CH2+Ag+→EO+ O(ads)+Ag
O(ads)+ CH2=CH2→CO2+H2O
实际生产采用220-260℃的可能原因是________ 。
(3)乙烯电解制备EO的原理示意如图。
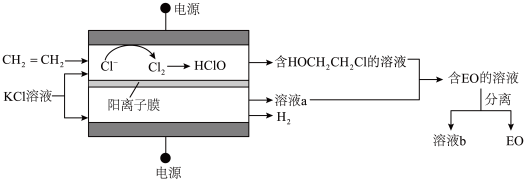
阳极室产生Cl2后发生的反应有:Cl2+H2O=HCl+HClO、CH2=CH2+HClO=HOCH2CH2Cl。
法拉第效率FE的定义:FE(B)= ×100%
×100%
①若FE(EO)=100%,则溶液b的溶质为________ (化学式)。
②一定条件下,反应物按一定流速通过该装置。当乙烯完全消耗时,测得FE(EO)≈70%,S(EO)≈97%。
推测FE(EO)≈70%的原因:若没有生成EO的乙烯全部在阳极放电生成CO2,则生成CO2的电极反应方程式为______ ,FE(CO2)≈____ %。经检验阳极放电产物没有CO2,则S(EO)≈97%的可能原因是______ 。
 ,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。
,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。(1)一定条件下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)的过程中部分物料与能量变化如图所示。

①中间体OMC生成吸附态EO(ads)的活化能为
②由EO(g)生成AA(g)的热化学方程式为
(2)一定条件下,用Ag作催化剂,氧气直接氧化乙烯制环氧乙烷(部分机理未配平)。
主反应:2CH2=CH2(g)+O2(g)=2EO(g) ΔH=-213.8kJ/mol
副反应:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH=-1323kJ/mol
催化机理:O2+Ag(助剂)→
 (ads)+Ag+
(ads)+Ag+ (ads)+ CH2=CH2+Ag+→EO+ O(ads)+Ag
(ads)+ CH2=CH2+Ag+→EO+ O(ads)+AgO(ads)+ CH2=CH2→CO2+H2O
实际生产采用220-260℃的可能原因是
(3)乙烯电解制备EO的原理示意如图。

阳极室产生Cl2后发生的反应有:Cl2+H2O=HCl+HClO、CH2=CH2+HClO=HOCH2CH2Cl。
法拉第效率FE的定义:FE(B)=
 ×100%
×100%①若FE(EO)=100%,则溶液b的溶质为
②一定条件下,反应物按一定流速通过该装置。当乙烯完全消耗时,测得FE(EO)≈70%,S(EO)≈97%。
推测FE(EO)≈70%的原因:若没有生成EO的乙烯全部在阳极放电生成CO2,则生成CO2的电极反应方程式为
您最近一年使用:0次
解题方法
4 . 消除氮氧化物(主要为 和
和 )是治理空气污染的主要任务。
)是治理空气污染的主要任务。
(1)甲烷还原法可在催化剂作用下消除氮氧化物污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应:
 ①
①
 ②
②
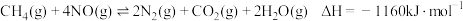 ③
③
则反应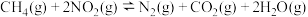 的
的
___________ 。
(2)利用电化学装置可消除氮氧化物污染,变废为宝。

①图Ⅰ装置实现的能量转化形式是___________ 。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为___________ 。石墨Ⅱ电极上发生的电极反应为___________ 。
②图Ⅱ为电解 制备
制备 的装置。该装置中阳极的电极反应式为
的装置。该装置中阳极的电极反应式为___________ 。为使电解产物全部转化为 ,需补充物质A,物质A的化学式为
,需补充物质A,物质A的化学式为___________ 。
 和
和 )是治理空气污染的主要任务。
)是治理空气污染的主要任务。(1)甲烷还原法可在催化剂作用下消除氮氧化物污染,
 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应: ①
① ②
②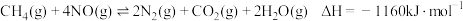 ③
③则反应
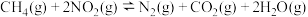 的
的
(2)利用电化学装置可消除氮氧化物污染,变废为宝。

①图Ⅰ装置实现的能量转化形式是
 和
和 的体积比为
的体积比为②图Ⅱ为电解
 制备
制备 的装置。该装置中阳极的电极反应式为
的装置。该装置中阳极的电极反应式为 ,需补充物质A,物质A的化学式为
,需补充物质A,物质A的化学式为
您最近一年使用:0次
解题方法
5 .  是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
(1)实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为:
,其实验过程可表示为:

在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成
气体,生成 ,反应为
,反应为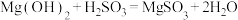 ,其平衡常数K与
,其平衡常数K与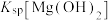 、
、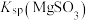 、
、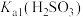 、
、 的代数关系式为
的代数关系式为
______ ;下列实验操作一定能提高氧化镁浆料吸收 效率的有
效率的有______ (填序号)。
A.水浴加热氧化镁浆料 B.加快搅拌速率
C.降低通入 气体的速率 D.通过多孔球泡向氧化镁浆料中通
气体的速率 D.通过多孔球泡向氧化镁浆料中通
(2)烟气中 可以用“亚硫酸铵吸收法”处理。
可以用“亚硫酸铵吸收法”处理。
①吸收时发生反应的化学方程式为______ 。
②测得25℃时溶液pH与各组份物质的量分数的变化关系如下左图所示,b点时溶液pH=7,则
______ 。

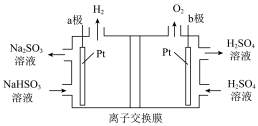
(3)电解法脱硫:用 溶液吸收
溶液吸收 气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂
气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂_______ 的循环利用。
(4)①图中a由极要连接电源的填______ (“正”或“负”)极。
②电解装置中使用______ (阳离子或阴离子)交换膜。
 是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。(1)实验室模拟“镁法工业烟气脱硫”并制备
 ,其实验过程可表示为:
,其实验过程可表示为:
在搅拌下向氧化镁浆料中匀速缓慢通入
 气体,生成
气体,生成 ,反应为
,反应为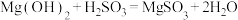 ,其平衡常数K与
,其平衡常数K与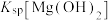 、
、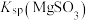 、
、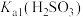 、
、 的代数关系式为
的代数关系式为
 效率的有
效率的有A.水浴加热氧化镁浆料 B.加快搅拌速率
C.降低通入
 气体的速率 D.通过多孔球泡向氧化镁浆料中通
气体的速率 D.通过多孔球泡向氧化镁浆料中通
(2)烟气中
 可以用“亚硫酸铵吸收法”处理。
可以用“亚硫酸铵吸收法”处理。①吸收时发生反应的化学方程式为
②测得25℃时溶液pH与各组份物质的量分数的变化关系如下左图所示,b点时溶液pH=7,则



(3)电解法脱硫:用
 溶液吸收
溶液吸收 气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂
气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂(4)①图中a由极要连接电源的填
②电解装置中使用
您最近一年使用:0次
6 . 大气污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。
I.
(1)利用废气中的 回收硫磺,生产工艺可分为两个阶段。涉及到的热化学方程式:
回收硫磺,生产工艺可分为两个阶段。涉及到的热化学方程式:
阶段一: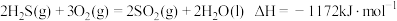
阶段二: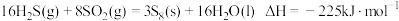
①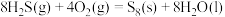 的
的
___________  。
。
② 是由8个硫原子形成的环状结构,每个硫原子以
是由8个硫原子形成的环状结构,每个硫原子以 杂化轨道中的两个轨道与相邻的两个硫原子形成
杂化轨道中的两个轨道与相邻的两个硫原子形成 键。
键。 中含有
中含有 键为
键为___________  。
。
(2) 溶液脱除空气中
溶液脱除空气中 并再生的原理如图所示。
并再生的原理如图所示。

① 溶液脱除空气中
溶液脱除空气中 的总反应化学方程式为
的总反应化学方程式为___________ 。
②将一定体积含 的空气匀速通入
的空气匀速通入 溶液中,反应相同时间,初始
溶液中,反应相同时间,初始 浓度
浓度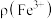 及
及 与
与 脱除率的关系如图所示。当
脱除率的关系如图所示。当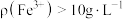 时,
时, 脱除率下降的原因是
脱除率下降的原因是___________ 。

Ⅱ.研发 的碳捕捉和碳利用技术是实现碳中和的关键。
的碳捕捉和碳利用技术是实现碳中和的关键。
(3)325℃时,水在 粉表面产生的
粉表面产生的 可将
可将 转化成甲酸
转化成甲酸 ,同时生成
,同时生成 。
。
①由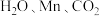 制备甲酸的化学方程式为
制备甲酸的化学方程式为___________ 。
②直接加热 与
与 难以生成甲酸,该条件下能较快生成甲酸的原因是
难以生成甲酸,该条件下能较快生成甲酸的原因是___________ 。
(4)多晶 是目前唯一被实验证实能高效催化
是目前唯一被实验证实能高效催化 还原为烃类(如
还原为烃类(如 )的金属。如图所示,电解装置中分别以多晶
)的金属。如图所示,电解装置中分别以多晶 和
和 为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后
为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后 浓度基本保持不变,温度控制在10℃左右。生成
浓度基本保持不变,温度控制在10℃左右。生成 的电极反应式为
的电极反应式为___________ 。

I.
(1)利用废气中的
 回收硫磺,生产工艺可分为两个阶段。涉及到的热化学方程式:
回收硫磺,生产工艺可分为两个阶段。涉及到的热化学方程式:阶段一:
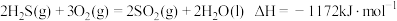
阶段二:
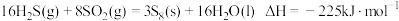
①
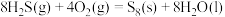 的
的
 。
。②
 是由8个硫原子形成的环状结构,每个硫原子以
是由8个硫原子形成的环状结构,每个硫原子以 杂化轨道中的两个轨道与相邻的两个硫原子形成
杂化轨道中的两个轨道与相邻的两个硫原子形成 键。
键。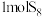 中含有
中含有 键为
键为 。
。(2)
 溶液脱除空气中
溶液脱除空气中 并再生的原理如图所示。
并再生的原理如图所示。
①
 溶液脱除空气中
溶液脱除空气中 的总反应化学方程式为
的总反应化学方程式为②将一定体积含
 的空气匀速通入
的空气匀速通入 溶液中,反应相同时间,初始
溶液中,反应相同时间,初始 浓度
浓度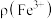 及
及 与
与 脱除率的关系如图所示。当
脱除率的关系如图所示。当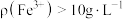 时,
时, 脱除率下降的原因是
脱除率下降的原因是
Ⅱ.研发
 的碳捕捉和碳利用技术是实现碳中和的关键。
的碳捕捉和碳利用技术是实现碳中和的关键。(3)325℃时,水在
 粉表面产生的
粉表面产生的 可将
可将 转化成甲酸
转化成甲酸 ,同时生成
,同时生成 。
。①由
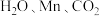 制备甲酸的化学方程式为
制备甲酸的化学方程式为②直接加热
 与
与 难以生成甲酸,该条件下能较快生成甲酸的原因是
难以生成甲酸,该条件下能较快生成甲酸的原因是(4)多晶
 是目前唯一被实验证实能高效催化
是目前唯一被实验证实能高效催化 还原为烃类(如
还原为烃类(如 )的金属。如图所示,电解装置中分别以多晶
)的金属。如图所示,电解装置中分别以多晶 和
和 为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后
为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后 浓度基本保持不变,温度控制在10℃左右。生成
浓度基本保持不变,温度控制在10℃左右。生成 的电极反应式为
的电极反应式为
您最近一年使用:0次
7 . 甲烷是一种能量密度低、难液化、运输成本较高的能源。将甲烷转化成能量密度较高的液体燃料已成为重要的课题。
Ⅰ.直接氧化法制甲醇
(1)已知下列反应的热化学方程式:
反应1: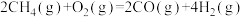

反应2: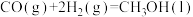
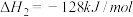
写出甲烷氧化法制甲醇的热化学方程式:______ 。
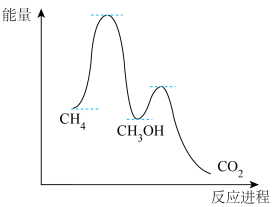
(2)甲烷氧化过程中的活化能垒如图所示。该方法制备CH3OH产率较低,其原因是______ 。
Ⅱ.甲烷的电催化氧化
(3)Hibino科学团队在阳极进行甲烷转化研究,其装置图如图所示,其阳极电极反应式为______ 。

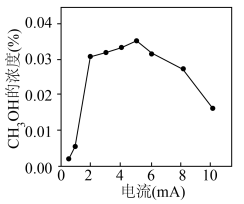
(4)钒(V)物种被认为是形成活性氧物质(如 )的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
)的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是______ 。
Ⅲ.多相催化剂氧化甲烷法
光照条件下,TiO2负载的Fe2O3多相催化剂合成甲醇时,可将甲醇的选择性(选择性 )提升至90%以上,其反应机理如图所示。
)提升至90%以上,其反应机理如图所示。
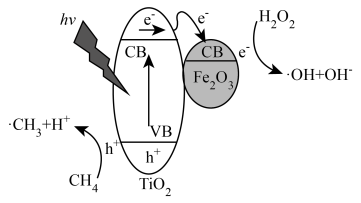
(5)光照时,表面形成的空穴(h+)具有强______ (填“氧化性”或“还原性”)。
(6)写出甲烷通过多相催化剂法制取甲醇的化学方程式______ 。
(7)从反应过程中产生的微粒角度分析,TiO2负载的Fe2O3多相催化剂能将甲醇的选择性提升至90%以上的原因是______ 。
Ⅰ.直接氧化法制甲醇
(1)已知下列反应的热化学方程式:
反应1:
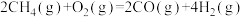

反应2:
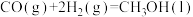
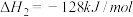
写出甲烷氧化法制甲醇的热化学方程式:
(2)甲烷氧化过程中的活化能垒如图所示。该方法制备CH3OH产率较低,其原因是

Ⅱ.甲烷的电催化氧化
(3)Hibino科学团队在阳极进行甲烷转化研究,其装置图如图所示,其阳极电极反应式为

(4)钒(V)物种被认为是形成活性氧物质(如
 )的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
)的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
Ⅲ.多相催化剂氧化甲烷法
光照条件下,TiO2负载的Fe2O3多相催化剂合成甲醇时,可将甲醇的选择性(选择性
 )提升至90%以上,其反应机理如图所示。
)提升至90%以上,其反应机理如图所示。
(5)光照时,表面形成的空穴(h+)具有强
(6)写出甲烷通过多相催化剂法制取甲醇的化学方程式
(7)从反应过程中产生的微粒角度分析,TiO2负载的Fe2O3多相催化剂能将甲醇的选择性提升至90%以上的原因是
您最近一年使用:0次
8 . 氢气是未来的重要能源,可以通过甲烷电化学分解法、甲烷蒸汽重整法、光解水法等来制备。
(1)甲烷电化学分解法。可能的反应机理如图,该装置中阳极反应式为___________ 。

(2)甲烷蒸汽重整法。该方法是在重整制氢过程中加入纳米CaO作为高温 吸附剂,所涉及的主要热化学方程式为:
吸附剂,所涉及的主要热化学方程式为:
反应I:
反应Ⅱ:
反应Ⅲ:
①反应I-反应Ⅲ分两个温度段进行,工业生产中采用先高温后低温的原因是___________ 。
②高温下 会发生积碳反应:
会发生积碳反应: 。高温下该反应能自发进行的原因是
。高温下该反应能自发进行的原因是___________ 。为了防止积碳,实际操作中水蒸气要过量,发生反应: ,其
,其
___________  。
。
③利用 为载体的催化剂可以除去
为载体的催化剂可以除去 中混有的少量CO和NO,
中混有的少量CO和NO, 催化剂中复合掺杂
催化剂中复合掺杂 、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是
、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是___________ 。
(3)光解水法。GeZnNO催化剂光照时会产生电子和具有强氧化性的电子空穴 ,加入助催化剂
,加入助催化剂 有利于电子与
有利于电子与 的分离,该催化剂光解水可能的反应机理如图所示。
的分离,该催化剂光解水可能的反应机理如图所示。 产生
产生 和
和 的过程可描述为
的过程可描述为___________ 。

(1)甲烷电化学分解法。可能的反应机理如图,该装置中阳极反应式为

(2)甲烷蒸汽重整法。该方法是在重整制氢过程中加入纳米CaO作为高温
 吸附剂,所涉及的主要热化学方程式为:
吸附剂,所涉及的主要热化学方程式为:反应I:

反应Ⅱ:

反应Ⅲ:

①反应I-反应Ⅲ分两个温度段进行,工业生产中采用先高温后低温的原因是
②高温下
 会发生积碳反应:
会发生积碳反应: 。高温下该反应能自发进行的原因是
。高温下该反应能自发进行的原因是 ,其
,其
 。
。③利用
 为载体的催化剂可以除去
为载体的催化剂可以除去 中混有的少量CO和NO,
中混有的少量CO和NO, 催化剂中复合掺杂
催化剂中复合掺杂 、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是
、CuO后能提升催化活性。实验测得当催化温度超过400℃时,催化剂的催化活性下降,可能原因是(3)光解水法。GeZnNO催化剂光照时会产生电子和具有强氧化性的电子空穴
 ,加入助催化剂
,加入助催化剂 有利于电子与
有利于电子与 的分离,该催化剂光解水可能的反应机理如图所示。
的分离,该催化剂光解水可能的反应机理如图所示。 产生
产生 和
和 的过程可描述为
的过程可描述为
您最近一年使用:0次
名校
9 . 甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:______________________________________________ 。
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的_________________ 。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)==CH3OH(g),已知某些化学键的键能数据如下表:
请回答下列问题:
①图1中曲线a到曲线b的措施是_________ 。

②已知CO中的C与O之间为叁键,其键能为x kJ/mol,则x=________ 。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为______________________________________ 。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为________ 。
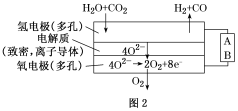
(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000 ℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图2可知A为直流电源的________ (填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:____________________ 。
(1)已知:CH3OH(g)===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)==CH3OH(g),已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
| 键能/(kJ·mol-1) | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题:
①图1中曲线a到曲线b的措施是

②已知CO中的C与O之间为叁键,其键能为x kJ/mol,则x=
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为
(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000 ℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图2可知A为直流电源的

您最近一年使用:0次
解题方法
10 . 国家主席习近平在9月22日召开的联合国大会上表示:“中国将争取在2060年前实现碳中和”。捕集CO2的技术对解决全球温室效应意义重大。回答下列问题:
(1)国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-270kJ·mol-1。几种化学键的键能如表所示:
则a=___________ 。
(2)将CO2还原为CH4,是实现CO2资源化利用的有效途径之一,装置如图所示:
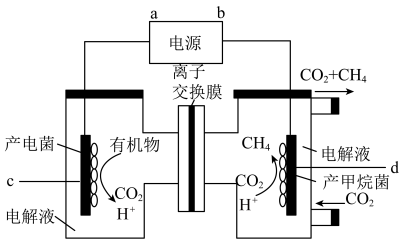
①H+的移动方向为___________ (填“自左至右”或“自右至左”);d电极的电极反应式为___________ 。
②若电源为CH3OH O2
O2 KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过
KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过___________ molH+,该清洁燃料电池中的正极反应式为___________ 。
(3)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应III:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77kJ·mol-1
反应II的ΔH2=___________ kJ·mol-1。
(4)利用太阳能光解Fe3O4,制备的FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图2所示。过程II反应的化学方程式是___________ 。

(5)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36L(标准状况下)O2,则电路中转移的电子至少为___________ mol。
②生成乙烯的电极反应式是___________ 。
(1)国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-270kJ·mol-1。几种化学键的键能如表所示:
| 化学键 | C H H | H H H | H O O | C O O |
| 键能/kJ·mol-1 | 413 | 436 | a | 745 |
(2)将CO2还原为CH4,是实现CO2资源化利用的有效途径之一,装置如图所示:

①H+的移动方向为
②若电源为CH3OH
 O2
O2 KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过
KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过(3)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应III:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77kJ·mol-1
反应II的ΔH2=
(4)利用太阳能光解Fe3O4,制备的FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图2所示。过程II反应的化学方程式是

(5)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36L(标准状况下)O2,则电路中转移的电子至少为
②生成乙烯的电极反应式是
您最近一年使用:0次



