名校
1 . 电催化还原CO2是当今资源化利用二氧化碳的重点课题。
(1)利用CO2合成淀粉
①
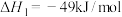
②
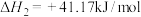
③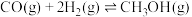

___________ (填“高温自发”“低温自发”或“任何温度下都自发”)。
(2)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示.控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示.___________ 。
②控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
③科研小组利用13CO2代替原有的CO2进行研究,其目的是___________ 。
(3)一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液呈蓝色.写出Cu2O还原HAuCl4的离子方程式:___________ 。
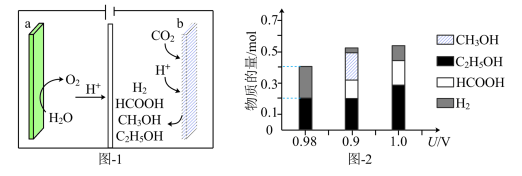
(4)金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图4所示。___________ 。
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是___________ 。
(1)利用CO2合成淀粉
①

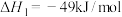
②

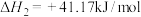
③
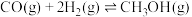

(2)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示.控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示.
②控制电压为0.8V,电解时转移电子的物质的量为
③科研小组利用13CO2代替原有的CO2进行研究,其目的是
(3)一种铜基复合电极材料Au/Cu2O的制备方法:将一定量Cu2O分散至水与乙醇的混合溶液中,向溶液中逐滴滴加HAuCl4(一种强酸)溶液,搅拌一段时间后离心分离,得Au/Cu2O,溶液呈蓝色.写出Cu2O还原HAuCl4的离子方程式:
(4)金属Cu/La复合电极材料电催化还原CO2制备甲醛和乙醇的可能机理如图3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图4所示。
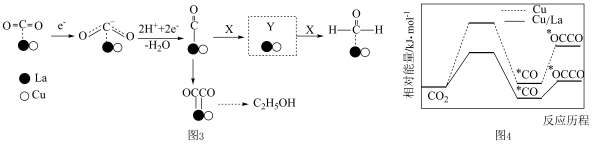
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原CO2的优点是
您最近一年使用:0次
名校
2 . 含氮化合物( 、
、 、
、 等)是环境污染物,可用以下方法消除其污染。
等)是环境污染物,可用以下方法消除其污染。
Ⅰ.苯酚(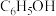 )是一种广泛使用、易氧化的化工产品。一种在
)是一种广泛使用、易氧化的化工产品。一种在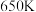 下用
下用 废气催化氧化苯制备苯酚的新方法为:
废气催化氧化苯制备苯酚的新方法为: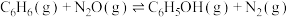 。
。
(1)已知



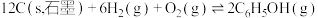
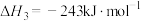
则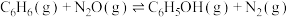

___________ 。
Ⅱ.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的 可高效转化酸性溶液中的硝态氮(
可高效转化酸性溶液中的硝态氮( ),以达到消除污染的目的,其工作原理如图-1所示。
),以达到消除污染的目的,其工作原理如图-1所示。
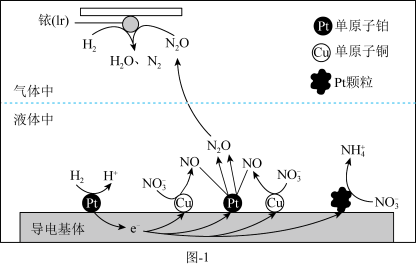
(2) 被
被 还原为
还原为 的过程可描述为:液体中,
的过程可描述为:液体中, 在导电基体的单原子铂上失去电子生成
在导电基体的单原子铂上失去电子生成 ,电子进入导电基体中进行传导,
,电子进入导电基体中进行传导,___________ 。
(3)若导电基体上的Pt颗粒增多,造成的后果是___________ 。
(4)单原子铂催化剂相比于Pt颗粒催化剂,优点有___________ 。
Ⅲ.三维电极法:它是在传统的电解槽两电极之间填充粒状或碎屑状材料,填充的粒子电极表面能带电,成为新的一极(第三极)。如图2为用三维电极法处理氨氮废水的原理图,石墨板作为阴、阳极,自制活性炭为填充材料,电解一定浓度的 、
、 与NaCl的酸性混合溶液来进行模拟。
与NaCl的酸性混合溶液来进行模拟。

(5)该装置可以生成大量氧化性更强的 ,
, 去除
去除 的离子方程式为
的离子方程式为___________ 。
(6)相比于传统的二维电极反应系统,三维电极的优点有___________ 。
 、
、 、
、 等)是环境污染物,可用以下方法消除其污染。
等)是环境污染物,可用以下方法消除其污染。Ⅰ.苯酚(
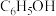 )是一种广泛使用、易氧化的化工产品。一种在
)是一种广泛使用、易氧化的化工产品。一种在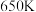 下用
下用 废气催化氧化苯制备苯酚的新方法为:
废气催化氧化苯制备苯酚的新方法为: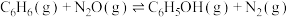 。
。(1)已知




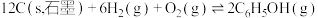
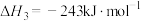
则
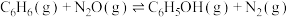

Ⅱ.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的
 可高效转化酸性溶液中的硝态氮(
可高效转化酸性溶液中的硝态氮( ),以达到消除污染的目的,其工作原理如图-1所示。
),以达到消除污染的目的,其工作原理如图-1所示。
(2)
 被
被 还原为
还原为 的过程可描述为:液体中,
的过程可描述为:液体中, 在导电基体的单原子铂上失去电子生成
在导电基体的单原子铂上失去电子生成 ,电子进入导电基体中进行传导,
,电子进入导电基体中进行传导,(3)若导电基体上的Pt颗粒增多,造成的后果是
(4)单原子铂催化剂相比于Pt颗粒催化剂,优点有
Ⅲ.三维电极法:它是在传统的电解槽两电极之间填充粒状或碎屑状材料,填充的粒子电极表面能带电,成为新的一极(第三极)。如图2为用三维电极法处理氨氮废水的原理图,石墨板作为阴、阳极,自制活性炭为填充材料,电解一定浓度的
 、
、 与NaCl的酸性混合溶液来进行模拟。
与NaCl的酸性混合溶液来进行模拟。
(5)该装置可以生成大量氧化性更强的
 ,
, 去除
去除 的离子方程式为
的离子方程式为(6)相比于传统的二维电极反应系统,三维电极的优点有
您最近一年使用:0次
3 . 纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图1、图2。
(1)①肼燃料电池中A极发生的电极反应为___________ 。
②上述装置中D电极应连接肼燃料电池的___________ 极(填“A”或“B”),该电解池的阳极反应式为___________ 。
③当反应生成14.4gCu2O时,停止电解,至少需要肼___________ mol,通过离子交换膜的阴离子的物质的量为___________ mol。(离子交换膜只允许OH-通过)
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2也可制备纳米级Cu2O,同时放出N2,该反应的化学方程式为___________ 。
(3)发射火箭时以液态肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水。已知:①2H2O2(1)=2H2O(l)+O2(g) △H=-196kJmol-1;②H2O(l)=H2O(g) △H=43.98kJmol-1;③肼的燃烧热为-622.08kJmol-1。写出上述反应的热化学方程式___________ 。

(1)①肼燃料电池中A极发生的电极反应为
②上述装置中D电极应连接肼燃料电池的
③当反应生成14.4gCu2O时,停止电解,至少需要肼
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2也可制备纳米级Cu2O,同时放出N2,该反应的化学方程式为
(3)发射火箭时以液态肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水。已知:①2H2O2(1)=2H2O(l)+O2(g) △H=-196kJmol-1;②H2O(l)=H2O(g) △H=43.98kJmol-1;③肼的燃烧热为-622.08kJmol-1。写出上述反应的热化学方程式
您最近一年使用:0次
2023-04-27更新
|
123次组卷
|
2卷引用:江苏省扬州市高邮市2022-2023学年高一下学期4月期中考试化学试题
4 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发CO2的碳捕捉和碳利用技术则是关键。
(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g) C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1
③2CO(g) CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1
反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=_____ kJ•mol-1。
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为_____ 。

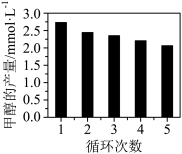
(3)CO2与H2反应如果用Co/C作为催化剂,可以得到含有少量甲酸的甲醇。为了研究催化剂的催化效率,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的可能原因_____ 。
(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为_____ mol•L-1。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
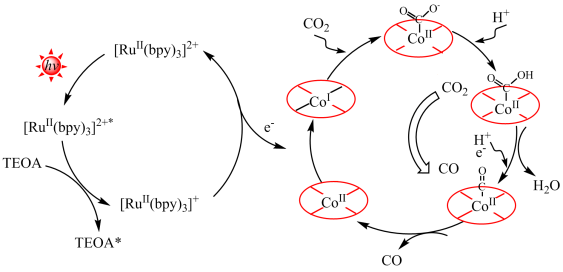
(5)某课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoII表示),测试结果表明,该CoII在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoII/CoI反应路径(如图)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoII供激发电子将CoII还原为CoI,_____ 。(结合图示,描述CO2还原为CO的过程)
(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g)
 C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1③2CO(g)
 CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为

(3)CO2与H2反应如果用Co/C作为催化剂,可以得到含有少量甲酸的甲醇。为了研究催化剂的催化效率,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的可能原因

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为
(5)某课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoII表示),测试结果表明,该CoII在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoII/CoI反应路径(如图)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoII供激发电子将CoII还原为CoI,

您最近一年使用:0次
5 . 尽管NOx、SO2、CO都是有毒气体,但是它们在生产、医学领域中都有重要应用。合理利用或转化CO、NOx等污染性气体是人们共同关注的课题。回答下列问题:
(1)已知:①CO(g)+ H2O(g)=CO2(g)+H2(g) △H=-41.0kJ·mol-1
②N2(g)+ O2(g)=2NO(g) △H=+ 180.0kJ· mol-1
③H2(g)+ O2 (g)=H2O(g) △H=- 241.8kJ·mol-l
O2 (g)=H2O(g) △H=- 241.8kJ·mol-l
CO和NO按一定比例混合,在适当催化剂作用下可生成无毒气体实现安全排放,该反应的热化学方程式为_______ 。
(2)研究发现CO和水蒸气在双功能催化剂(能吸附不同粒子)作用下发生反应CO(g)+ H2O(g)=CO2(g) +H2(g) △H<0, 反应机理的变化过程示意图如图所示。(CO吸附在催化剂表面,可用*CO表示,其他物种依次类推):_______ 。
(3)直接电解吸收NOX制备硝酸。用稀硝酸吸收NOx生成HNO2,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。_______ 。
②若b极处放出的气体可直接排放到空气中,则该气体物质是_______ ( 写名称)。
(4)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,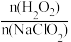 、 溶液pH对脱硫脱硝的影响如图所示:
、 溶液pH对脱硫脱硝的影响如图所示:_______ 。
②根据图示SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是_______ 。
(1)已知:①CO(g)+ H2O(g)=CO2(g)+H2(g) △H=-41.0kJ·mol-1
②N2(g)+ O2(g)=2NO(g) △H=+ 180.0kJ· mol-1
③H2(g)+
 O2 (g)=H2O(g) △H=- 241.8kJ·mol-l
O2 (g)=H2O(g) △H=- 241.8kJ·mol-lCO和NO按一定比例混合,在适当催化剂作用下可生成无毒气体实现安全排放,该反应的热化学方程式为
(2)研究发现CO和水蒸气在双功能催化剂(能吸附不同粒子)作用下发生反应CO(g)+ H2O(g)=CO2(g) +H2(g) △H<0, 反应机理的变化过程示意图如图所示。(CO吸附在催化剂表面,可用*CO表示,其他物种依次类推):

(3)直接电解吸收NOX制备硝酸。用稀硝酸吸收NOx生成HNO2,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。

②若b极处放出的气体可直接排放到空气中,则该气体物质是
(4)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,
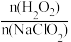 、 溶液pH对脱硫脱硝的影响如图所示:
、 溶液pH对脱硫脱硝的影响如图所示:
②根据图示SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是
您最近一年使用:0次
名校
解题方法
6 . 化学反应与能量变化是化学家研究的永恒话题。
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。
①硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把_______ 能转化为_______ 能的装置。
②工业制备纯硅的反应: ,生成的
,生成的 通入
通入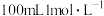 的
的 溶液恰好反应,则制备纯硅的过程中
溶液恰好反应,则制备纯硅的过程中_______ (填“吸收或“释放”)的热量为_______  。
。
(2)氢气是一种理想的绿色能源.请回答下列问题
①在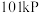 下,
下, 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出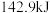 的热量。写出表示氢气燃烧热的热化学方程式
的热量。写出表示氢气燃烧热的热化学方程式_______ 。
②氢能的存储是氢能利用的前提,科学家研究出一种储氢合金 ,已知:
,已知:
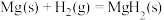
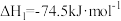
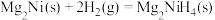
 ;
;

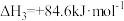
则
_______  。
。
(3)化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图.请回答下列问题。
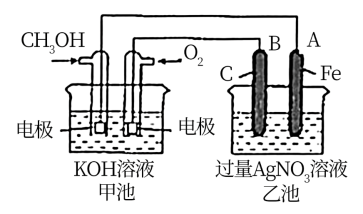
①乙池是_______ 装置(填“原电池”或“电解池”),A电极的名称是_______ ;B(石墨)电极的电极反应式为:_______ 。
②甲池中通入 一极的电极反应式为:
一极的电极反应式为:_______ 。
③反应一段时间后,要使乙池反应后的溶液恢复到原来的状态,则需加入_______ (填化学式)。
④研究证实,甲醇可由 在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:_______ 。
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。
①硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把
②工业制备纯硅的反应:
 ,生成的
,生成的 通入
通入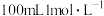 的
的 溶液恰好反应,则制备纯硅的过程中
溶液恰好反应,则制备纯硅的过程中 。
。(2)氢气是一种理想的绿色能源.请回答下列问题
①在
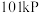 下,
下, 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出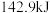 的热量。写出表示氢气燃烧热的热化学方程式
的热量。写出表示氢气燃烧热的热化学方程式②氢能的存储是氢能利用的前提,科学家研究出一种储氢合金
 ,已知:
,已知: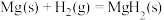
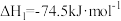
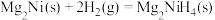
 ;
;
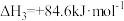
则

 。
。(3)化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图.请回答下列问题。

①乙池是
②甲池中通入
 一极的电极反应式为:
一极的电极反应式为:③反应一段时间后,要使乙池反应后的溶液恢复到原来的状态,则需加入
④研究证实,甲醇可由
 在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
您最近一年使用:0次
2021-05-07更新
|
201次组卷
|
2卷引用:江苏省苏州市吴中区2020-2021学年高二下学期期中调研测试化学试题
7 . 我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。为此我国制定了实现“碳中和”和“温室气体净零排放”的长期战略目标。CO2的转化、回收和重整受到越来越多的关注,它是有效应对全球气候变化、促进低碳社会构建的重要方法。
(1) 热化学转化法。科学家研究利用回收的CO2制取甲酸(HCOOH)。
①已知:Ⅰ:HCOOH(g) = CO(g)+H2O(g) ΔH1=+72.6 kJ·mol-1;
Ⅱ:2CO(g)+O2(g) = 2CO2(g) ΔH 2=-576.0 kJ·mol-1;
Ⅲ:2H2(g)+O2(g) = 2H2O(g) ΔH 3=-483.6 kJ·mol-1
则反应Ⅳ:CO2(g)+H2(g) = HCOOH(g)的ΔH=_______ 。
②查阅资料知在过渡金属催化剂存在下,CO2(g)和H2(g)合成HCOOH(g)的反应分两步进行:已知第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);则第一步反应的方程式_______ 。
③工业上利用2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H<0,合成甲醚。向一绝热恒容密闭容器中,加入1molCO2和3molH2发生上述反应,能够说明该反应达到平衡状态的是_______ 。(填字母)
a. 容器内温度保持不变 b. 容器内 比值保持不变
比值保持不变
c. 2v正(CO2)=v逆(CH3OCH3) d. 容器内气体的密度保持不变
(2)催化还原法
①CO2与丙烯通过金属杂多酸盐[CoxH(3-2x)PW12O40] 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对CO2转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是_______ 。
②催化剂在温度不同时对CO2转化率的影响如图2所示,300 ℃催化效果远不如200 ℃ 和250 ℃的原因_______ 。

(3)电化学催化重整法。科研人员通过电解酸化的CO2制备CH4,装置如图3所示。

①电解过程中,阴极的电极反应式为_______ 。
②电解一段时间后,阳极区溶液pH减小,其原因是_______ 。
(1) 热化学转化法。科学家研究利用回收的CO2制取甲酸(HCOOH)。
①已知:Ⅰ:HCOOH(g) = CO(g)+H2O(g) ΔH1=+72.6 kJ·mol-1;
Ⅱ:2CO(g)+O2(g) = 2CO2(g) ΔH 2=-576.0 kJ·mol-1;
Ⅲ:2H2(g)+O2(g) = 2H2O(g) ΔH 3=-483.6 kJ·mol-1
则反应Ⅳ:CO2(g)+H2(g) = HCOOH(g)的ΔH=
②查阅资料知在过渡金属催化剂存在下,CO2(g)和H2(g)合成HCOOH(g)的反应分两步进行:已知第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);则第一步反应的方程式
③工业上利用2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H<0,合成甲醚。向一绝热恒容密闭容器中,加入1molCO2和3molH2发生上述反应,能够说明该反应达到平衡状态的是
a. 容器内温度保持不变 b. 容器内
 比值保持不变
比值保持不变c. 2v正(CO2)=v逆(CH3OCH3) d. 容器内气体的密度保持不变
(2)催化还原法
①CO2与丙烯通过金属杂多酸盐[CoxH(3-2x)PW12O40] 催化合成甲基丙烯酸。研究发现金属杂多酸盐中x对CO2转化率的影响如图1所示,由图1得出催化效果最好的金属杂多酸盐化学式是
②催化剂在温度不同时对CO2转化率的影响如图2所示,300 ℃催化效果远不如200 ℃ 和250 ℃的原因

(3)电化学催化重整法。科研人员通过电解酸化的CO2制备CH4,装置如图3所示。

①电解过程中,阴极的电极反应式为
②电解一段时间后,阳极区溶液pH减小,其原因是
您最近一年使用:0次
8 . 工业上CO2、CH4等含碳化合物有着重要的应用。
(1)科学家以CH4为原料来制备乙烯,同时得到氢气。已知相关物质的标准燃烧热如下表所示,写出甲烷制备乙烯的热化学方程式:___________ 。
(2)在400℃时,向初始体积为1 L的恒容密闭反应器中充入1 mol CH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%。
①该温度下,平衡常数K=___________ 。
②若向该平衡体系中充入等物质的量的CH4和H2,则平衡将___________ (填“正向移动”或“逆向移动”或“不移动”成“无法确定"),理由是___________ 。
(3)科学家用氮化镓材料与铜组装成如图所示的人工光合系统实现CO2的再利用。

①该电化学装置属于___________ (填"原电池”或“电解池”)。
②该电池的Cu电极上发生反应的电极方程式为___________ 。
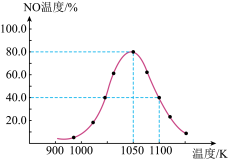
(4)现利用反应除去汽车尾气中的NOx:C(s)+2NO(g) N2(g)+CO2(g) △H=-34.0 kJ/mol。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a (NO)随温度的变化如图所示。由图可知,1050 K 前反应中NO的转化率随温度升高而增大,原因是
N2(g)+CO2(g) △H=-34.0 kJ/mol。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a (NO)随温度的变化如图所示。由图可知,1050 K 前反应中NO的转化率随温度升高而增大,原因是___________ 。
(5)以连二硫酸根(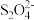 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
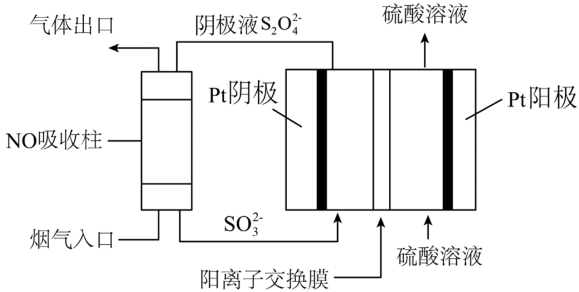
①阴极区的电极反应式为___________ 。
②NO吸收转化后的主要产物为 ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为___________ mL。
(1)科学家以CH4为原料来制备乙烯,同时得到氢气。已知相关物质的标准燃烧热如下表所示,写出甲烷制备乙烯的热化学方程式:
| 物质 | 标准燃烧热/kJ/mol |
| 氢气 | -285.8 |
| 甲烷 | -890.3 |
| 乙烯 | -1411.0 |
①该温度下,平衡常数K=
②若向该平衡体系中充入等物质的量的CH4和H2,则平衡将
(3)科学家用氮化镓材料与铜组装成如图所示的人工光合系统实现CO2的再利用。

①该电化学装置属于
②该电池的Cu电极上发生反应的电极方程式为
(4)现利用反应除去汽车尾气中的NOx:C(s)+2NO(g)
 N2(g)+CO2(g) △H=-34.0 kJ/mol。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a (NO)随温度的变化如图所示。由图可知,1050 K 前反应中NO的转化率随温度升高而增大,原因是
N2(g)+CO2(g) △H=-34.0 kJ/mol。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a (NO)随温度的变化如图所示。由图可知,1050 K 前反应中NO的转化率随温度升高而增大,原因是
(5)以连二硫酸根(
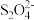 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
①阴极区的电极反应式为
②NO吸收转化后的主要产物为
 ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为
您最近一年使用:0次
9 . 硫酸厂尾气中含有一定量的 SO2,回收并综合利用 SO2对环境保护有重要意义。
(1)利用氨水吸收烟气中的 SO2可转化为(NH4)2SO4。相关反应热化学方程式如下:
SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) ΔH2=bkJ•mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=ckJ•mol-1
①反应 2SO2(g)+4NH3•H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的ΔH3=_______ kJ•mol-1
②空气氧化(NH4)2SO3的速率随温度的变化如图 1 所示,当温度超过 60℃时,(NH4)2SO3氧化速率下降的原因可能是_____ 。研究发现,在 500℃下硫酸铵分解过程中得到 4 种产物,其含氮物质随时间变化关系如图 2 所示。写出该条件下硫酸铵分解的化学方程式: _______ 。

(2)工业上利用 SO2尾气可制备亚硫酰氯(SOCl2)。SOCl2是一种发烟液体,易水解,可用于农药、医药、染料、电池等生产,其制备原理为:S(s)+2Cl2(g)+SO2(g)⇌2SOCl2(g)。
①该反应的平衡常数表达式为____________ 。
②用 SOCl2与 A1Cl3•6H2O 混合共热,可得到无水 A1Cl3,原因是____________ 。
(3)用电解法处理含有 SO2尾气的装置如图所示(电极材料均为惰性电极)。阴极的电极反应式为_________________ 。
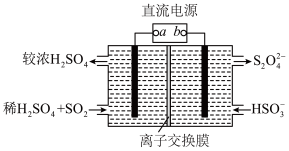
(1)利用氨水吸收烟气中的 SO2可转化为(NH4)2SO4。相关反应热化学方程式如下:
SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) ΔH2=bkJ•mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=ckJ•mol-1
①反应 2SO2(g)+4NH3•H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的ΔH3=
②空气氧化(NH4)2SO3的速率随温度的变化如图 1 所示,当温度超过 60℃时,(NH4)2SO3氧化速率下降的原因可能是

(2)工业上利用 SO2尾气可制备亚硫酰氯(SOCl2)。SOCl2是一种发烟液体,易水解,可用于农药、医药、染料、电池等生产,其制备原理为:S(s)+2Cl2(g)+SO2(g)⇌2SOCl2(g)。
①该反应的平衡常数表达式为
②用 SOCl2与 A1Cl3•6H2O 混合共热,可得到无水 A1Cl3,原因是
(3)用电解法处理含有 SO2尾气的装置如图所示(电极材料均为惰性电极)。阴极的电极反应式为

您最近一年使用:0次
2020-11-25更新
|
320次组卷
|
3卷引用:江苏省镇江市镇江中学2021届高三上学期期中教学质量检测化学试题
10 . 对CO2进行综合利用可以节约能源,减少碳排放,对于环保有重要意义。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
则估算该反应的△H=________ kJ/mol(用a、b、c、d的代数式表示)。
②一定条件下,向2 L密闭容器中通入CO2和CH4各4 mol,发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为
2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为________ mol/L。
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CH4+CO2 CH3COOH。
CH3COOH。
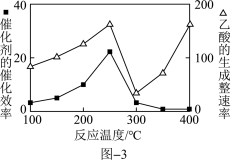
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图3所示。在制备乙酸时,可选择的适宜温度为________ 。
②为了提高该反应中CH4的转化率,可以采取的措施是________ (写出一种)。
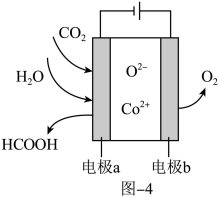
(3)CO2在新型钴基电催化剂作用下转化为清洁燃料——甲酸,其工作原理如图4所示。该装置是________ (填“原电池”或“电解池),电极 的电极反应式为
的电极反应式为________ 。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g) ①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | 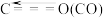 |
| 键能/(kJ/mol) | a | b | c | d |
②一定条件下,向2 L密闭容器中通入CO2和CH4各4 mol,发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为
2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为20%,则平衡时CO2的浓度为(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CH4+CO2
 CH3COOH。
CH3COOH。
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图3所示。在制备乙酸时,可选择的适宜温度为
②为了提高该反应中CH4的转化率,可以采取的措施是
(3)CO2在新型钴基电催化剂作用下转化为清洁燃料——甲酸,其工作原理如图4所示。该装置是
 的电极反应式为
的电极反应式为
您最近一年使用:0次



