解题方法
1 . 碳中和作为一种新型环保形式,目前已经被越来越多的大型活动和会议采用。回答下列有关问题:
(1)利用 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:
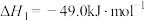
Ⅱ.逆水汽变换:
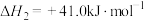
Ⅲ.甲醇脱水:

工艺2:利用 直接加氢合成
直接加氢合成 (反应Ⅳ)
(反应Ⅳ)
①据上述信息可知反应Ⅳ的热化学方程式为___________ ,反应Ⅰ低温___________ 自发进行(填“能”、“不能”)。
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是___________ 。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内 浓度保持不变
浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)工艺1需先合成甲醇。在不同压强下,按照 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图甲、乙所示。
的平衡产率随温度的变化关系如下图甲、乙所示。
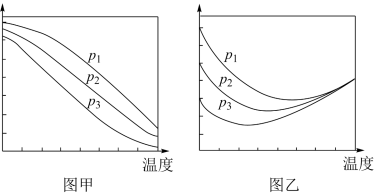
①下列说法正确的是___________ 。
A.图甲纵坐标表示 的平衡产率
的平衡产率
B.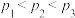
C.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件
D.一定温度压强下,提高 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是___________ 。
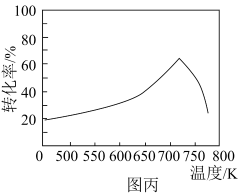
(3)对于合成甲醇的反应:
 ,一定条件下,单位时间内不同温度下测定的
,一定条件下,单位时间内不同温度下测定的 转化率如图丙所示。温度高于
转化率如图丙所示。温度高于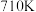 时,随温度的升高
时,随温度的升高 转化率降低的原因可能是
转化率降低的原因可能是___________ 。
(4) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
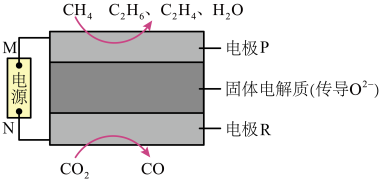
图丁
①电极M为电源的___________ 极;
②电极R上发生的电极反应为___________ 。
(1)利用
 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:

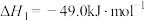
Ⅱ.逆水汽变换:

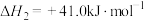
Ⅲ.甲醇脱水:


工艺2:利用
 直接加氢合成
直接加氢合成 (反应Ⅳ)
(反应Ⅳ)①据上述信息可知反应Ⅳ的热化学方程式为
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是
A.气体物质中碳元素与氧元素的质量比不变
B.容器内
 浓度保持不变
浓度保持不变C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)工艺1需先合成甲醇。在不同压强下,按照
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图甲、乙所示。
的平衡产率随温度的变化关系如下图甲、乙所示。
①下列说法正确的是
A.图甲纵坐标表示
 的平衡产率
的平衡产率B.
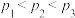
C.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件D.一定温度压强下,提高
 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂②图乙中,某温度时,三条曲线几乎交于一点的原因是
(3)对于合成甲醇的反应:

 ,一定条件下,单位时间内不同温度下测定的
,一定条件下,单位时间内不同温度下测定的 转化率如图丙所示。温度高于
转化率如图丙所示。温度高于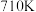 时,随温度的升高
时,随温度的升高 转化率降低的原因可能是
转化率降低的原因可能是
(4)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
图丁
①电极M为电源的
②电极R上发生的电极反应为
您最近一年使用:0次
解题方法
2 . 含碳化合物的资源化综合利用,不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)利用CO、CO2和H2在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-58kJ·mol-1
③CO2(g)+H2(g)=CO(g)+H2O(g) △H
反应③的△H=_______ kJ·mol-1。
(2)工业上可通过甲醇洗基化法制取甲酸甲酯,反应为:CH3OH(g)+CO(g) HCOOCH3(g) △H=-29.1kJ·mol-1。
HCOOCH3(g) △H=-29.1kJ·mol-1。
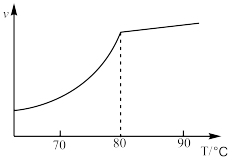
①科研人员对该反应进行了研究,在一定压强时,温度对反应速率的影响如图所示。实际工业生产中采用的温度是80℃,其理由是_______ 。
②反应过程发生副反应:2CH3OH(g) HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
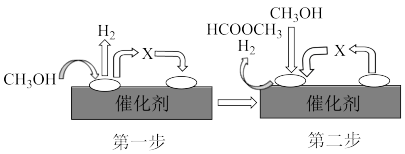
写出第二步的反应方程式_______ 。
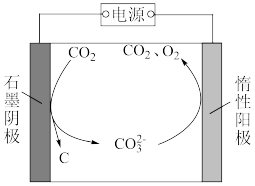
(3)华盛顿大学的研究人员研究出一种方法,可实现CO2零排放,其基本原理如图所示:反应温度控制在900℃时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为_______ 。
(4)CO2气氛下乙苯催化脱氢制苯乙烯的反应为: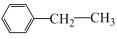 (g)+CO2(g)
(g)+CO2(g)
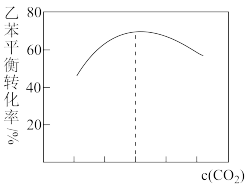
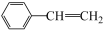 (g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因
(g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因_______ 。
(1)利用CO、CO2和H2在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-58kJ·mol-1
③CO2(g)+H2(g)=CO(g)+H2O(g) △H
反应③的△H=
(2)工业上可通过甲醇洗基化法制取甲酸甲酯,反应为:CH3OH(g)+CO(g)
 HCOOCH3(g) △H=-29.1kJ·mol-1。
HCOOCH3(g) △H=-29.1kJ·mol-1。①科研人员对该反应进行了研究,在一定压强时,温度对反应速率的影响如图所示。实际工业生产中采用的温度是80℃,其理由是

②反应过程发生副反应:2CH3OH(g)
 HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
HCOOCH3(g)+2H2(g)。该反应的机理分二步完成,可以用如图表示:
写出第二步的反应方程式
(3)华盛顿大学的研究人员研究出一种方法,可实现CO2零排放,其基本原理如图所示:反应温度控制在900℃时,电解质为熔融碳酸钠。电解过程中碳元素转化的过程可描述为

(4)CO2气氛下乙苯催化脱氢制苯乙烯的反应为:
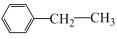 (g)+CO2(g)
(g)+CO2(g)
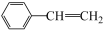 (g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因
(g)+CO(g)+H2O(g)。原料在催化剂面充分吸附进行反应。现保持原料中乙苯浓度不变,增加CO2浓度,乙苯平衡转化率与CO2浓度的关系如图所示,请解释乙苯平衡转化率随着CO2浓度变化的原因
您最近一年使用:0次



