1 . 氮气转化为氮的化合物对于工业制备硝酸有着重要的意义。回答下列问题:
(1)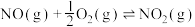
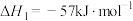
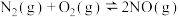

某反应的平衡常数表达式为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为_______ 。
(2)已知反应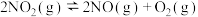 的速率方程为
的速率方程为 ,
,
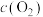 ,其中
,其中 、
、 是正、逆反应的速率常数,且只受温度影响,并随温度升高而增大。
是正、逆反应的速率常数,且只受温度影响,并随温度升高而增大。 时,在2L恒容密闭容器中充入
时,在2L恒容密闭容器中充入 气体发生反应
气体发生反应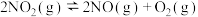 ,不同时刻测得容器中
,不同时刻测得容器中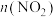 如下表所示:
如下表所示:
①1~4s该反应的平均速率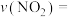
_______ 。
② 温度达到化学平衡时,该反应
温度达到化学平衡时,该反应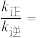
_______ 。
③若将容器的温度改为 ,其他条件不变,当
,其他条件不变,当 时,则
时,则
_______  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(3)对于反应
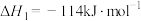 。保持其他初始条件不变,催化反应相同时间内测得NO转化率与温度的关系如图所示。随温度的升高,NO的转化率先增大后减小,理由是
。保持其他初始条件不变,催化反应相同时间内测得NO转化率与温度的关系如图所示。随温度的升高,NO的转化率先增大后减小,理由是_______ ;图中A点如果延长反应时间能_______ (填“提高”“降低”或“不影响”)NO转化率;图中B点如果增加 的浓度能
的浓度能_______ (填“提高”“降低”或“不影响”)NO转化率。
(1)
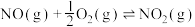
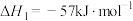
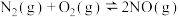

某反应的平衡常数表达式为
 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)已知反应
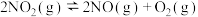 的速率方程为
的速率方程为 ,
,
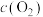 ,其中
,其中 、
、 是正、逆反应的速率常数,且只受温度影响,并随温度升高而增大。
是正、逆反应的速率常数,且只受温度影响,并随温度升高而增大。 时,在2L恒容密闭容器中充入
时,在2L恒容密闭容器中充入 气体发生反应
气体发生反应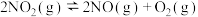 ,不同时刻测得容器中
,不同时刻测得容器中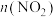 如下表所示:
如下表所示:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
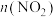 (mol) (mol) | 2.0 | 1.6 | 1.3 | 1.1 | 1.0 | 1.0 |
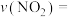
②
 温度达到化学平衡时,该反应
温度达到化学平衡时,该反应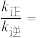
③若将容器的温度改为
 ,其他条件不变,当
,其他条件不变,当 时,则
时,则
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。(3)对于反应

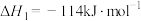 。保持其他初始条件不变,催化反应相同时间内测得NO转化率与温度的关系如图所示。随温度的升高,NO的转化率先增大后减小,理由是
。保持其他初始条件不变,催化反应相同时间内测得NO转化率与温度的关系如图所示。随温度的升高,NO的转化率先增大后减小,理由是 的浓度能
的浓度能
您最近一年使用:0次
2 . 按要求回答下列问题:
(1)下列变化属于吸热反应的是______ (填序号)。
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤ 固体溶于水
固体溶于水
(2)强酸与强碱的稀溶液发生中和反应生成1mol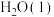 时的反应热
时的反应热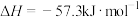 。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为______ 。(结果保留小数点后一位)
(3)已知1g 完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为
完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为______ ,试写出该反应的热化学方程式为______ 。
(4)试比较反应热的大小:
①

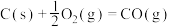
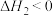
则
______  (填“>”或“<”,下同)。
(填“>”或“<”,下同)。
②已知常温时红磷比白磷稳定。
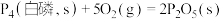

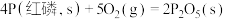

则
______  。
。
(5)已知:25℃、101kPa时,
①

②

③
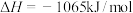
则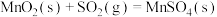

______ 。
(1)下列变化属于吸热反应的是
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤
 固体溶于水
固体溶于水(2)强酸与强碱的稀溶液发生中和反应生成1mol
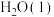 时的反应热
时的反应热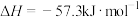 。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为(3)已知1g
 完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为
完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为(4)试比较反应热的大小:
①


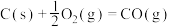
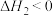
则

 (填“>”或“<”,下同)。
(填“>”或“<”,下同)。②已知常温时红磷比白磷稳定。
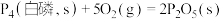

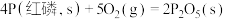

则

 。
。(5)已知:25℃、101kPa时,
①


②


③

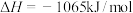
则
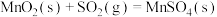

您最近一年使用:0次
2024-05-17更新
|
227次组卷
|
2卷引用:云南省临沧市沧源佤族自治县民族中学2022-2023学年高二上学期第一次月考化学试题
3 . 已知: 、
、 、
、 的燃烧热分别为
的燃烧热分别为 、
、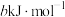 和
和 (a、b、c都大于0)。则反应
(a、b、c都大于0)。则反应 的
的 为
为
 、
、 、
、 的燃烧热分别为
的燃烧热分别为 、
、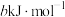 和
和 (a、b、c都大于0)。则反应
(a、b、c都大于0)。则反应 的
的 为
为A. | B. |
C.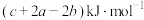 | D.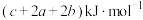 |
您最近一年使用:0次
4 . 图像更能直接地体现化学反应的伴随现象,如能量、速率、浓度等物理量的变化。下列说法错误的是

A.由图甲可知  , ,  ,则 ,则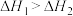 |
B.图乙是在一定条件下,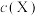 随时间t的变化,正反应 随时间t的变化,正反应 ,M点正反应速率<N点逆反应速率 ,M点正反应速率<N点逆反应速率 |
C.图丙所示反应的热化学方程式为 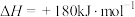 |
D.图丁中t时刻改变的条件可能是增大 的浓度,同时减小 的浓度,同时减小 的浓度 的浓度 |
您最近一年使用:0次
5 . 将 转化为
转化为 是含铅物质转化的重要途径。已知:
是含铅物质转化的重要途径。已知:
①

②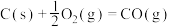

则反应 的
的 是
是
 转化为
转化为 是含铅物质转化的重要途径。已知:
是含铅物质转化的重要途径。已知:①


②
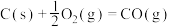

则反应
 的
的 是
是A. | B. |
C. | D. |
您最近一年使用:0次
6 . 第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2(g)+O2(g) 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1
反应H2(g)+Se(s) H2Se(g)的反应热△H=
H2Se(g)的反应热△H=___________ kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s) H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是___________ (填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
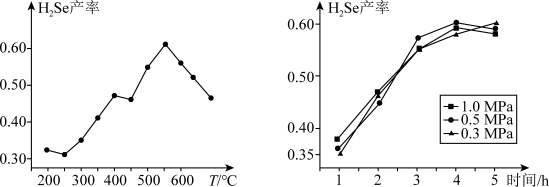
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:___________ 。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈___________ (填“酸性”或“碱性”),该溶液中的物料守恒关系式为___________ 。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________ ,最后通入SO2析出硒单质。
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=___________ (保留2位有效数字)。
(1)已知:①2H2Se(g)+O2(g)
 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1②2H2(g)+O2(g)
 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1反应H2(g)+Se(s)
 H2Se(g)的反应热△H=
H2Se(g)的反应热△H=(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s)
 H2Se(g),
H2Se(g),①下列情况可判断反应达到平衡状态的是
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq)
 CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=
您最近一年使用:0次
7 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
总反应的
___________  ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________ (填标号)。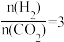 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为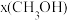 ,在
,在 ℃下的
℃下的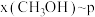 、在
、在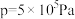 下的
下的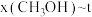 如图所示。
如图所示。
___________ ;
②图中对应等压过程的曲线是___________ ;
③当 时,
时, 的平衡转化率
的平衡转化率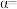
___________ ,反应条件可能为___________ 或___________ 。
(1)二氧化碳加氢制甲醇的总反应可表示为:

该反应一般认为通过如下步骤来实现:
①

②

总反应的

 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是A. 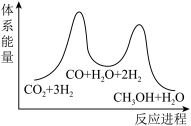 B.
B.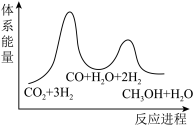
C. D.
D.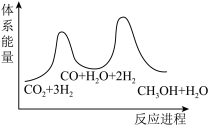
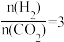 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为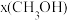 ,在
,在 ℃下的
℃下的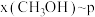 、在
、在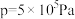 下的
下的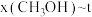 如图所示。
如图所示。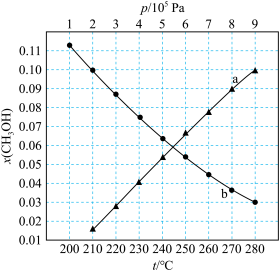

②图中对应等压过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率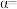
您最近一年使用:0次
8 . 试回答下列有关热化学问题。
(1)根据键能数据计算 的反应热
的反应热
___________ 。
(2) 催化重整反应为
催化重整反应为 。
。
已知:
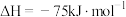
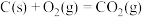
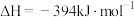
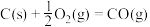
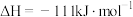
该催化重整反应的
___________  。
。
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图: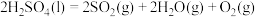

反应Ⅲ: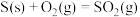
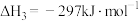
反应Ⅱ的热化学方程式:___________ 。
(4)工业上常用磷精矿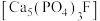 和硫酸反应制备磷酸。已知
和硫酸反应制备磷酸。已知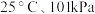 时:
时:

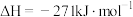
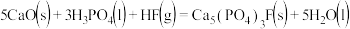
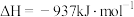
则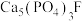 和硫酸反应生成磷酸的热化学方程式是
和硫酸反应生成磷酸的热化学方程式是___________ 。
(5)已知: 钒催化剂参与反应的能量变化如图所示,
钒催化剂参与反应的能量变化如图所示,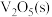 与
与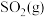 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为___________ 。
(1)根据键能数据计算
 的反应热
的反应热
| 化学键 |  |  |  |  |
键能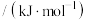 | 414 | 489 | 565 | 155 |
(2)
 催化重整反应为
催化重整反应为 。
。已知:

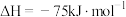
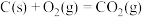
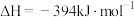
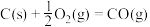
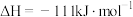
该催化重整反应的

 。
。(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
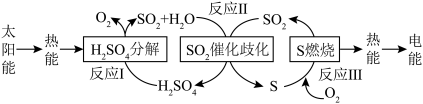
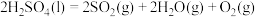

反应Ⅲ:
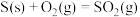
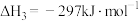
反应Ⅱ的热化学方程式:
(4)工业上常用磷精矿
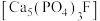 和硫酸反应制备磷酸。已知
和硫酸反应制备磷酸。已知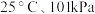 时:
时:
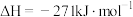
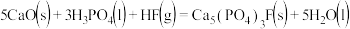
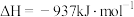
则
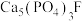 和硫酸反应生成磷酸的热化学方程式是
和硫酸反应生成磷酸的热化学方程式是(5)已知:
 钒催化剂参与反应的能量变化如图所示,
钒催化剂参与反应的能量变化如图所示,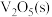 与
与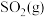 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为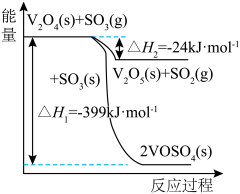
您最近一年使用:0次
9 . 用 溶液吸收热电企业产生的废气时,涉及如图所示转化,由图示关系可得:
溶液吸收热电企业产生的废气时,涉及如图所示转化,由图示关系可得: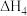 等于
等于
 溶液吸收热电企业产生的废气时,涉及如图所示转化,由图示关系可得:
溶液吸收热电企业产生的废气时,涉及如图所示转化,由图示关系可得: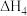 等于
等于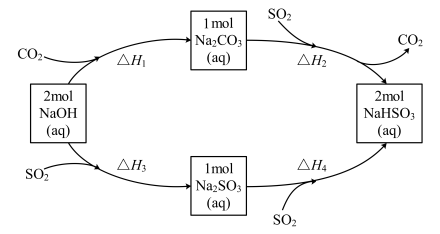
A.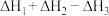 | B. |
C.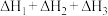 | D.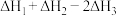 |
您最近一年使用:0次
解题方法
10 . 研究化学反应中的能量变化可以为提高工业生产效率提供指导性的理论依据。请结合所学化学反应原理相关知识回答下列问题:
(1)计算化学反应中的能量变化有多种途径。
①通过化学键的键能计算。已知:
计算可得: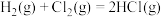

_______ 
②通过盖斯定律计算。已知:
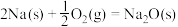
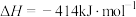

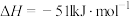
写出Na2O2与Na反应生成Na2O的热化学方程式:_______ 。
(2)实现“节能减排”和“低碳经济”的一项重要课题就是将CO2转化为可利用的资源,工业上有一种方法是用CO2来生产燃料甲醇。
已知:
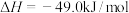 ,在一定条件下,向体积固定为1L的密闭容器中充入1molCO2和3molH2,测得CO2气体和CH3OH(g))的浓度随时间变化曲线如图所示。
,在一定条件下,向体积固定为1L的密闭容器中充入1molCO2和3molH2,测得CO2气体和CH3OH(g))的浓度随时间变化曲线如图所示。
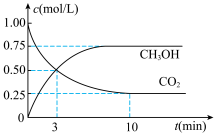
①甲醇中的官能团名称为_______ 。
②反应开始至平衡时,反应速率
_______ mol/(L⋅min)。CO2的平衡转化率为_______ 。
③为了加快化学反应速率,只改变下列某一条件,可采取的措施有_______ (填序号)。
A.升高温度 B.扩大容器体积 C.再充入CO2气体 D.使用合适的催化剂
(1)计算化学反应中的能量变化有多种途径。
①通过化学键的键能计算。已知:
| 化学键 | H—H | Cl—Cl | H—Cl |
| 键能(kJ/mol) | 436 | 247 | 434 |
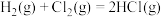


②通过盖斯定律计算。已知:
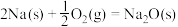
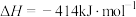

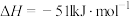
写出Na2O2与Na反应生成Na2O的热化学方程式:
(2)实现“节能减排”和“低碳经济”的一项重要课题就是将CO2转化为可利用的资源,工业上有一种方法是用CO2来生产燃料甲醇。
已知:

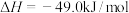 ,在一定条件下,向体积固定为1L的密闭容器中充入1molCO2和3molH2,测得CO2气体和CH3OH(g))的浓度随时间变化曲线如图所示。
,在一定条件下,向体积固定为1L的密闭容器中充入1molCO2和3molH2,测得CO2气体和CH3OH(g))的浓度随时间变化曲线如图所示。
①甲醇中的官能团名称为
②反应开始至平衡时,反应速率

③为了加快化学反应速率,只改变下列某一条件,可采取的措施有
A.升高温度 B.扩大容器体积 C.再充入CO2气体 D.使用合适的催化剂
您最近一年使用:0次



