名校
1 . 工业上常采用氨氧化法制硝酸,其流程是将氨和空气混合后通入灼热的铂铑合金网,反应生成NO(g),生成的一氧化氮与残余的氧气继续反应生成二氧化氮:2NO(g)+O2(g) = 2NO2(g);ΔH = -116.4 kJ·mol-1。随后将二氧化氮通入水中制取硝酸。对于反应2NO(g)+O2(g)  2NO2(g),下列说法正确的是
2NO2(g),下列说法正确的是
 2NO2(g),下列说法正确的是
2NO2(g),下列说法正确的是| A.该反应能够自发的原因是ΔS > 0 |
| B.工业上使用合适的催化剂可提高NO2的生产效率 |
| C.升高温度,该反应V(逆)减小,V(正)增大,平衡向逆反应方向移动 |
| D.2 mol NO(g)和1 mol O2(g)中所含化学键能总和比2 mol NO2(g)中大116.4 kJ·mol-1 |
您最近一年使用:0次
2 . 研发二氧化碳的利用技术具有重要意义。
(1) 还原
还原 是实现“双碳”经济的有效途径之一,相关反应有:
是实现“双碳”经济的有效途径之一,相关反应有:
反应Ⅰ:


反应Ⅱ:


反应Ⅲ:


则反应 的
的
___________ 。
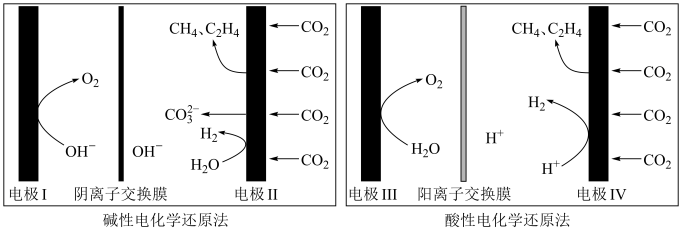
(2)利用电解法在碱性或酸性条件下将 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示:
已知:选择性(S)和法拉第效率(FE)的定义(X代表 或
或 )如下:
)如下:
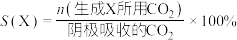
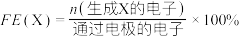
①写出碱性条件下 生成
生成 的电极反应式:
的电极反应式:___________ 。
②实验测得,碱性条件生成 、
、 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是___________ 。
③实验测得,酸性条件生成 、
、 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是___________ 。
④碱性条件下反应一段时间,实验测得 、
、 的选择性及
的选择性及 的法拉第效率如下表所示。则
的法拉第效率如下表所示。则 的法拉第效率
的法拉第效率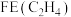 为
为___________ 。
(1)
 还原
还原 是实现“双碳”经济的有效途径之一,相关反应有:
是实现“双碳”经济的有效途径之一,相关反应有:反应Ⅰ:



反应Ⅱ:



反应Ⅲ:



则反应
 的
的
(2)利用电解法在碱性或酸性条件下将
 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示:
已知:选择性(S)和法拉第效率(FE)的定义(X代表
 或
或 )如下:
)如下: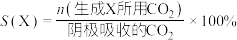
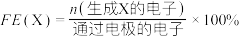
①写出碱性条件下
 生成
生成 的电极反应式:
的电极反应式:②实验测得,碱性条件生成
 、
、 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是③实验测得,酸性条件生成
 、
、 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是④碱性条件下反应一段时间,实验测得
 、
、 的选择性及
的选择性及 的法拉第效率如下表所示。则
的法拉第效率如下表所示。则 的法拉第效率
的法拉第效率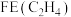 为
为 |  | |
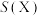 | 2% | 8% |
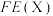 | 12.5% |
您最近一年使用:0次
2024-02-24更新
|
255次组卷
|
2卷引用:江苏省 徐州市第七中学2023-2024学年高三上学期12月月考化学试题
3 . 氢能是一种绿色能源,也是重要的还原剂。目前有多种方法可以制氢并储氢。催化加氢反应可以用于重要化工原料的转化。
Ⅰ.电解法制氢
(1)甲醇电解可制得 ,其原理如图所示。
,其原理如图所示。___________ 。
Ⅱ.催化重整法制氢
(2)已知:反应1:
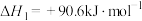
反应2:
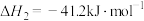
则反应3: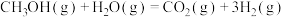
 =
=______ 
(3)以 催化剂进行甲醇重整制氢时,固定其它条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及
催化剂进行甲醇重整制氢时,固定其它条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及 选择性的影响如图所示。
选择性的影响如图所示。 的选择性=
的选择性=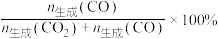
当水、甲醇比大于0.8时, 选择性下降的原因是
选择性下降的原因是___________ 。
(4)铜基催化剂(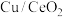 )能高效进行甲醇重整制氢,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。甲醇中混有少量的甲硫醇(
)能高效进行甲醇重整制氢,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。甲醇中混有少量的甲硫醇(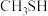 ),重整制氢时加入
),重整制氢时加入 可有效避免铜基催化剂失活且平衡产率略有上升,其原理用化学反应方程式表示为
可有效避免铜基催化剂失活且平衡产率略有上升,其原理用化学反应方程式表示为___________ 。
Ⅲ.催化加氢还原反应的应用 单原子位点对4-硝基苯乙烯有较好吸附效果。
单原子位点对4-硝基苯乙烯有较好吸附效果。
①使用双单原子催化剂可以大大提高4-乙烯基苯胺的产率,原因是_______ 。
Ⅰ.电解法制氢
(1)甲醇电解可制得
 ,其原理如图所示。
,其原理如图所示。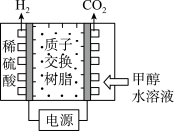
Ⅱ.催化重整法制氢
(2)已知:反应1:

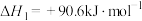
反应2:

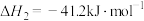
则反应3:
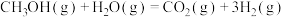
 =
=
(3)以
 催化剂进行甲醇重整制氢时,固定其它条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及
催化剂进行甲醇重整制氢时,固定其它条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及 选择性的影响如图所示。
选择性的影响如图所示。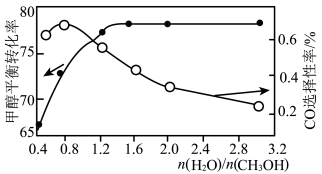
 的选择性=
的选择性=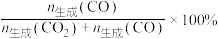
当水、甲醇比大于0.8时,
 选择性下降的原因是
选择性下降的原因是(4)铜基催化剂(
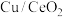 )能高效进行甲醇重整制氢,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。甲醇中混有少量的甲硫醇(
)能高效进行甲醇重整制氢,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。甲醇中混有少量的甲硫醇(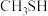 ),重整制氢时加入
),重整制氢时加入 可有效避免铜基催化剂失活且平衡产率略有上升,其原理用化学反应方程式表示为
可有效避免铜基催化剂失活且平衡产率略有上升,其原理用化学反应方程式表示为Ⅲ.催化加氢还原反应的应用
 能将
能将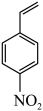 在特定条件下转化为4-乙烯基苯胺
在特定条件下转化为4-乙烯基苯胺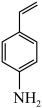 。两种不同催化剂将4-硝基苯乙烯还原加氢的过程如图所示。
。两种不同催化剂将4-硝基苯乙烯还原加氢的过程如图所示。

 单原子位点对4-硝基苯乙烯有较好吸附效果。
单原子位点对4-硝基苯乙烯有较好吸附效果。①使用双单原子催化剂可以大大提高4-乙烯基苯胺的产率,原因是
②请描述4-硝基苯乙烯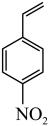 在单原子催化剂下与
在单原子催化剂下与 发生反应的过程
发生反应的过程
您最近一年使用:0次
4 . 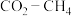 催化重整可获得合成气
催化重整可获得合成气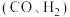 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为
反应①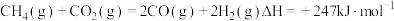
反应②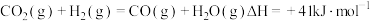
反应③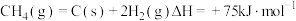
反应④
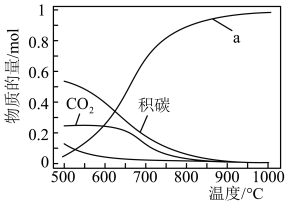
研究发现在密闭容器中 下,
下,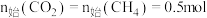 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
 催化重整可获得合成气
催化重整可获得合成气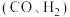 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为反应①
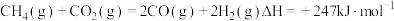
反应②
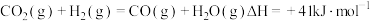
反应③
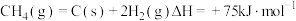
反应④

研究发现在密闭容器中
 下,
下,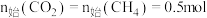 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
A.图中a表示 |
B. 的 的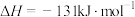 |
C.其他条件不变,在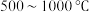 范围,随着温度的升高,平衡时 范围,随着温度的升高,平衡时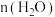 不断增大 不断增大 |
D.当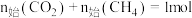 ,其他条件不变时,提高 ,其他条件不变时,提高 的值,能减少平衡时积碳量 的值,能减少平衡时积碳量 |
您最近一年使用:0次
2024-02-13更新
|
1159次组卷
|
4卷引用:江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题
江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)山东省潍坊市2024届高高考模拟训练调研化学试题
5 . 脱除汽车尾气中的NO和CO包括以下两个反应:
Ⅰ.
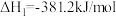
Ⅱ.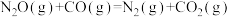
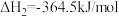
将恒定组成的NO和CO混合气通入不同温度的反应器,相同时间内检测物质浓度,结果如题13图所示。下列说法正确的是
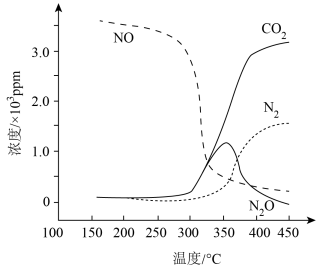
Ⅰ.

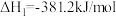
Ⅱ.
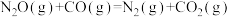
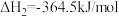
将恒定组成的NO和CO混合气通入不同温度的反应器,相同时间内检测物质浓度,结果如题13图所示。下列说法正确的是

A.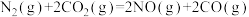 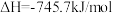 |
| B.使用合适催化剂,能提高NO的平衡转化率 |
| C.其他条件不变,增大体系的压强,NO的平衡转化率增大 |
| D.350℃~420℃范围内,温度升高,反应Ⅰ速率增大的幅度大于反应Ⅱ速率增大的幅度 |
您最近一年使用:0次
6 . 甲烷是一种能量密度低、难液化、运输成本较高的能源。将甲烷转化成能量密度较高的液体燃料已成为重要的课题。
Ⅰ.直接氧化法制甲醇
(1)已知下列反应的热化学方程式:
反应1: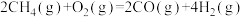

反应2: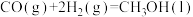
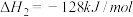
写出甲烷氧化法制甲醇的热化学方程式:______ 。
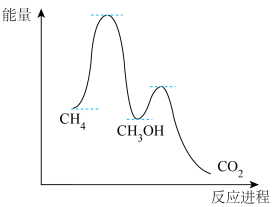
(2)甲烷氧化过程中的活化能垒如图所示。该方法制备CH3OH产率较低,其原因是______ 。
Ⅱ.甲烷的电催化氧化
(3)Hibino科学团队在阳极进行甲烷转化研究,其装置图如图所示,其阳极电极反应式为______ 。

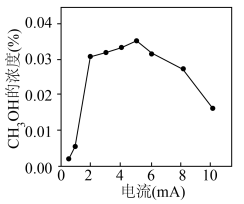
(4)钒(V)物种被认为是形成活性氧物质(如 )的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
)的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是______ 。
Ⅲ.多相催化剂氧化甲烷法
光照条件下,TiO2负载的Fe2O3多相催化剂合成甲醇时,可将甲醇的选择性(选择性 )提升至90%以上,其反应机理如图所示。
)提升至90%以上,其反应机理如图所示。
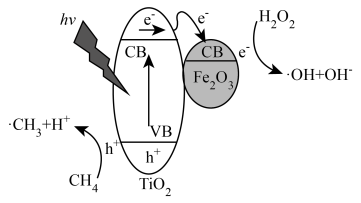
(5)光照时,表面形成的空穴(h+)具有强______ (填“氧化性”或“还原性”)。
(6)写出甲烷通过多相催化剂法制取甲醇的化学方程式______ 。
(7)从反应过程中产生的微粒角度分析,TiO2负载的Fe2O3多相催化剂能将甲醇的选择性提升至90%以上的原因是______ 。
Ⅰ.直接氧化法制甲醇
(1)已知下列反应的热化学方程式:
反应1:
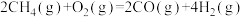

反应2:
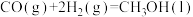
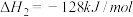
写出甲烷氧化法制甲醇的热化学方程式:
(2)甲烷氧化过程中的活化能垒如图所示。该方法制备CH3OH产率较低,其原因是

Ⅱ.甲烷的电催化氧化
(3)Hibino科学团队在阳极进行甲烷转化研究,其装置图如图所示,其阳极电极反应式为

(4)钒(V)物种被认为是形成活性氧物质(如
 )的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
)的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
Ⅲ.多相催化剂氧化甲烷法
光照条件下,TiO2负载的Fe2O3多相催化剂合成甲醇时,可将甲醇的选择性(选择性
 )提升至90%以上,其反应机理如图所示。
)提升至90%以上,其反应机理如图所示。
(5)光照时,表面形成的空穴(h+)具有强
(6)写出甲烷通过多相催化剂法制取甲醇的化学方程式
(7)从反应过程中产生的微粒角度分析,TiO2负载的Fe2O3多相催化剂能将甲醇的选择性提升至90%以上的原因是
您最近一年使用:0次
名校
解题方法
7 . 利用 和
和 重整技术可获得合成气(主要成分为
重整技术可获得合成气(主要成分为 、
、 ),重整过程中部分反应的热化学方程式:
),重整过程中部分反应的热化学方程式:
反应Ⅰ:
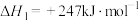
反应Ⅱ:
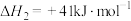
反应Ⅲ:

相同时间内,不同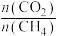 配比随温度变化对出口合成气中
配比随温度变化对出口合成气中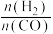 的影响如图所示。
的影响如图所示。

下列说法正确的是
 和
和 重整技术可获得合成气(主要成分为
重整技术可获得合成气(主要成分为 、
、 ),重整过程中部分反应的热化学方程式:
),重整过程中部分反应的热化学方程式:反应Ⅰ:

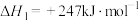
反应Ⅱ:

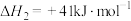
反应Ⅲ:


相同时间内,不同
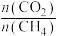 配比随温度变化对出口合成气中
配比随温度变化对出口合成气中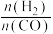 的影响如图所示。
的影响如图所示。
下列说法正确的是
A.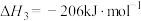 |
B. 时, 时, 点的 点的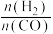 大于 大于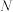 点的是反应Ⅱ导致的 点的是反应Ⅱ导致的 |
| C.使用合适的催化剂可以提高合成气的平衡产率 |
D.当 时,温度高于 时,温度高于 后 后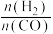 减小是由于反应Ⅲ平衡逆向移动 减小是由于反应Ⅲ平衡逆向移动 |
您最近一年使用:0次
解题方法
8 . 尿素  是常用的化肥与工业原料,其生产与应用有着重要的意义。
是常用的化肥与工业原料,其生产与应用有着重要的意义。
(1)尿素生产一般控制在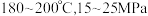 下进行,主要涉及下列反应:
下进行,主要涉及下列反应:
反应1
反应2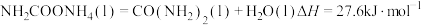
反应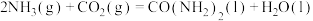 的
的
___________ 。
(2) 具有强还原性,生产尿素过程中,常通入适量氧气防止镍制容器表面的金属钝化膜
具有强还原性,生产尿素过程中,常通入适量氧气防止镍制容器表面的金属钝化膜 被破坏。
被破坏。
① 与
与 反应产生
反应产生 的化学方程式为
的化学方程式为___________ 。
②生产时通入的 气体中常混有少量
气体中常混有少量 。有氧气存在的条件下,
。有氧气存在的条件下, 腐蚀反应容器的速率会更快,其原因是
腐蚀反应容器的速率会更快,其原因是___________ 。
(3)尿素在结晶过程中主要副反应是尿素发生脱氨反应。其反应历程如下:
反应3 CO(NH2)2(l)=HNCO(g)+NH3(g) (快反应)
反应4 HNCO(g)+CO(NH2)2(l)=(H2NCO)2NH(l)(缩二脲) (慢反应)
①在缩二脲的结构式( )中圈出电子云密度最小的氢原子
)中圈出电子云密度最小的氢原子___________ 。
②在尿素结晶过程中,反应3可视为处于平衡状态。实验表明,在合成尿素的体系中, 的浓度越高,缩二脲生成速率越慢,其原因是
的浓度越高,缩二脲生成速率越慢,其原因是___________ 。
(4)含结晶水的 晶体表面存在结构“
晶体表面存在结构“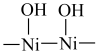 ”,用加热后的
”,用加热后的  晶体作催化剂,以
晶体作催化剂,以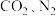 为原料,电解
为原料,电解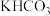 溶液可获得尿素。
溶液可获得尿素。
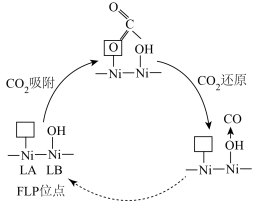
①生成尿素的电极方程式为___________ 。
②加热后的 晶体表面会产生
晶体表面会产生 位点,
位点, 位点与
位点与 位点共同形成
位点共同形成 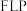 位点,其催化机理(部分)如图所示。实验表明,在
位点,其催化机理(部分)如图所示。实验表明,在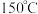 下加热
下加热  晶体得到的催化剂催化效果最好,温度过高或过低催化效果会降低的原因是
晶体得到的催化剂催化效果最好,温度过高或过低催化效果会降低的原因是___________ 。
③电解质溶液中若存在 极大地降低催化剂的活性,原因是
极大地降低催化剂的活性,原因是___________ 。
 是常用的化肥与工业原料,其生产与应用有着重要的意义。
是常用的化肥与工业原料,其生产与应用有着重要的意义。(1)尿素生产一般控制在
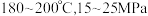 下进行,主要涉及下列反应:
下进行,主要涉及下列反应:反应1

反应2
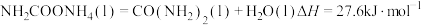
反应
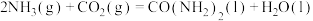 的
的
(2)
 具有强还原性,生产尿素过程中,常通入适量氧气防止镍制容器表面的金属钝化膜
具有强还原性,生产尿素过程中,常通入适量氧气防止镍制容器表面的金属钝化膜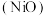 被破坏。
被破坏。①
 与
与 反应产生
反应产生 的化学方程式为
的化学方程式为②生产时通入的
 气体中常混有少量
气体中常混有少量 。有氧气存在的条件下,
。有氧气存在的条件下, 腐蚀反应容器的速率会更快,其原因是
腐蚀反应容器的速率会更快,其原因是(3)尿素在结晶过程中主要副反应是尿素发生脱氨反应。其反应历程如下:
反应3 CO(NH2)2(l)=HNCO(g)+NH3(g) (快反应)
反应4 HNCO(g)+CO(NH2)2(l)=(H2NCO)2NH(l)(缩二脲) (慢反应)
①在缩二脲的结构式(
 )中圈出电子云密度最小的氢原子
)中圈出电子云密度最小的氢原子②在尿素结晶过程中,反应3可视为处于平衡状态。实验表明,在合成尿素的体系中,
 的浓度越高,缩二脲生成速率越慢,其原因是
的浓度越高,缩二脲生成速率越慢,其原因是(4)含结晶水的
 晶体表面存在结构“
晶体表面存在结构“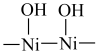 ”,用加热后的
”,用加热后的  晶体作催化剂,以
晶体作催化剂,以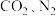 为原料,电解
为原料,电解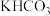 溶液可获得尿素。
溶液可获得尿素。
①生成尿素的电极方程式为
②加热后的
 晶体表面会产生
晶体表面会产生 位点,
位点, 位点与
位点与 位点共同形成
位点共同形成 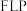 位点,其催化机理(部分)如图所示。实验表明,在
位点,其催化机理(部分)如图所示。实验表明,在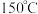 下加热
下加热  晶体得到的催化剂催化效果最好,温度过高或过低催化效果会降低的原因是
晶体得到的催化剂催化效果最好,温度过高或过低催化效果会降低的原因是③电解质溶液中若存在
 极大地降低催化剂的活性,原因是
极大地降低催化剂的活性,原因是
您最近一年使用:0次
9 .  、
、 是重要污染物,处理
是重要污染物,处理 、
、 等污染物对建设美丽中国具有重要意义。回答下列问题。
等污染物对建设美丽中国具有重要意义。回答下列问题。
(1)已知 还原
还原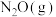 的反应机理如图1所示:
的反应机理如图1所示:
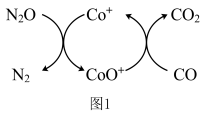
已知:
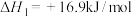

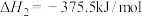
则 与
与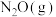 反应的热化学方程式为
反应的热化学方程式为___________ 。
(2)研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。雨水中含有来自大气中的 ,溶于水的
,溶于水的 只有部分转化为
只有部分转化为 。已知
。已知 时,
时,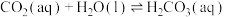
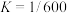 ,正反应的速率可表示为
,正反应的速率可表示为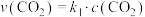 ,逆反应的速率可表示
,逆反应的速率可表示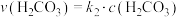 ,则
,则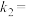
___________ (用含 的代数式表示)。
的代数式表示)。
(3)电解法转化 是实现可再生能源有效利用的关键手段之一,其装置原理如图2所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图2所示。

① 为电源的
为电源的___________ (填“正极”或“负极”),该装置的阴极的电极反应式为___________ 。
②若电解开始前两极室溶液质量相等,当电解过程转移了 电子,则阴阳极室溶液质量差为
电子,则阴阳极室溶液质量差为___________  。
。
(4)近年来,低温等离子技术是在高压放电下, 产生
产生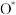 自由基,
自由基,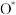 自由基将
自由基将 氧化为
氧化为 后,再用
后,再用 溶液吸收,达到消除
溶液吸收,达到消除 的目的。实验室将模拟气(
的目的。实验室将模拟气( 、
、 、
、 )以一定流速通入低温等离子体装置,实验装置如图3所示。
)以一定流速通入低温等离子体装置,实验装置如图3所示。

已知:
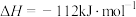 。
。
①等离子体技术在低温条件下可提高 的转化率,原因是
的转化率,原因是___________ 。
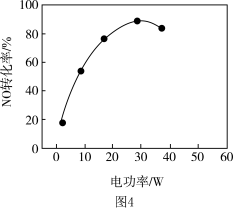
②其他条件相同,等离子体的电功率与 的转化率关系如图4所示,当电功率大于
的转化率关系如图4所示,当电功率大于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是___________ 。
 、
、 是重要污染物,处理
是重要污染物,处理 、
、 等污染物对建设美丽中国具有重要意义。回答下列问题。
等污染物对建设美丽中国具有重要意义。回答下列问题。(1)已知
 还原
还原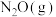 的反应机理如图1所示:
的反应机理如图1所示: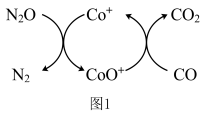
已知:

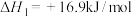

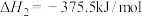
则
 与
与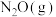 反应的热化学方程式为
反应的热化学方程式为(2)研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。雨水中含有来自大气中的
 ,溶于水的
,溶于水的 只有部分转化为
只有部分转化为 。已知
。已知 时,
时,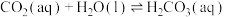
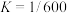 ,正反应的速率可表示为
,正反应的速率可表示为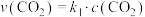 ,逆反应的速率可表示
,逆反应的速率可表示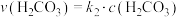 ,则
,则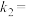
 的代数式表示)。
的代数式表示)。(3)电解法转化
 是实现可再生能源有效利用的关键手段之一,其装置原理如图2所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图2所示。
①
 为电源的
为电源的②若电解开始前两极室溶液质量相等,当电解过程转移了
 电子,则阴阳极室溶液质量差为
电子,则阴阳极室溶液质量差为 。
。(4)近年来,低温等离子技术是在高压放电下,
 产生
产生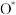 自由基,
自由基,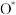 自由基将
自由基将 氧化为
氧化为 后,再用
后,再用 溶液吸收,达到消除
溶液吸收,达到消除 的目的。实验室将模拟气(
的目的。实验室将模拟气( 、
、 、
、 )以一定流速通入低温等离子体装置,实验装置如图3所示。
)以一定流速通入低温等离子体装置,实验装置如图3所示。
已知:

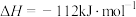 。
。①等离子体技术在低温条件下可提高
 的转化率,原因是
的转化率,原因是②其他条件相同,等离子体的电功率与
 的转化率关系如图4所示,当电功率大于
的转化率关系如图4所示,当电功率大于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是
您最近一年使用:0次
名校
10 . 环氧乙烷(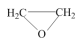 ,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。
,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。
(1)一定条件下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)的过程中部分物料与能量变化如图所示。
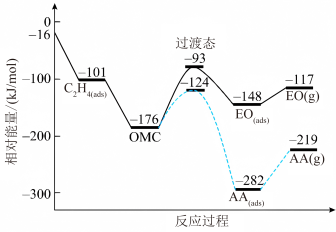
①中间体OMC生成吸附态EO(ads)的活化能为_______ kJ/mol。
②由EO(g)生成AA(g)的热化学方程式为_______ 。
(2)一定条件下,用Ag作催化剂,氧气直接氧化乙烯制环氧乙烷(部分机理未配平)。
主反应:2CH2=CH2(g)+O2(g)=2EO(g) ΔH=-213.8kJ/mol
副反应:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH=-1323kJ/mol
催化机理:O2+Ag(助剂)→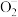 (ads)+Ag+
(ads)+Ag+
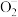 (ads)+ CH2=CH2+Ag+→EO+ O(ads)+Ag
(ads)+ CH2=CH2+Ag+→EO+ O(ads)+Ag
O(ads)+ CH2=CH2→CO2+H2O
实际生产采用220-260℃的可能原因是________ 。
(3)乙烯电解制备EO的原理示意如图。
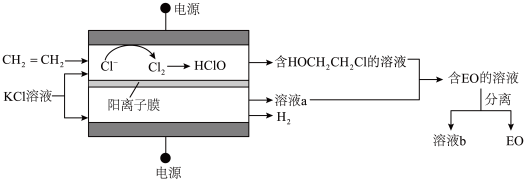
阳极室产生Cl2后发生的反应有:Cl2+H2O=HCl+HClO、CH2=CH2+HClO=HOCH2CH2Cl。
法拉第效率FE的定义:FE(B)= ×100%
×100%
①若FE(EO)=100%,则溶液b的溶质为________ (化学式)。
②一定条件下,反应物按一定流速通过该装置。当乙烯完全消耗时,测得FE(EO)≈70%,S(EO)≈97%。
推测FE(EO)≈70%的原因:若没有生成EO的乙烯全部在阳极放电生成CO2,则生成CO2的电极反应方程式为______ ,FE(CO2)≈____ %。经检验阳极放电产物没有CO2,则S(EO)≈97%的可能原因是______ 。
 ,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。
,简称EO)是一种重要的工业原料和消毒剂。工业上用乙烯制备EO。(1)一定条件下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)的过程中部分物料与能量变化如图所示。

①中间体OMC生成吸附态EO(ads)的活化能为
②由EO(g)生成AA(g)的热化学方程式为
(2)一定条件下,用Ag作催化剂,氧气直接氧化乙烯制环氧乙烷(部分机理未配平)。
主反应:2CH2=CH2(g)+O2(g)=2EO(g) ΔH=-213.8kJ/mol
副反应:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH=-1323kJ/mol
催化机理:O2+Ag(助剂)→
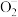 (ads)+Ag+
(ads)+Ag+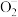 (ads)+ CH2=CH2+Ag+→EO+ O(ads)+Ag
(ads)+ CH2=CH2+Ag+→EO+ O(ads)+AgO(ads)+ CH2=CH2→CO2+H2O
实际生产采用220-260℃的可能原因是
(3)乙烯电解制备EO的原理示意如图。

阳极室产生Cl2后发生的反应有:Cl2+H2O=HCl+HClO、CH2=CH2+HClO=HOCH2CH2Cl。
法拉第效率FE的定义:FE(B)=
 ×100%
×100%①若FE(EO)=100%,则溶液b的溶质为
②一定条件下,反应物按一定流速通过该装置。当乙烯完全消耗时,测得FE(EO)≈70%,S(EO)≈97%。
推测FE(EO)≈70%的原因:若没有生成EO的乙烯全部在阳极放电生成CO2,则生成CO2的电极反应方程式为
您最近一年使用:0次



