名校
1 . 完成下列问题
(1)已知:①

②

则

___________ 。
(2)已知:①

②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

 ,则a=
,则a=___________ 。
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(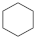 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是___________ ;反应 (l)=
(l)= (l)的
(l)的
___________ 。

(1)已知:①


②


则


(2)已知:①


②


则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)= (l)的
(l)的

您最近一年使用:0次
2 . 我国要在2030年前实现碳达峰、2060年前实现碳中和的目标,CO2的捕集与转化是研究的重要课题。
(1)CO2和CH4重整可制合成气CO和H2,其热化学反应方程式为CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。
已知下列热化学反应方程式:
反应1:C(s)+2H2(g)=CH4(g) ΔH1
反应2:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-40.0 kJ·mol-1
反应3:C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+132.0 kJ·mol-1
则ΔH1=___________ kJ·mol-1。
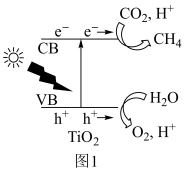
(2)光催化还原法实现CO2甲烷化可能的反应机理如图1所示。该过程可描述为:光照条件下,催化剂TiO2的价带(VB)中的电子激发至导带(CB)中,价带中形成电子空穴(h+),___________ 。
(3)一种电化学法将CO2转化为乙烯的原理如图2所示。
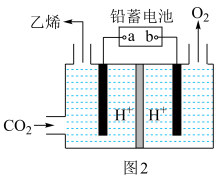
①阴极上的电极反应式为___________ 。
②以铅蓄电池为电源,每生成0.5 mol乙烯,理论上产生O2的物质的量为___________ 。
(1)CO2和CH4重整可制合成气CO和H2,其热化学反应方程式为CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。
已知下列热化学反应方程式:
反应1:C(s)+2H2(g)=CH4(g) ΔH1
反应2:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-40.0 kJ·mol-1
反应3:C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+132.0 kJ·mol-1
则ΔH1=
(2)光催化还原法实现CO2甲烷化可能的反应机理如图1所示。该过程可描述为:光照条件下,催化剂TiO2的价带(VB)中的电子激发至导带(CB)中,价带中形成电子空穴(h+),

(3)一种电化学法将CO2转化为乙烯的原理如图2所示。

①阴极上的电极反应式为
②以铅蓄电池为电源,每生成0.5 mol乙烯,理论上产生O2的物质的量为
您最近一年使用:0次
名校
3 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于放热反应的是_____ (填字母)。
A. 碳与水蒸气反应
B. 铝和氧化铁反应
C. CaCO3受热分解
D. 氢气还原三氧化钨制取钨
E. 锌与盐酸反应
(2)获取能量变化的途径
①已知:
则:SiCl4(g)+2H2(g)= Si(s)+4HCl(g)的反应热
_____ 
②已知在常温常压下:
i、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)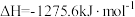
ii、H2O(l)=H2O(g)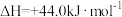
写出表示甲醇燃烧热的热化学方程式_____ 。
(3)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为____________ 。
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。
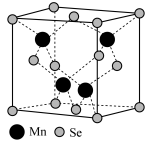
①β-MnSe中Mn的配位数为_______ 。
②Mn2+的价电子排布式为_______ 。
(1)下列反应中,属于放热反应的是
A. 碳与水蒸气反应
B. 铝和氧化铁反应
C. CaCO3受热分解
D. 氢气还原三氧化钨制取钨
E. 锌与盐酸反应
(2)获取能量变化的途径
①已知:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能(kJ·mol-1) | 460 | 360 | 436 | 431 | 176 | 347 |


②已知在常温常压下:
i、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)
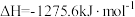
ii、H2O(l)=H2O(g)
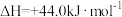
写出表示甲醇燃烧热的热化学方程式
(3)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为
(4)最近科学家研制出超薄铁磁β-MnSe半导体,β-MnSe的晶胞结构如图所示。

①β-MnSe中Mn的配位数为
②Mn2+的价电子排布式为
您最近一年使用:0次
解题方法
4 . 回答下列问题
(1) 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下: ,则S(单斜,s)、S(斜方,s)相比,较稳定的是
,则S(单斜,s)、S(斜方,s)相比,较稳定的是___________ [填“S(单斜,s)”或“S(斜方、s)”]。
(2)下表中的数据表示破坏 化学键需消耗的能量(即键能,单位为
化学键需消耗的能量(即键能,单位为 )。
)。
热化学方程式: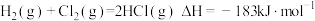 ,则
,则 键的键能为
键的键能为___________  。
。
(3)标准状况下,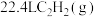 在
在 中完全燃烧生成
中完全燃烧生成 和
和 ,放出
,放出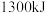 热量,请写出该反应的热化学方程式:
热量,请写出该反应的热化学方程式:___________ 。
(4)已知: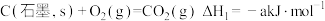
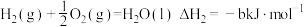
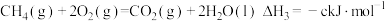
计算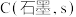 与
与 反应生成
反应生成 的
的 为
为___________ (用含a、b、c的式子表示) 。
。
(5) 和
和 反应生成
反应生成 和
和 的能量变化如图所示。则反应过程中,每生成
的能量变化如图所示。则反应过程中,每生成 理论上放出的热量为
理论上放出的热量为___________
(1)
 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下: ,则S(单斜,s)、S(斜方,s)相比,较稳定的是
,则S(单斜,s)、S(斜方,s)相比,较稳定的是(2)下表中的数据表示破坏
 化学键需消耗的能量(即键能,单位为
化学键需消耗的能量(即键能,单位为 )。
)。| 化学键 |  |  |
| 键能 | 436 | 431 |
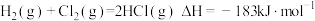 ,则
,则 键的键能为
键的键能为 。
。(3)标准状况下,
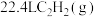 在
在 中完全燃烧生成
中完全燃烧生成 和
和 ,放出
,放出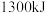 热量,请写出该反应的热化学方程式:
热量,请写出该反应的热化学方程式:(4)已知:
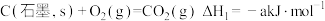
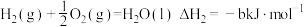
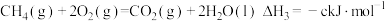
计算
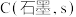 与
与 反应生成
反应生成 的
的 为
为 。
。(5)
 和
和 反应生成
反应生成 和
和 的能量变化如图所示。则反应过程中,每生成
的能量变化如图所示。则反应过程中,每生成 理论上放出的热量为
理论上放出的热量为
您最近一年使用:0次
名校
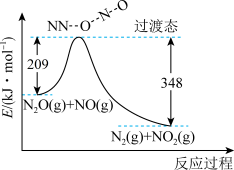
5 . N2O、NO和NO2等氮氧化物是空气污染物。含有氨氧化物的尾气需处理后才能排放。
(1)N2O的处理,N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化制作用下生成N2O的化学方程式为_____ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH-=2 +H2O、2NO2+2OH-=
+H2O、2NO2+2OH-= +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有_____ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是_____ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是_____ (填化学式)。
③用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(1)=HNO3(aq)+HNO2(aq) △H=-116.1kJ/mol;
3HNO2(aq)=HNO3(aq)+2NO(g)H2O(1) △H=+75.9kJ/mol
反应3NO2(g)+H2O(1)=2HNO3(aq)+NO(g)的△H=_____ kJ/mol。
④用稀硝酸吸收NO得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应_____ 。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO液中,HClO氧化NO生成Cl-和 ,其离子方程式为
,其离子方程式为_____ 。
(1)N2O的处理,N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化制作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH-=2
 +H2O、2NO2+2OH-=
+H2O、2NO2+2OH-= +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
③用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(1)=HNO3(aq)+HNO2(aq) △H=-116.1kJ/mol;
3HNO2(aq)=HNO3(aq)+2NO(g)H2O(1) △H=+75.9kJ/mol
反应3NO2(g)+H2O(1)=2HNO3(aq)+NO(g)的△H=
④用稀硝酸吸收NO得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO液中,HClO氧化NO生成Cl-和
 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
6 . 化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cρV总△T计算获得。
(1)盐酸浓度的测定:移取20.00mL特测液,加入指示利,用0.500mol/LNaOH溶液滴定至终点消耗NaOH溶液22.00mL。该盐酸浓度为_____ mol/L。
(2)热量的测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为_____ J(c和ρ分别取4.18J/g·℃和1.0g/mL,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4 (aq)=FeSO4(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响,下同)。实验结果见如表。
①温度:b_____ c(填“>”“<”或“=”)。
②△H=_____ (选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq)=3FeSO4(aq)的焓变。
查阅资料:配制Fe2(SO4)3溶液时需加入酸。加酸的目的是抑制Fe3+水解。
提出猜想:Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和_____ (用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为_____ 。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用_____ 。
(1)盐酸浓度的测定:移取20.00mL特测液,加入指示利,用0.500mol/LNaOH溶液滴定至终点消耗NaOH溶液22.00mL。该盐酸浓度为
(2)热量的测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4 (aq)=FeSO4(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响,下同)。实验结果见如表。
| 反应试剂 | 体系温度/℃ | |||
| 反应前 | 反应后 | |||
| ⅰ | 0.20mol/LCuSO4溶液100mL | 1.20gFe粉 | A | b |
| ⅱ | 0.56gFe粉 | a | C | |
②△H=
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq)=3FeSO4(aq)的焓变。
查阅资料:配制Fe2(SO4)3溶液时需加入酸。加酸的目的是抑制Fe3+水解。
提出猜想:Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为
(5)化学能可转化为热能,写出其在生产或生活中的一种应用
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题:
(1)①常温常压下 在
在 中完全燃烧放出
中完全燃烧放出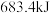 的热量。写出
的热量。写出 标准燃烧热的热化学方程式
标准燃烧热的热化学方程式_______ 。
②常温常压下,强酸和强碱的稀溶液反应的中和热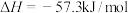 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。
(2)已知下列反应的热化学方程式:






则反应 的
的
_______ 。(用含a、b、c的代数式表示)
(3)已知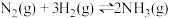
 ,拆开
,拆开 键和
键和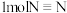 键需要的能量分别是
键需要的能量分别是 和
和 ,则拆开
,则拆开 键需要的能量是
键需要的能量是_______  。
。
(1)①常温常压下
 在
在 中完全燃烧放出
中完全燃烧放出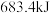 的热量。写出
的热量。写出 标准燃烧热的热化学方程式
标准燃烧热的热化学方程式②常温常压下,强酸和强碱的稀溶液反应的中和热
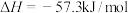 ,写出该反应的化学方程式
,写出该反应的化学方程式(2)已知下列反应的热化学方程式:






则反应
 的
的
(3)已知
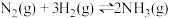
 ,拆开
,拆开 键和
键和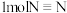 键需要的能量分别是
键需要的能量分别是 和
和 ,则拆开
,则拆开 键需要的能量是
键需要的能量是 。
。
您最近一年使用:0次
名校
解题方法
8 . 氢元素单质及其化合物是人类赖以生活的重要能源。回答下列问题:
(1)肼(N2H4)是一种液态火箭推进剂。N2H4分解的能量变化如图所示:

①正反应的活化能为___________ kJ·mol-1,气态肼分解的热化学方程式为___________ 。
②该反应断开反应物中化学键吸收的总能量___________ (填“>”“<”或“=”)形成生成物中化学键放出的总能量。
(2)盖斯定律认为:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①反应A+B→C(△H<0)分两步进行:
(i)A+B→X(△H>0)
(ii)X→C(△H<0)
下列示意图中,能正确表示总反应过程中能量变化的是___________ (填字母)。

②已知:H2O(g)=H2O(l) △H1=-Q1kJ·mol-1
C2H5OH(g)=C2H5OH(1) △H2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ·mol-1
则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)的△H=___________ kJ·mol-1,若将23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为___________ kJ。
(1)肼(N2H4)是一种液态火箭推进剂。N2H4分解的能量变化如图所示:

①正反应的活化能为
②该反应断开反应物中化学键吸收的总能量
(2)盖斯定律认为:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①反应A+B→C(△H<0)分两步进行:
(i)A+B→X(△H>0)
(ii)X→C(△H<0)
下列示意图中,能正确表示总反应过程中能量变化的是

②已知:H2O(g)=H2O(l) △H1=-Q1kJ·mol-1
C2H5OH(g)=C2H5OH(1) △H2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ·mol-1
则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)的△H=
您最近一年使用:0次
9 . NOx、CO是重要污染物,处理NOx、CO等污染物对建设美丽中国具有重要意义。回答下列问题。
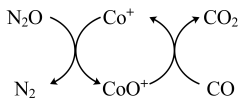
(1)已知CO(g)还原 的反应机理如图所示
的反应机理如图所示
已知:


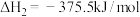
CO(g)与 反应的热化学方程式为
反应的热化学方程式为___________ 。
(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为 ,发生反应
,发生反应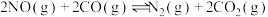 ,达到平衡时NO(g)和
,达到平衡时NO(g)和 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为___________ (结果保留一位小数),该反应的化学平衡常数Kp=___________ 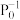 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,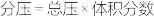 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则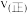
___________ 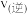 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(3)对于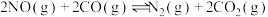 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
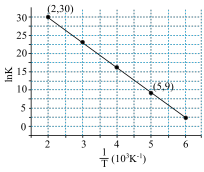
则该反应的活化能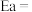
___________  。
。
(4)电解法转化 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
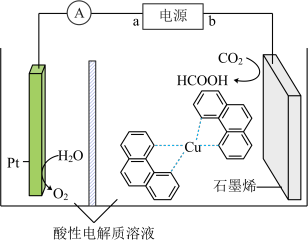
①a为电源的___________ (填“正极”或“负极”),该装置的阴极的电极反应式为___________ 。
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为___________ g。

(1)已知CO(g)还原
 的反应机理如图所示
的反应机理如图所示已知:



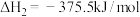
CO(g)与
 反应的热化学方程式为
反应的热化学方程式为(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为
 ,发生反应
,发生反应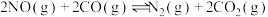 ,达到平衡时NO(g)和
,达到平衡时NO(g)和 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为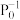 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,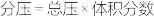 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则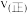
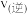 (填“>”“<”或“=”)
(填“>”“<”或“=”)(3)对于
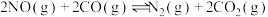 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
则该反应的活化能
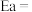
 。
。(4)电解法转化
 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
①a为电源的
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为
您最近一年使用:0次
2023-08-15更新
|
500次组卷
|
2卷引用:江苏省淮安市高中校协作体2023-2024学年高三上学期期中联考化学试题
名校
10 . 填空
(1)已知下列热化学方程式:
①H2O(1)=H2(g)+ O2(g) △H1=285.8 kJ∙mol−1
O2(g) △H1=285.8 kJ∙mol−1
②C(s)+ O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
③H2O(g)=H2(g)+ O2(g) △H3=241.8 kJ∙mol−1
O2(g) △H3=241.8 kJ∙mol−1
上述反应中属于放热反应的是_____ 。
(2)①的反应过程是太阳光催化分解水制氢气,该反应中主要能量转化形式为_____ 。
a.太阳能转化为化学能 b.化学能转化为电能
(3)若反应③使用催化剂,那么△H3将_____ (填“增大”“减小”或“不变”)
(4)反应C(s)+H2O(g)=CO(g)+H2(g)的△H=_____ kJ∙mol−1。
(5)0.1mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼(B2O3)和气态水,释放203.3kJ的热。
①写出反应的热化学方程式_____ 。
②H2O(1)=H2O(g) △H=_____ kJ∙mol−1。
③11.2L(标准状况)气态乙硼烷(B2H6)完全燃烧生成液态水生成的热_____ kJ。
(1)已知下列热化学方程式:
①H2O(1)=H2(g)+
 O2(g) △H1=285.8 kJ∙mol−1
O2(g) △H1=285.8 kJ∙mol−1②C(s)+
 O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
O2(g)=CO(g) △H2=−110.5 kJ∙mol−1③H2O(g)=H2(g)+
 O2(g) △H3=241.8 kJ∙mol−1
O2(g) △H3=241.8 kJ∙mol−1上述反应中属于放热反应的是
(2)①的反应过程是太阳光催化分解水制氢气,该反应中主要能量转化形式为
a.太阳能转化为化学能 b.化学能转化为电能
(3)若反应③使用催化剂,那么△H3将
(4)反应C(s)+H2O(g)=CO(g)+H2(g)的△H=
(5)0.1mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼(B2O3)和气态水,释放203.3kJ的热。
①写出反应的热化学方程式
②H2O(1)=H2O(g) △H=
③11.2L(标准状况)气态乙硼烷(B2H6)完全燃烧生成液态水生成的热
您最近一年使用:0次
2023-07-28更新
|
453次组卷
|
2卷引用:江苏省淮安市淮安区2022-2023学年高二上学期期中调研测试化学试题



