名校
1 . 氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______ kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________ 。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________ ;为抑制肼的分解,可采取的合理措施有________ (任写一种)。
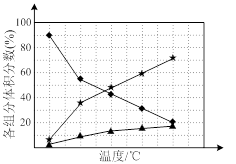
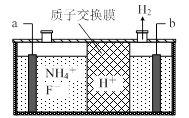
图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________ 。
② a电极为电解池的_____________ (填“阴”或“阳”)极,写出该电极的电极反应式:________________ ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________ 。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:


图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为
② a电极为电解池的
您最近半年使用:0次
2016-01-21更新
|
369次组卷
|
3卷引用:2015届江苏省南通、扬州、连云港高三第二次调研测试化学试卷
2 . 氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=________ kJ·mol-1。
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
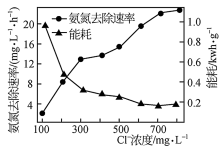
①写出电解时阳极的电极反应式:________________ 。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是____________________________ 。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是____________________________ 。
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为________________________________ 。
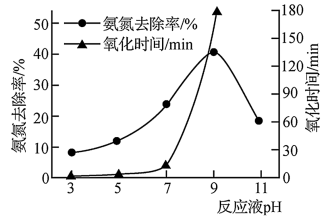
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是_________________ 。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。

①写出电解时阳极的电极反应式:
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是

您最近半年使用:0次
2020-04-14更新
|
446次组卷
|
2卷引用:江苏省苏锡常镇四市2020届高三教学情况调查(一) 化学试题
3 . 甲烷是一种能量密度低、难液化、运输成本较高的能源。将甲烷转化成能量密度较高的液体燃料已成为重要的课题。
Ⅰ.直接氧化法制甲醇
(1)已知下列反应的热化学方程式:
反应1: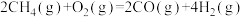

反应2: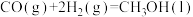
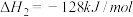
写出甲烷氧化法制甲醇的热化学方程式:______ 。
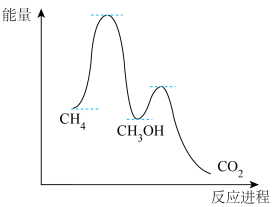
(2)甲烷氧化过程中的活化能垒如图所示。该方法制备CH3OH产率较低,其原因是______ 。
Ⅱ.甲烷的电催化氧化
(3)Hibino科学团队在阳极进行甲烷转化研究,其装置图如图所示,其阳极电极反应式为______ 。

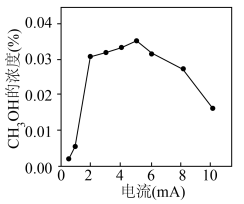
(4)钒(V)物种被认为是形成活性氧物质(如 )的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
)的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是______ 。
Ⅲ.多相催化剂氧化甲烷法
光照条件下,TiO2负载的Fe2O3多相催化剂合成甲醇时,可将甲醇的选择性(选择性 )提升至90%以上,其反应机理如图所示。
)提升至90%以上,其反应机理如图所示。
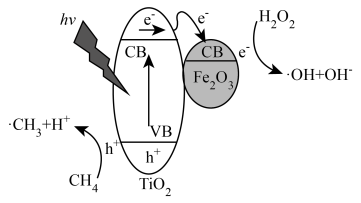
(5)光照时,表面形成的空穴(h+)具有强______ (填“氧化性”或“还原性”)。
(6)写出甲烷通过多相催化剂法制取甲醇的化学方程式______ 。
(7)从反应过程中产生的微粒角度分析,TiO2负载的Fe2O3多相催化剂能将甲醇的选择性提升至90%以上的原因是______ 。
Ⅰ.直接氧化法制甲醇
(1)已知下列反应的热化学方程式:
反应1:
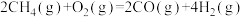

反应2:
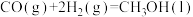
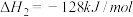
写出甲烷氧化法制甲醇的热化学方程式:
(2)甲烷氧化过程中的活化能垒如图所示。该方法制备CH3OH产率较低,其原因是

Ⅱ.甲烷的电催化氧化
(3)Hibino科学团队在阳极进行甲烷转化研究,其装置图如图所示,其阳极电极反应式为

(4)钒(V)物种被认为是形成活性氧物质(如
 )的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
)的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
Ⅲ.多相催化剂氧化甲烷法
光照条件下,TiO2负载的Fe2O3多相催化剂合成甲醇时,可将甲醇的选择性(选择性
 )提升至90%以上,其反应机理如图所示。
)提升至90%以上,其反应机理如图所示。
(5)光照时,表面形成的空穴(h+)具有强
(6)写出甲烷通过多相催化剂法制取甲醇的化学方程式
(7)从反应过程中产生的微粒角度分析,TiO2负载的Fe2O3多相催化剂能将甲醇的选择性提升至90%以上的原因是
您最近半年使用:0次
4 . 煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s) + CO2(g)△H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)⇌CaSO4(s)△H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g)△H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g)△H4= +218.92kJ/mol
(1)△H3=________ kJ/mol。
(2)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:_________ 。
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。

(3)阳极的电极反应式为____ 。
(4)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:___ ;
___FeS2+____·OH=________Fe3++ ______SO + _____H2O +
+ _____H2O +
(5)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;__ 。

I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s) + CO2(g)△H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)⇌CaSO4(s)△H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g)△H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g)△H4= +218.92kJ/mol
(1)△H3=
(2)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。

(3)阳极的电极反应式为
(4)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:
___FeS2+____·OH=________Fe3++ ______SO
 + _____H2O +
+ _____H2O +(5)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;

您最近半年使用:0次
解题方法
5 . 二氧化氯( )具有强氧化性,
)具有强氧化性, 协同氨法同时脱硫脱硝具有高脱除率。
协同氨法同时脱硫脱硝具有高脱除率。
(1) 单独参与脱硝过程中发生以下反应:
单独参与脱硝过程中发生以下反应:



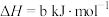


则反应 的
的
________ 
(2) 的浓度、吸收液
的浓度、吸收液 对脱硫脱硝效率的影响分别如图所示,
对脱硫脱硝效率的影响分别如图所示,
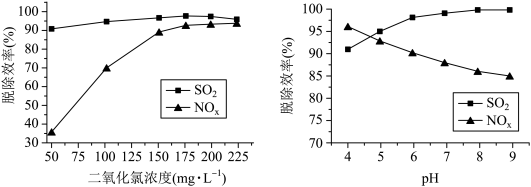
①最适宜的 浓度为
浓度为________  ;
;
② 时,随着
时,随着 的增大,
的增大, 的脱除率下降,其可能的原因是
的脱除率下降,其可能的原因是__________
③ 时,
时, 会发生歧化反应:
会发生歧化反应: ,当有
,当有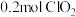 完全反应时,转移电子数目为
完全反应时,转移电子数目为________  ;歧化反应生成的
;歧化反应生成的 也可以作为氧化剂进行脱硝反应,写出碱性条件下
也可以作为氧化剂进行脱硝反应,写出碱性条件下 将
将 氧化为
氧化为 的离子方程式
的离子方程式______________ 。
(3)工业上以不锈钢材料为阴极,表面覆盖金属氧化物的石墨为阳极,电解 溶液制备
溶液制备 。写出阳极产生
。写出阳极产生 的电极反应式
的电极反应式________ ;此方法的缺点是所得产品纯度不高, 气体中所含的杂质可能有
气体中所含的杂质可能有_____________ 。
 )具有强氧化性,
)具有强氧化性, 协同氨法同时脱硫脱硝具有高脱除率。
协同氨法同时脱硫脱硝具有高脱除率。(1)
 单独参与脱硝过程中发生以下反应:
单独参与脱硝过程中发生以下反应:


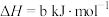


则反应
 的
的

(2)
 的浓度、吸收液
的浓度、吸收液 对脱硫脱硝效率的影响分别如图所示,
对脱硫脱硝效率的影响分别如图所示,
①最适宜的
 浓度为
浓度为 ;
;②
 时,随着
时,随着 的增大,
的增大, 的脱除率下降,其可能的原因是
的脱除率下降,其可能的原因是③
 时,
时, 会发生歧化反应:
会发生歧化反应: ,当有
,当有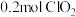 完全反应时,转移电子数目为
完全反应时,转移电子数目为 ;歧化反应生成的
;歧化反应生成的 也可以作为氧化剂进行脱硝反应,写出碱性条件下
也可以作为氧化剂进行脱硝反应,写出碱性条件下 将
将 氧化为
氧化为 的离子方程式
的离子方程式(3)工业上以不锈钢材料为阴极,表面覆盖金属氧化物的石墨为阳极,电解
 溶液制备
溶液制备 。写出阳极产生
。写出阳极产生 的电极反应式
的电极反应式 气体中所含的杂质可能有
气体中所含的杂质可能有
您最近半年使用:0次
名校
6 . 含氮化合物( 、
、 、
、 等)是环境污染物,可用以下方法消除其污染。
等)是环境污染物,可用以下方法消除其污染。
Ⅰ.苯酚(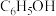 )是一种广泛使用、易氧化的化工产品。一种在
)是一种广泛使用、易氧化的化工产品。一种在 下用
下用 废气催化氧化苯制备苯酚的新方法为:
废气催化氧化苯制备苯酚的新方法为: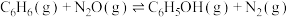 。
。
(1)已知



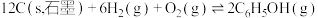
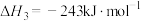
则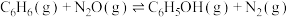

___________ 。
Ⅱ.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的 可高效转化酸性溶液中的硝态氮(
可高效转化酸性溶液中的硝态氮( ),以达到消除污染的目的,其工作原理如图-1所示。
),以达到消除污染的目的,其工作原理如图-1所示。
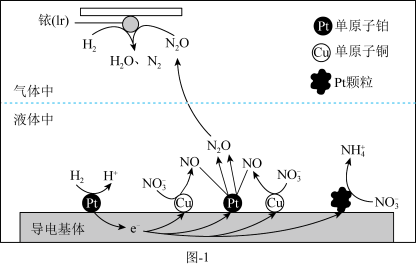
(2) 被
被 还原为
还原为 的过程可描述为:液体中,
的过程可描述为:液体中, 在导电基体的单原子铂上失去电子生成
在导电基体的单原子铂上失去电子生成 ,电子进入导电基体中进行传导,
,电子进入导电基体中进行传导,___________ 。
(3)若导电基体上的Pt颗粒增多,造成的后果是___________ 。
(4)单原子铂催化剂相比于Pt颗粒催化剂,优点有___________ 。
Ⅲ.三维电极法:它是在传统的电解槽两电极之间填充粒状或碎屑状材料,填充的粒子电极表面能带电,成为新的一极(第三极)。如图2为用三维电极法处理氨氮废水的原理图,石墨板作为阴、阳极,自制活性炭为填充材料,电解一定浓度的 、
、 与NaCl的酸性混合溶液来进行模拟。
与NaCl的酸性混合溶液来进行模拟。

(5)该装置可以生成大量氧化性更强的 ,
, 去除
去除 的离子方程式为
的离子方程式为___________ 。
(6)相比于传统的二维电极反应系统,三维电极的优点有___________ 。
 、
、 、
、 等)是环境污染物,可用以下方法消除其污染。
等)是环境污染物,可用以下方法消除其污染。Ⅰ.苯酚(
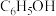 )是一种广泛使用、易氧化的化工产品。一种在
)是一种广泛使用、易氧化的化工产品。一种在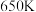 下用
下用 废气催化氧化苯制备苯酚的新方法为:
废气催化氧化苯制备苯酚的新方法为: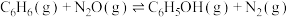 。
。(1)已知




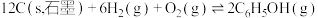
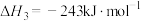
则
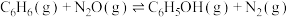

Ⅱ.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的
 可高效转化酸性溶液中的硝态氮(
可高效转化酸性溶液中的硝态氮( ),以达到消除污染的目的,其工作原理如图-1所示。
),以达到消除污染的目的,其工作原理如图-1所示。
(2)
 被
被 还原为
还原为 的过程可描述为:液体中,
的过程可描述为:液体中, 在导电基体的单原子铂上失去电子生成
在导电基体的单原子铂上失去电子生成 ,电子进入导电基体中进行传导,
,电子进入导电基体中进行传导,(3)若导电基体上的Pt颗粒增多,造成的后果是
(4)单原子铂催化剂相比于Pt颗粒催化剂,优点有
Ⅲ.三维电极法:它是在传统的电解槽两电极之间填充粒状或碎屑状材料,填充的粒子电极表面能带电,成为新的一极(第三极)。如图2为用三维电极法处理氨氮废水的原理图,石墨板作为阴、阳极,自制活性炭为填充材料,电解一定浓度的
 、
、 与NaCl的酸性混合溶液来进行模拟。
与NaCl的酸性混合溶液来进行模拟。
(5)该装置可以生成大量氧化性更强的
 ,
, 去除
去除 的离子方程式为
的离子方程式为(6)相比于传统的二维电极反应系统,三维电极的优点有
您最近半年使用:0次
名校
7 . 苯乙烯是生产塑料和合成橡胶的重要有机原料,可由乙苯催化脱氢获得。
I.直接催化脱氢
(1)已知:①C6H5C2H5(g)+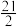 O2(g)=8CO2(g)+5H2O(g) △H1=-4386.9kJ•mol-1
O2(g)=8CO2(g)+5H2O(g) △H1=-4386.9kJ•mol-1
②C6H5CH=CH2(g)+10O2(g)=8CO2(g)+4H2O(g) △H2=-4263.1kJ•mol-1
③H2(g)+ O2(g)=H2O(g) △H3=-241.8kJ•mol-1
O2(g)=H2O(g) △H3=-241.8kJ•mol-1
反应C6H5C2H5(g) C6H5CH=CH2(g)+H2(g)的△H=
C6H5CH=CH2(g)+H2(g)的△H=______ kJ•mol-1。
(2)向密闭容器中充入乙苯蒸气和高温水蒸气,在0.1MPa和催化条件下,不同温度时乙苯的平衡转化率和苯乙烯的平衡选择性如图1所示。
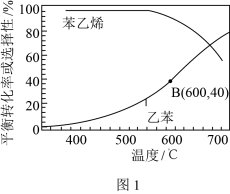
(已知:高温水蒸气不参与乙苯催化脱氢反应;苯乙烯的平衡选择性指除了H2以外的产物中苯乙烯的物质的量分数;乙苯可能会裂解产生积碳覆盖在催化剂表面,使催化剂“中毒”。)
①加入高温水蒸气的作用是______ 。
②实际生产中控制反应温度为600℃的理由是______ 。
II.CO2氧化乙苯脱氢
 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g) △H=+158.8kJ•mol-1
(g)+CO(g)+H2O(g) △H=+158.8kJ•mol-1
(3)CO2氧化乙苯脱氢反应的机理如下:
①晶格氧机理
Ar气氛围下,以高价态钒镁氧化物晶体作催化剂进行乙苯脱氢,并将CO2转化为CO,催化循环可表示为图2,图中物质 为
为______ (填“MgVmOn+1”或“MgVmOn”)
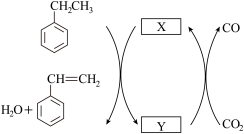
图2
②酸碱位协同催化机理
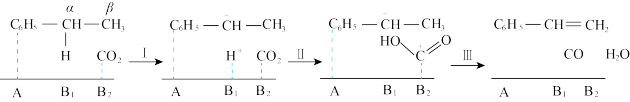
由图可知,酸性位(A)和碱性位(B)都是反应的活性中心,酸性位上发生乙苯的吸附活化;弱碱性位(B1)参与脱去α-H,而强碱性位(B2)活化CO2,被活化的CO2很容易和β-H反应,生成苯乙烯。由于催化剂的碱性不同,在Al2O3上发生的是乙苯直接脱氢,而在Na2O/Al2O3上发生的基本上是CO2耦合乙苯脱氢的原因是______ 。
(4)从资源综合利用角度分析,CO2氧化乙苯脱氢制苯乙烯的优点是______ 。
I.直接催化脱氢
(1)已知:①C6H5C2H5(g)+
 O2(g)=8CO2(g)+5H2O(g) △H1=-4386.9kJ•mol-1
O2(g)=8CO2(g)+5H2O(g) △H1=-4386.9kJ•mol-1②C6H5CH=CH2(g)+10O2(g)=8CO2(g)+4H2O(g) △H2=-4263.1kJ•mol-1
③H2(g)+
 O2(g)=H2O(g) △H3=-241.8kJ•mol-1
O2(g)=H2O(g) △H3=-241.8kJ•mol-1反应C6H5C2H5(g)
 C6H5CH=CH2(g)+H2(g)的△H=
C6H5CH=CH2(g)+H2(g)的△H=(2)向密闭容器中充入乙苯蒸气和高温水蒸气,在0.1MPa和催化条件下,不同温度时乙苯的平衡转化率和苯乙烯的平衡选择性如图1所示。

(已知:高温水蒸气不参与乙苯催化脱氢反应;苯乙烯的平衡选择性指除了H2以外的产物中苯乙烯的物质的量分数;乙苯可能会裂解产生积碳覆盖在催化剂表面,使催化剂“中毒”。)
①加入高温水蒸气的作用是
②实际生产中控制反应温度为600℃的理由是
II.CO2氧化乙苯脱氢
 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g) △H=+158.8kJ•mol-1
(g)+CO(g)+H2O(g) △H=+158.8kJ•mol-1(3)CO2氧化乙苯脱氢反应的机理如下:
①晶格氧机理
Ar气氛围下,以高价态钒镁氧化物晶体作催化剂进行乙苯脱氢,并将CO2转化为CO,催化循环可表示为图2,图中物质
 为
为
图2
②酸碱位协同催化机理
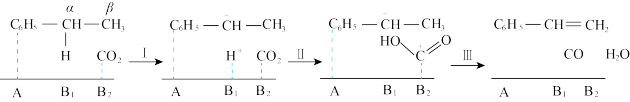
由图可知,酸性位(A)和碱性位(B)都是反应的活性中心,酸性位上发生乙苯的吸附活化;弱碱性位(B1)参与脱去α-H,而强碱性位(B2)活化CO2,被活化的CO2很容易和β-H反应,生成苯乙烯。由于催化剂的碱性不同,在Al2O3上发生的是乙苯直接脱氢,而在Na2O/Al2O3上发生的基本上是CO2耦合乙苯脱氢的原因是
(4)从资源综合利用角度分析,CO2氧化乙苯脱氢制苯乙烯的优点是
您最近半年使用:0次
名校
解题方法
8 . 烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____ kJ·mol-1。
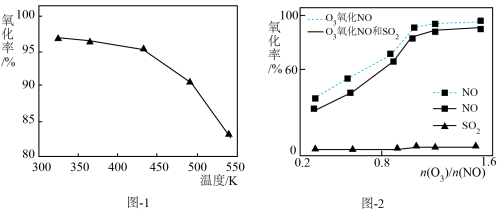
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____ 。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____ 。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____ ;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____ (填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____ 。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____ 。
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多

(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
您最近半年使用:0次
2018-12-04更新
|
218次组卷
|
2卷引用:【市级联考】江苏省扬州市2019届高三上学期期中质量检测化学试题
名校
解题方法
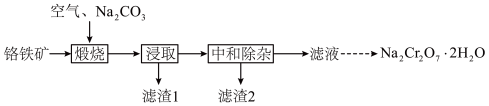
9 . 重铬酸钠晶体( )为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含
)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含 ,还含少量
,还含少量 、
、 、
、 等]制备,主要工艺流程如下:
等]制备,主要工艺流程如下:
已知:① 在水溶液中常以
在水溶液中常以 、
、 、
、 、
、 等形态存在;本实验条件下,当
等形态存在;本实验条件下,当 约为3.5时
约为3.5时 转化为
转化为 。
。
②酸性条件下, 具有较强的氧化性,易被还原成
具有较强的氧化性,易被还原成 。
。
请回答下列问题:
(1)“煅烧”时, 转化为
转化为 和
和 ,写出铬铁矿发生的主要反应的化学方程式
,写出铬铁矿发生的主要反应的化学方程式_______ 。
(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液 约为7。
约为7。
①加热至接近沸腾的目的为_______ 。
②若持续加热较长时间,可以通过生成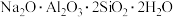 而将硅除去,写出相应的离子方程式
而将硅除去,写出相应的离子方程式_______ 。
(3)室温下,“中和除杂”后所得的滤液中存在下列平衡:



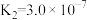
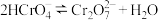
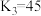
室温下,反应 的平衡常数
的平衡常数
_______ ;酸化 时,通常用硫酸而不用盐酸,原因是
时,通常用硫酸而不用盐酸,原因是_______ 。
 )为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含
)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含 ,还含少量
,还含少量 、
、 、
、 等]制备,主要工艺流程如下:
等]制备,主要工艺流程如下:
已知:①
 在水溶液中常以
在水溶液中常以 、
、 、
、 、
、 等形态存在;本实验条件下,当
等形态存在;本实验条件下,当 约为3.5时
约为3.5时 转化为
转化为 。
。②酸性条件下,
 具有较强的氧化性,易被还原成
具有较强的氧化性,易被还原成 。
。请回答下列问题:
(1)“煅烧”时,
 转化为
转化为 和
和 ,写出铬铁矿发生的主要反应的化学方程式
,写出铬铁矿发生的主要反应的化学方程式(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液
 约为7。
约为7。①加热至接近沸腾的目的为
②若持续加热较长时间,可以通过生成
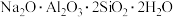 而将硅除去,写出相应的离子方程式
而将硅除去,写出相应的离子方程式(3)室温下,“中和除杂”后所得的滤液中存在下列平衡:



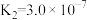
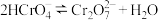
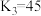
室温下,反应
 的平衡常数
的平衡常数
 时,通常用硫酸而不用盐酸,原因是
时,通常用硫酸而不用盐酸,原因是
您最近半年使用:0次
2021-09-20更新
|
349次组卷
|
3卷引用:江苏省泰州中学2022届高三上学期期初检测化学试题
解题方法
10 . 碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH1
反应Ⅱ:HI(aq)= H2(g)+
H2(g)+ I2(aq) ΔH2
I2(aq) ΔH2
反应Ⅲ:2H2SO4(aq)=2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)=H2SO4(aq)+H2(g)的ΔH=___ (用ΔH1、ΔH2表示)。
②分析上述反应,下列判断正确的是___
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2同时产生1molH2
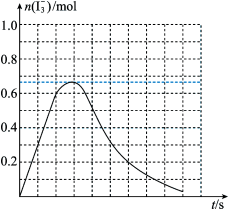
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq) I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是
I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是___ 。
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:___ 。
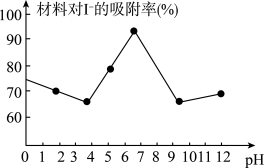
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附___ (填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s) AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=___ [用c(Cl-)、Ksp(AgCl)和Ksq(AgI)表示]。该方法去除碘离子的原理是___ 。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH1
反应Ⅱ:HI(aq)=
 H2(g)+
H2(g)+ I2(aq) ΔH2
I2(aq) ΔH2反应Ⅲ:2H2SO4(aq)=2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)=H2SO4(aq)+H2(g)的ΔH=
②分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2同时产生1molH2
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)
 I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是
I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附

(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
 AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
您最近半年使用:0次



