名校
1 . 氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______ kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________ 。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________ ;为抑制肼的分解,可采取的合理措施有________ (任写一种)。
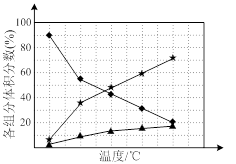
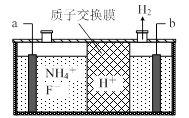
图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________ 。
② a电极为电解池的_____________ (填“阴”或“阳”)极,写出该电极的电极反应式:________________ ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________ 。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:


图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为
② a电极为电解池的
您最近一年使用:0次
2016-01-21更新
|
369次组卷
|
3卷引用:2015届江苏省南通、扬州、连云港高三第二次调研测试化学试卷
2 . 甲烷是一种能量密度低、难液化、运输成本较高的能源。将甲烷转化成能量密度较高的液体燃料已成为重要的课题。
Ⅰ.直接氧化法制甲醇
(1)已知下列反应的热化学方程式:
反应1: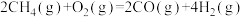

反应2: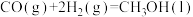
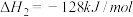
写出甲烷氧化法制甲醇的热化学方程式:______ 。
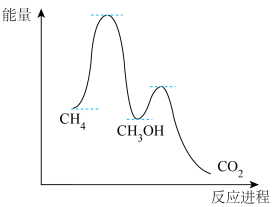
(2)甲烷氧化过程中的活化能垒如图所示。该方法制备CH3OH产率较低,其原因是______ 。
Ⅱ.甲烷的电催化氧化
(3)Hibino科学团队在阳极进行甲烷转化研究,其装置图如图所示,其阳极电极反应式为______ 。

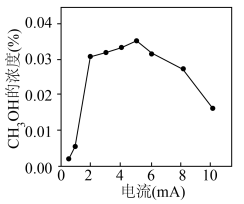
(4)钒(V)物种被认为是形成活性氧物质(如 )的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
)的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是______ 。
Ⅲ.多相催化剂氧化甲烷法
光照条件下,TiO2负载的Fe2O3多相催化剂合成甲醇时,可将甲醇的选择性(选择性 )提升至90%以上,其反应机理如图所示。
)提升至90%以上,其反应机理如图所示。
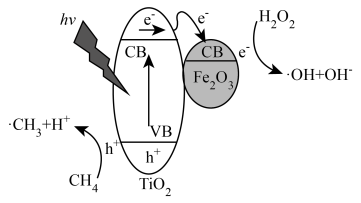
(5)光照时,表面形成的空穴(h+)具有强______ (填“氧化性”或“还原性”)。
(6)写出甲烷通过多相催化剂法制取甲醇的化学方程式______ 。
(7)从反应过程中产生的微粒角度分析,TiO2负载的Fe2O3多相催化剂能将甲醇的选择性提升至90%以上的原因是______ 。
Ⅰ.直接氧化法制甲醇
(1)已知下列反应的热化学方程式:
反应1:
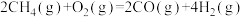

反应2:
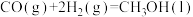
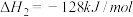
写出甲烷氧化法制甲醇的热化学方程式:
(2)甲烷氧化过程中的活化能垒如图所示。该方法制备CH3OH产率较低,其原因是

Ⅱ.甲烷的电催化氧化
(3)Hibino科学团队在阳极进行甲烷转化研究,其装置图如图所示,其阳极电极反应式为

(4)钒(V)物种被认为是形成活性氧物质(如
 )的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
)的活性位点,V2O5/SnO2作阳极材料时,CH3OH的浓度与电流的关系如图所示,当电流>5mA时,CH3OH的浓度随电流的增加而下降的原因是
Ⅲ.多相催化剂氧化甲烷法
光照条件下,TiO2负载的Fe2O3多相催化剂合成甲醇时,可将甲醇的选择性(选择性
 )提升至90%以上,其反应机理如图所示。
)提升至90%以上,其反应机理如图所示。
(5)光照时,表面形成的空穴(h+)具有强
(6)写出甲烷通过多相催化剂法制取甲醇的化学方程式
(7)从反应过程中产生的微粒角度分析,TiO2负载的Fe2O3多相催化剂能将甲醇的选择性提升至90%以上的原因是
您最近一年使用:0次
3 . 煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s) + CO2(g)△H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)⇌CaSO4(s)△H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g)△H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g)△H4= +218.92kJ/mol
(1)△H3=________ kJ/mol。
(2)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:_________ 。
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。

(3)阳极的电极反应式为____ 。
(4)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:___ ;
___FeS2+____·OH=________Fe3++ ______SO + _____H2O +
+ _____H2O +
(5)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;__ 。

I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s) + CO2(g)△H1= +178.30kJ/mol
②CaO(s) + SO2(g) + 0.5O2(g)⇌CaSO4(s)△H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g)△H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g)△H4= +218.92kJ/mol
(1)△H3=
(2)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。

(3)阳极的电极反应式为
(4)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:
___FeS2+____·OH=________Fe3++ ______SO
 + _____H2O +
+ _____H2O +(5)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;

您最近一年使用:0次
名校
4 . 苯乙烯是生产塑料和合成橡胶的重要有机原料,可由乙苯催化脱氢获得。
I.直接催化脱氢
(1)已知:①C6H5C2H5(g)+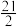 O2(g)=8CO2(g)+5H2O(g) △H1=-4386.9kJ•mol-1
O2(g)=8CO2(g)+5H2O(g) △H1=-4386.9kJ•mol-1
②C6H5CH=CH2(g)+10O2(g)=8CO2(g)+4H2O(g) △H2=-4263.1kJ•mol-1
③H2(g)+ O2(g)=H2O(g) △H3=-241.8kJ•mol-1
O2(g)=H2O(g) △H3=-241.8kJ•mol-1
反应C6H5C2H5(g) C6H5CH=CH2(g)+H2(g)的△H=
C6H5CH=CH2(g)+H2(g)的△H=______ kJ•mol-1。
(2)向密闭容器中充入乙苯蒸气和高温水蒸气,在0.1MPa和催化条件下,不同温度时乙苯的平衡转化率和苯乙烯的平衡选择性如图1所示。
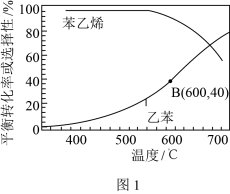
(已知:高温水蒸气不参与乙苯催化脱氢反应;苯乙烯的平衡选择性指除了H2以外的产物中苯乙烯的物质的量分数;乙苯可能会裂解产生积碳覆盖在催化剂表面,使催化剂“中毒”。)
①加入高温水蒸气的作用是______ 。
②实际生产中控制反应温度为600℃的理由是______ 。
II.CO2氧化乙苯脱氢
 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g) △H=+158.8kJ•mol-1
(g)+CO(g)+H2O(g) △H=+158.8kJ•mol-1
(3)CO2氧化乙苯脱氢反应的机理如下:
①晶格氧机理
Ar气氛围下,以高价态钒镁氧化物晶体作催化剂进行乙苯脱氢,并将CO2转化为CO,催化循环可表示为图2,图中物质 为
为______ (填“MgVmOn+1”或“MgVmOn”)
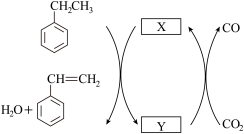
图2
②酸碱位协同催化机理
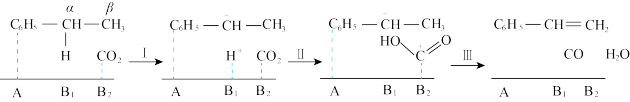
由图可知,酸性位(A)和碱性位(B)都是反应的活性中心,酸性位上发生乙苯的吸附活化;弱碱性位(B1)参与脱去α-H,而强碱性位(B2)活化CO2,被活化的CO2很容易和β-H反应,生成苯乙烯。由于催化剂的碱性不同,在Al2O3上发生的是乙苯直接脱氢,而在Na2O/Al2O3上发生的基本上是CO2耦合乙苯脱氢的原因是______ 。
(4)从资源综合利用角度分析,CO2氧化乙苯脱氢制苯乙烯的优点是______ 。
I.直接催化脱氢
(1)已知:①C6H5C2H5(g)+
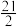 O2(g)=8CO2(g)+5H2O(g) △H1=-4386.9kJ•mol-1
O2(g)=8CO2(g)+5H2O(g) △H1=-4386.9kJ•mol-1②C6H5CH=CH2(g)+10O2(g)=8CO2(g)+4H2O(g) △H2=-4263.1kJ•mol-1
③H2(g)+
 O2(g)=H2O(g) △H3=-241.8kJ•mol-1
O2(g)=H2O(g) △H3=-241.8kJ•mol-1反应C6H5C2H5(g)
 C6H5CH=CH2(g)+H2(g)的△H=
C6H5CH=CH2(g)+H2(g)的△H=(2)向密闭容器中充入乙苯蒸气和高温水蒸气,在0.1MPa和催化条件下,不同温度时乙苯的平衡转化率和苯乙烯的平衡选择性如图1所示。

(已知:高温水蒸气不参与乙苯催化脱氢反应;苯乙烯的平衡选择性指除了H2以外的产物中苯乙烯的物质的量分数;乙苯可能会裂解产生积碳覆盖在催化剂表面,使催化剂“中毒”。)
①加入高温水蒸气的作用是
②实际生产中控制反应温度为600℃的理由是
II.CO2氧化乙苯脱氢
 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g) △H=+158.8kJ•mol-1
(g)+CO(g)+H2O(g) △H=+158.8kJ•mol-1(3)CO2氧化乙苯脱氢反应的机理如下:
①晶格氧机理
Ar气氛围下,以高价态钒镁氧化物晶体作催化剂进行乙苯脱氢,并将CO2转化为CO,催化循环可表示为图2,图中物质
 为
为
图2
②酸碱位协同催化机理
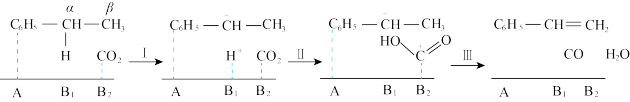
由图可知,酸性位(A)和碱性位(B)都是反应的活性中心,酸性位上发生乙苯的吸附活化;弱碱性位(B1)参与脱去α-H,而强碱性位(B2)活化CO2,被活化的CO2很容易和β-H反应,生成苯乙烯。由于催化剂的碱性不同,在Al2O3上发生的是乙苯直接脱氢,而在Na2O/Al2O3上发生的基本上是CO2耦合乙苯脱氢的原因是
(4)从资源综合利用角度分析,CO2氧化乙苯脱氢制苯乙烯的优点是
您最近一年使用:0次
名校
解题方法
5 . 烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____ kJ·mol-1。
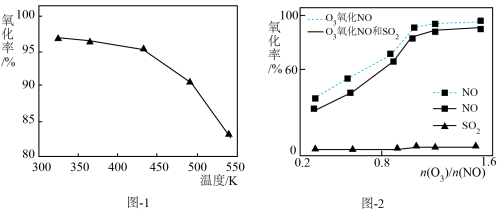
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____ 。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____ 。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____ ;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____ (填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____ 。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____ 。
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多

(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
您最近一年使用:0次
2018-12-04更新
|
218次组卷
|
2卷引用:江苏省扬州中学2023-2024学年高二上学期10月月考化学试题
6 . 化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cρV总△T计算获得。
(1)盐酸浓度的测定:移取20.00mL特测液,加入指示利,用0.500mol/LNaOH溶液滴定至终点消耗NaOH溶液22.00mL。该盐酸浓度为_____ mol/L。
(2)热量的测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为_____ J(c和ρ分别取4.18J/g·℃和1.0g/mL,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4 (aq)=FeSO4(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响,下同)。实验结果见如表。
①温度:b_____ c(填“>”“<”或“=”)。
②△H=_____ (选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq)=3FeSO4(aq)的焓变。
查阅资料:配制Fe2(SO4)3溶液时需加入酸。加酸的目的是抑制Fe3+水解。
提出猜想:Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和_____ (用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为_____ 。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用_____ 。
(1)盐酸浓度的测定:移取20.00mL特测液,加入指示利,用0.500mol/LNaOH溶液滴定至终点消耗NaOH溶液22.00mL。该盐酸浓度为
(2)热量的测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4 (aq)=FeSO4(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响,下同)。实验结果见如表。
| 反应试剂 | 体系温度/℃ | |||
| 反应前 | 反应后 | |||
| ⅰ | 0.20mol/LCuSO4溶液100mL | 1.20gFe粉 | A | b |
| ⅱ | 0.56gFe粉 | a | C | |
②△H=
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq)=3FeSO4(aq)的焓变。
查阅资料:配制Fe2(SO4)3溶液时需加入酸。加酸的目的是抑制Fe3+水解。
提出猜想:Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为
(5)化学能可转化为热能,写出其在生产或生活中的一种应用
您最近一年使用:0次
7 . 我国提出“碳达峰”目标是在2030年前达到最高值,2060年前达到“碳中和”。因此,二氧化碳的综合利用尤为重要。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚( )也有广泛的应用。
)也有广泛的应用。
反应Ⅰ:
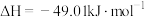
反应Ⅱ:
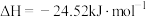
反应Ⅲ:
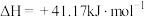
①结合计算分析反应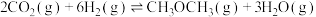 的自发性:
的自发性:___________ 。
②恒压、投料比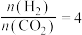 的情况下,不同温度下
的情况下,不同温度下 的平衡转化率和产物的选择性(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性(选择性是指生成某物质消耗的 占
占 消耗总量的百分比)如下图所示:
消耗总量的百分比)如下图所示:
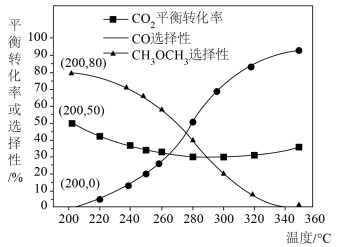
当温度超过 ,
, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是___________ 。
③工业实际设计温度一般在 范围内变化,不能过高的原因是
范围内变化,不能过高的原因是___________ 。
(2)研究表明,在电解质水溶液中, 气体可被电化学还原。
气体可被电化学还原。
① 在碱性介质中电还原为正丙醇(
在碱性介质中电还原为正丙醇(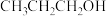 )的电极反应方程式为
)的电极反应方程式为___________ 。
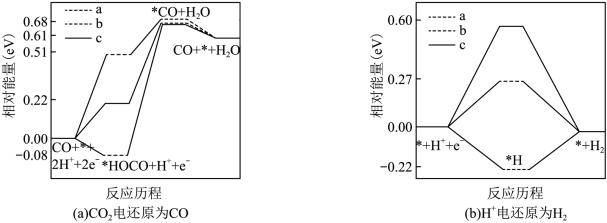
②在电解质水溶液中,三种不同催化剂( 、
、 、
、 )上
)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为___________ (用 、
、 、
、 字母排序)。
字母排序)。
(3) 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( 、
、 表示乙苯分子中
表示乙苯分子中 或
或 原子的位置;
原子的位置; 、
、 为催化剂的活性位点,其中
为催化剂的活性位点,其中 位点带部分正电荷,
位点带部分正电荷,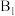 、
、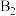 位点带部分负电荷)。
位点带部分负电荷)。

图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为___________ 。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(
 )也有广泛的应用。
)也有广泛的应用。反应Ⅰ:

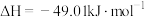
反应Ⅱ:

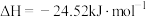
反应Ⅲ:

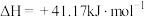
①结合计算分析反应
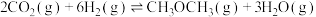 的自发性:
的自发性:②恒压、投料比
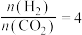 的情况下,不同温度下
的情况下,不同温度下 的平衡转化率和产物的选择性(选择性是指生成某物质消耗的
的平衡转化率和产物的选择性(选择性是指生成某物质消耗的 占
占 消耗总量的百分比)如下图所示:
消耗总量的百分比)如下图所示:
当温度超过
 ,
, 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是③工业实际设计温度一般在
 范围内变化,不能过高的原因是
范围内变化,不能过高的原因是(2)研究表明,在电解质水溶液中,
 气体可被电化学还原。
气体可被电化学还原。①
 在碱性介质中电还原为正丙醇(
在碱性介质中电还原为正丙醇(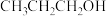 )的电极反应方程式为
)的电极反应方程式为②在电解质水溶液中,三种不同催化剂(
 、
、 、
、 )上
)上 电还原为
电还原为 的反应进程中(
的反应进程中( 被还原为
被还原为 的反应可同时发生),相对能量变化如图。由此判断,
的反应可同时发生),相对能量变化如图。由此判断, 电还原为
电还原为 从易到难的顺序为
从易到难的顺序为 、
、 、
、 字母排序)。
字母排序)。
(3)
 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( 、
、 表示乙苯分子中
表示乙苯分子中 或
或 原子的位置;
原子的位置; 、
、 为催化剂的活性位点,其中
为催化剂的活性位点,其中 位点带部分正电荷,
位点带部分正电荷,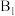 、
、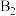 位点带部分负电荷)。
位点带部分负电荷)。
图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为
您最近一年使用:0次
名校
8 . 肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________ 。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________ 。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。
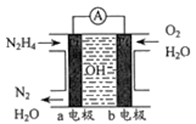
①该电池的负极是______ (填“a”或“b”)电极。
②写出正极的电极反应式:_____________ 。
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) N2(g)+2H2(g)。测得容器中
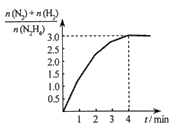
N2(g)+2H2(g)。测得容器中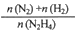 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______ 。

(1)已知肼的球棍模型如图所示,写出肼的电子式:
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是
②写出正极的电极反应式:
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l)
 N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
您最近一年使用:0次
2018-07-04更新
|
366次组卷
|
3卷引用:江苏省震泽中学2018-2019学年高一下学期第二次月考化学试题
解题方法
9 . 氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________ 。
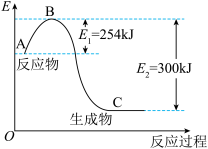
(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
试根据表中及(1)的图中数据计算N—H键的键能为________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________ 。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:

(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
| 化学键 | H—H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP)。固体NH4I在一定条件下首先分解达到平衡:
①NH4I(s)⇌NH3(g)+HI(g),然后缓缓进行反应:
②2HI(g)⇌H2(g)+I2(g)亦达到平衡。
它们的平衡常数分别为Kp1和Kp2,下面所述的p指的是平衡时气体的分压。
(1)当反应②刚开始进行时,恒容密闭体系中的变化情况是p(HI)___________ ,p总___________ (不变、增大、减小)
(2)平衡时,若p(NH3)=d,p(H2)=f,则p(HI)=___________ 。
(3)用Kp1和Kp2表示NH3的平衡分压,则p(NH3)=___________ 。
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g),ΔH=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),ΔH=-1135.7kJ/mol
(4)下列说法正确的是___________
Ⅲ.铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(5)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:___________ 。
(6)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。

①A点时剩余固体的成分是___________ (填化学式)。
②从开始加热到750K时总反应方程式为___________ 。
(7)CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O 发生反应,生成的Fe3+和Cr3+在阴极区与OH﹣结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10﹣38,KspCr(OH)3=6.0×10﹣31]。
发生反应,生成的Fe3+和Cr3+在阴极区与OH﹣结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10﹣38,KspCr(OH)3=6.0×10﹣31]。
①电解过程中NaCl的作用是___________ 。
②已知电解后的溶液中c(Fe3+)为2.0×10﹣13mol•L﹣1,则溶液中c(Cr3+)为___________ mol•L﹣1.
①NH4I(s)⇌NH3(g)+HI(g),然后缓缓进行反应:
②2HI(g)⇌H2(g)+I2(g)亦达到平衡。
它们的平衡常数分别为Kp1和Kp2,下面所述的p指的是平衡时气体的分压。
(1)当反应②刚开始进行时,恒容密闭体系中的变化情况是p(HI)
(2)平衡时,若p(NH3)=d,p(H2)=f,则p(HI)=
(3)用Kp1和Kp2表示NH3的平衡分压,则p(NH3)=
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g),ΔH=+67.7kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),ΔH=-1135.7kJ/mol
(4)下列说法正确的是___________
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-1068kJ/mol |
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H +OH﹣ +OH﹣ |
| C.铂做电极,以KOH溶液为电解质溶液的肼空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼-空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
Ⅲ.铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(5)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
(6)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。

①A点时剩余固体的成分是
②从开始加热到750K时总反应方程式为
(7)CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O
 发生反应,生成的Fe3+和Cr3+在阴极区与OH﹣结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10﹣38,KspCr(OH)3=6.0×10﹣31]。
发生反应,生成的Fe3+和Cr3+在阴极区与OH﹣结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10﹣38,KspCr(OH)3=6.0×10﹣31]。①电解过程中NaCl的作用是
②已知电解后的溶液中c(Fe3+)为2.0×10﹣13mol•L﹣1,则溶液中c(Cr3+)为
您最近一年使用:0次



