1 . 化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cρV总△T计算获得。
(1)盐酸浓度的测定:移取20.00mL特测液,加入指示利,用0.500mol/LNaOH溶液滴定至终点消耗NaOH溶液22.00mL。该盐酸浓度为_____ mol/L。
(2)热量的测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为_____ J(c和ρ分别取4.18J/g·℃和1.0g/mL,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4 (aq)=FeSO4(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响,下同)。实验结果见如表。
①温度:b_____ c(填“>”“<”或“=”)。
②△H=_____ (选择表中一组数据计算)。结果表明,该方法可行。
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq)=3FeSO4(aq)的焓变。
查阅资料:配制Fe2(SO4)3溶液时需加入酸。加酸的目的是抑制Fe3+水解。
提出猜想:Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和_____ (用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为_____ 。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用_____ 。
(1)盐酸浓度的测定:移取20.00mL特测液,加入指示利,用0.500mol/LNaOH溶液滴定至终点消耗NaOH溶液22.00mL。该盐酸浓度为
(2)热量的测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4 (aq)=FeSO4(aq)+Cu(s)的焓变△H(忽略温度对焓变的影响,下同)。实验结果见如表。
| 反应试剂 | 体系温度/℃ | |||
| 反应前 | 反应后 | |||
| ⅰ | 0.20mol/LCuSO4溶液100mL | 1.20gFe粉 | A | b |
| ⅱ | 0.56gFe粉 | a | C | |
②△H=
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq)=3FeSO4(aq)的焓变。
查阅资料:配制Fe2(SO4)3溶液时需加入酸。加酸的目的是抑制Fe3+水解。
提出猜想:Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。
验证猜想:用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为
(5)化学能可转化为热能,写出其在生产或生活中的一种应用
您最近一年使用:0次
名校
2 . 肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________ 。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________ 。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。
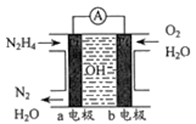
①该电池的负极是______ (填“a”或“b”)电极。
②写出正极的电极反应式:_____________ 。
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中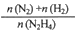 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______ 。
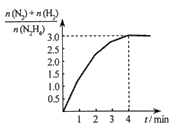

(1)已知肼的球棍模型如图所示,写出肼的电子式:
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是
②写出正极的电极反应式:
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l)
 N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中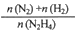 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
您最近一年使用:0次
2018-07-04更新
|
366次组卷
|
3卷引用:【全国百强校】江苏省常熟中学2017-2018学年高一下学期期末调研测试化学试题
3 . 燃煤烟气中的NOx、SO2经处理后可被吸收。
(1)若烟气主要成分为NO、SO2,可通过电解法除去,其原理如图1所示。阴极的电极反应式为___ 。电解过程得到产物为___ 。
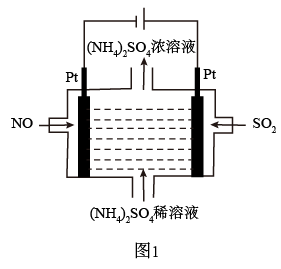
(2)若烟气主要成分为NO2、SO2,可通入NaOH溶液将NO2完全转化为NO 。则NO2、SO2与NaOH反应的离子方程式为
。则NO2、SO2与NaOH反应的离子方程式为___ 。
(3)O3氧化性强于O2,能更有效地氧化NO。
①2NO(g)+O2(g)=2NO2(g)ΔH1=-114kJ·mol-1
2O3(g)=3O2(g)ΔH2=-284.2kJ·mol-1(活化能Ea=119.2kJ·mol-1)
NO(g)+O3(g)=NO2(g)+O2(g)ΔH3=___ kJ·mol-1(活化能Ea=3.2kJ·mol-1)
②NO可经O3处理后再用碱液吸收而实现脱除。为分析氧化时温度对NO脱除率的影响,将NO与O3混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,NO脱除率随NO与O3混合反应时温度变化如图2所示。温度在50~150℃时,随着温度升高,NO脱除率无明显变化;温度超过150℃时,随着温度升高,NO脱除率下降。其可能原因是___ 。

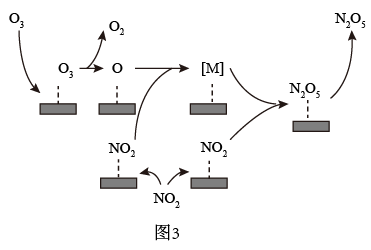
(4)用O3氧化NO2时,使用催化剂可提高氧化效率。研究发现NO2在某催化剂表面被O3氧化时反应机理如图3所示,反应过程中,氮氧化物[M]与NO2按物质的量1∶1反应生成N2O5,[M]的化学式为___ 。该催化氧化过程总反应的化学方程式为___ 。
(1)若烟气主要成分为NO、SO2,可通过电解法除去,其原理如图1所示。阴极的电极反应式为

(2)若烟气主要成分为NO2、SO2,可通入NaOH溶液将NO2完全转化为NO
 。则NO2、SO2与NaOH反应的离子方程式为
。则NO2、SO2与NaOH反应的离子方程式为(3)O3氧化性强于O2,能更有效地氧化NO。
①2NO(g)+O2(g)=2NO2(g)ΔH1=-114kJ·mol-1
2O3(g)=3O2(g)ΔH2=-284.2kJ·mol-1(活化能Ea=119.2kJ·mol-1)
NO(g)+O3(g)=NO2(g)+O2(g)ΔH3=
②NO可经O3处理后再用碱液吸收而实现脱除。为分析氧化时温度对NO脱除率的影响,将NO与O3混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,NO脱除率随NO与O3混合反应时温度变化如图2所示。温度在50~150℃时,随着温度升高,NO脱除率无明显变化;温度超过150℃时,随着温度升高,NO脱除率下降。其可能原因是

(4)用O3氧化NO2时,使用催化剂可提高氧化效率。研究发现NO2在某催化剂表面被O3氧化时反应机理如图3所示,反应过程中,氮氧化物[M]与NO2按物质的量1∶1反应生成N2O5,[M]的化学式为

您最近一年使用:0次
2021-01-07更新
|
286次组卷
|
4卷引用:江苏省昆山市周市高级中学2021-2022学年高三上学期暑期自主学习测试化学试题



