江苏省扬州市2021届高三上学期检测化学试题
江苏
高三
期末
2021-01-23
490次
整体难度:
适中
考查范围:
常见无机物及其应用、物质结构与性质、化学反应原理、化学实验基础、认识化学科学、有机化学基础
江苏省扬州市2021届高三上学期检测化学试题
江苏
高三
期末
2021-01-23
490次
整体难度:
适中
考查范围:
常见无机物及其应用、物质结构与性质、化学反应原理、化学实验基础、认识化学科学、有机化学基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
解题方法
1. 中国古代作画颜料多源于矿物质,绿色颜料来自孔雀石[主要成分为Cu(OH)2·CuCO3],青色颜料来自蓝铜矿[主要成分为Cu(OH)2·2CuCO3]。下列说法不 正确的是
| A.铜制品长期放置于空气中会被腐蚀 |
| B.孔雀石颜料受热不易分解 |
| C.蓝铜矿颜料不耐酸 |
| D.Cu(OH)2·CuCO3属于盐类 |
【知识点】 铜的其他化合物
您最近一年使用:0次
2021-01-07更新
|
1516次组卷
|
3卷引用:江苏扬州市2021届高三1月调研考试化学试题
单选题
|
适中(0.65)
名校
2. 2020年人类在金星大气中探测到PH3。实验室制备PH3的方法有:①PH4I+NaOH=NaI+PH3↑+H2O;②P4+3KOH+3H2O 3KH2PO2+PH3↑。已知H3PO2是一元弱酸,其结构式为
3KH2PO2+PH3↑。已知H3PO2是一元弱酸,其结构式为 。下列说法正确的是
。下列说法正确的是
 3KH2PO2+PH3↑。已知H3PO2是一元弱酸,其结构式为
3KH2PO2+PH3↑。已知H3PO2是一元弱酸,其结构式为 。下列说法正确的是
。下列说法正确的是A.基态P的轨道表示式为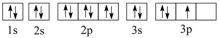 |
B.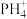 中提供孤电子对的原子是P 中提供孤电子对的原子是P |
| C.NaOH中只存在一种化学键 |
D.反应②中若KOH过量会发生反应:P4+9KOH 3K3PO2+PH3↑+3H2O 3K3PO2+PH3↑+3H2O |
您最近一年使用:0次
2021-01-07更新
|
292次组卷
|
3卷引用:江苏扬州市2021届高三1月调研考试化学试题
单选题
|
适中(0.65)
3. 下列选项所示的物质间转化均能实现的是
A.NaCl(aq) Cl2(g) Cl2(g)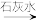 漂白粉 漂白粉 |
B.FeS2(s) SO2(g) SO2(g)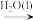 H2SO4(aq) H2SO4(aq) |
C.Fe2O3(s)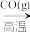 Fe(s) Fe(s)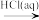 FeCl3(aq) FeCl3(aq) |
D.NO2(g)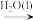 HNO3(aq) HNO3(aq)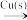 Cu(NO3)2(aq) Cu(NO3)2(aq) |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
4. 下列实验操作能达到实验目的的是
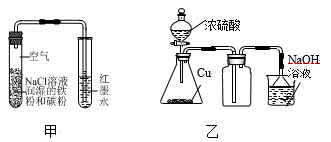

| A.用装置甲检验该条件下铁发生了吸氧腐蚀 |
| B.用装置乙制取并收集少量SO2气体 |
| C.用饱和NaHCO3溶液除去Cl2中的少量HCl |
| D.用湿润的pH试纸测量0.01mol·L-1Na2CO3溶液的pH |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
5. Ksp(BaCO3)=2.6×10−9,Ksp(BaSO4) =1.1×10−10。以BaSO4为原料制备BaCO3一种方法的部分反应为:
①BaSO4(s) + 4C(s) BaS(s) + 4CO(g)
BaS(s) + 4CO(g)
②2BaS(aq) + 2H2O(l)⇌Ba(HS)2(aq) + Ba(OH)2(aq) ΔH>0
③Ba(OH)2 + CO2 = BaCO3↓+ H2O
下列说法正确的是
①BaSO4(s) + 4C(s)
 BaS(s) + 4CO(g)
BaS(s) + 4CO(g)②2BaS(aq) + 2H2O(l)⇌Ba(HS)2(aq) + Ba(OH)2(aq) ΔH>0
③Ba(OH)2 + CO2 = BaCO3↓+ H2O
下列说法正确的是
| A.用Na2CO3溶液浸泡BaSO4,无法制备BaCO3 |
| B.反应①的ΔS<0 |
| C.反应②中升高温度,能使BaS反应更完全 |
| D.反应③中通入CO2至过量,溶液的导电性不断减弱 |
【知识点】 沉淀溶解平衡的应用
您最近一年使用:0次
2021-01-11更新
|
205次组卷
|
4卷引用:江苏扬州市2021届高三1月调研考试化学试题
单选题
|
适中(0.65)
解题方法
6. 资源化利用CO2的一种原理如图所示。下列说法正确的是
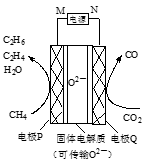

| A.M为电源的负极 |
| B.O2-从电极P移向电极Q |
| C.电极Q上的反应为CO2+2e-=CO+O2- |
| D.理论上参与反应的n(CH4)∶n(CO2)=4∶3 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
7. 为探究某些硫的含氧酸盐的部分性质,进行如下实验,并记录实验现象。①测量0.01 mol/LNaHSO3溶液的pH,pH约为5;②向0.01 mol/LNaHSO3溶液中滴加少量酸性KMnO4溶液,KMnO4溶液的紫红色褪去;③向0.1 mol/LNa2S2O3溶液中滴加稀盐酸,产生无色有刺激性气味的气体,且出现淡黄色沉淀,经测定溶液中无 ;④在Ag+催化条件下,向0.1 mol/LNa2S2O8无色溶液中滴加MnSO4溶液,溶液中出现紫红色。由上述实验现象能得出的结论是
;④在Ag+催化条件下,向0.1 mol/LNa2S2O8无色溶液中滴加MnSO4溶液,溶液中出现紫红色。由上述实验现象能得出的结论是
 ;④在Ag+催化条件下,向0.1 mol/LNa2S2O8无色溶液中滴加MnSO4溶液,溶液中出现紫红色。由上述实验现象能得出的结论是
;④在Ag+催化条件下,向0.1 mol/LNa2S2O8无色溶液中滴加MnSO4溶液,溶液中出现紫红色。由上述实验现象能得出的结论是A.实验①说明: |
B.实验②中发生反应: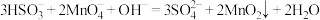 |
| C.实验③中的淡黄色沉淀为S,无色有刺激性气味的气体为H2S |
D.实验④说明:该条件下, 的氧化性强于 的氧化性强于 |
您最近一年使用:0次
2022-05-27更新
|
652次组卷
|
12卷引用:江苏扬州市2021届高三1月调研考试化学试题
江苏扬州市2021届高三1月调研考试化学试题江苏省扬州市2021届高三上学期检测化学试题(已下线)2021年秋季高三开学摸底考化学试卷03(江苏专用)江苏省苏州市相城区陆慕高级中学2021-2022学年高三上学期第一次阶段性诊断测试化学试题江苏省启东中学2022届高三最后一考化学试题江苏省响水中学2022-2023学年高三上学期开学测试化学试题江苏省扬州市2022届高三下学期5月考前调研测试化学(B)试题江苏省南京市雨花台中学2022-2023学年高二上学期10月月考化学试题江苏省泰州中学2022-2023学年高二5月检测化学试题江苏省常州市八校2022-2023学年高三上学期10月联合调研化学试题江苏省盐城市联盟校2023-2024学年高三上学期10月第一次学情调研检测化学试卷江苏省宿迁市青华中学2023-2024学年高三上学期期中考试化学试题
单选题
|
适中(0.65)
名校
8. 下列关于O、Na、S、Cl、K元素及其化合物的说法正确的是
| A.第一电离能:I1(K)>I1(Na) |
| B.沸点:H2S>H2O |
| C.原子半径:r(K)>r(Cl)>r(S)>r(O) |
| D.热稳定性:HCl>H2S |
您最近一年使用:0次
2021-01-07更新
|
665次组卷
|
6卷引用:江苏扬州市2021届高三1月调研考试化学试题
江苏扬州市2021届高三1月调研考试化学试题江苏省扬州市2021届高三上学期检测化学试题江苏省苏州市相城区陆慕高级中学2021-2022学年高三上学期第一次阶段性诊断测试化学试题(已下线)2022年江苏卷高考真题变式题1-13专题2 原子结构与元素性质 本专题达标检测(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题1-5)
单选题
|
适中(0.65)
解题方法
9. 对下列实验现象或事实解释不 正确的是
| 选项 | 实验现象或事实 | 解释 |
| A | N2转化为N,通常需要高温或放电条件 | N2分子中叁键的键能大 |
| B | 干冰用作制冷剂 | 干冰升华吸热,导致环境温度降低 |
| C | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| D | 0.1mol·L-1H2C2O4溶液和0.1mol·L-1 HNO3溶液的pH分别为1.3和1.0 | N的非金属性强于C |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
10. 化合物Y是一种药物中间体,可由X制得。下列有关化合物X、Y的说法正确的是


| A.用FeCl3溶液可以区分X和Y |
| B.X制备Y的反应类型是取代反应 |
| C.Y中共有2种含氧官能团:羟基和羰基 |
| D.1molY最多能与2molNaOH发生反应 |
您最近一年使用:0次
2021-01-07更新
|
424次组卷
|
4卷引用:江苏扬州市2021届高三1月调研考试化学试题
二、多选题 添加题型下试题
多选题
|
较难(0.4)
11. 常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3)=4.2×10-7,Ka2(H2CO3)=5.6×10-11。向20ml0.1mol·L-1NH4HCO3溶液中加入NaOH固体并恢复至常温,理论上溶液中NH 、NH3·H2O、HCO
、NH3·H2O、HCO 、CO
、CO 的变化如图所示(忽略溶液体积的变化)。下列说法正确的是
的变化如图所示(忽略溶液体积的变化)。下列说法正确的是
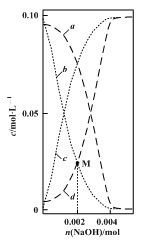
 、NH3·H2O、HCO
、NH3·H2O、HCO 、CO
、CO 的变化如图所示(忽略溶液体积的变化)。下列说法正确的是
的变化如图所示(忽略溶液体积的变化)。下列说法正确的是
A.0.1mol·L-1NH4HCO3溶液:c(NH )>c(HCO )>c(HCO )>c(H2CO3)>c(NH3·H2O) )>c(H2CO3)>c(NH3·H2O) |
B.0.1mol·L-1NH4HCO3溶液:c(NH )+c(NH3·H2O)+c(HCO )+c(NH3·H2O)+c(HCO )+c(CO )+c(CO )=0.2mol·L-1 )=0.2mol·L-1 |
C.曲线a表示的是c(NH )的变化 )的变化 |
D.M点时:c(CO )+c(HCO )+c(HCO )+c(OH-)=0.1mol·L-1+c(H+) )+c(OH-)=0.1mol·L-1+c(H+) |
您最近一年使用:0次
多选题
|
较难(0.4)
解题方法
12. 已知反应2CO2(g)+6H2(g) C2H4(g)+4H2O(g)ΔH。根据理论计算,在恒压、起始物质的量之比n(CO2)∶n(H2)=1∶3条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
C2H4(g)+4H2O(g)ΔH。根据理论计算,在恒压、起始物质的量之比n(CO2)∶n(H2)=1∶3条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
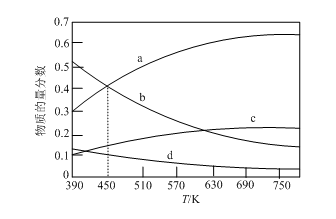
实验发现,在实际反应过程中还可能生成C3H6、C3H8、C4H8等副产物。下列有关说法正确的是
 C2H4(g)+4H2O(g)ΔH。根据理论计算,在恒压、起始物质的量之比n(CO2)∶n(H2)=1∶3条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
C2H4(g)+4H2O(g)ΔH。根据理论计算,在恒压、起始物质的量之比n(CO2)∶n(H2)=1∶3条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
实验发现,在实际反应过程中还可能生成C3H6、C3H8、C4H8等副产物。下列有关说法正确的是
| A.由理论计算可知,ΔH>0 |
| B.理论计算图中曲线d表示的是平衡时C2H4物质的量分数的变化 |
| C.在实际反应中,450K达到平衡时,n(C2H4)∶n(H2O)<1∶4 |
| D.在实际反应中,改用选择性更好的催化剂不能提高C2H4的产率 |
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
13. 二氧化氯(ClO2)是一种常用的饮用水消毒剂。
(1)ClO2分子中的键角约为120°。ClO2易溶于水的原因是___ 。ClO2得到一个电子后形成 ,
, 的空间构型是
的空间构型是___ 。
(2)某ClO2泡腾片的有效成分为NaClO2、NaHSO4、NaHCO3,其溶于水时反应可得到ClO2溶液,并逸出大量气体。NaClO2和NaHSO4反应生成ClO2和Cl-的离子方程式为___ ,逸出气体的主要成分是___ (填化学式)。
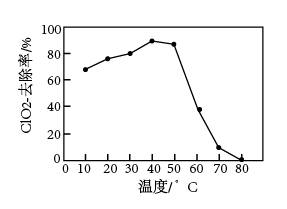
(3)ClO2消毒时会产生少量的ClO ,可利用FeSO4将ClO
,可利用FeSO4将ClO 转化为Cl-除去。控制其他条件相同,
转化为Cl-除去。控制其他条件相同, 去除率随温度变化如图所示。温度高于50℃时,
去除率随温度变化如图所示。温度高于50℃时, 去除率降低的可能原因是
去除率降低的可能原因是___ 。
(4)测定某水样中 浓度的方法如下:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
浓度的方法如下:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:ClO +I-+H+—H2O+I2+Cl-(未配平)
+I-+H+—H2O+I2+Cl-(未配平)
I2+S2O —I-+S4O
—I-+S4O (未配平)
(未配平)
计算水样中ClO 的浓度(写出计算过程)
的浓度(写出计算过程)___ 。
(1)ClO2分子中的键角约为120°。ClO2易溶于水的原因是
 ,
, 的空间构型是
的空间构型是(2)某ClO2泡腾片的有效成分为NaClO2、NaHSO4、NaHCO3,其溶于水时反应可得到ClO2溶液,并逸出大量气体。NaClO2和NaHSO4反应生成ClO2和Cl-的离子方程式为
(3)ClO2消毒时会产生少量的ClO
 ,可利用FeSO4将ClO
,可利用FeSO4将ClO 转化为Cl-除去。控制其他条件相同,
转化为Cl-除去。控制其他条件相同, 去除率随温度变化如图所示。温度高于50℃时,
去除率随温度变化如图所示。温度高于50℃时, 去除率降低的可能原因是
去除率降低的可能原因是
(4)测定某水样中
 浓度的方法如下:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
浓度的方法如下:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:ClO
 +I-+H+—H2O+I2+Cl-(未配平)
+I-+H+—H2O+I2+Cl-(未配平)I2+S2O
 —I-+S4O
—I-+S4O (未配平)
(未配平)计算水样中ClO
 的浓度(写出计算过程)
的浓度(写出计算过程)
您最近一年使用:0次
2021-01-07更新
|
242次组卷
|
3卷引用:江苏扬州市2021届高三1月调研考试化学试题
四、解答题 添加题型下试题
解答题-有机推断题
|
适中(0.65)
名校
14. 化合物H是合成某新型杀虫剂的中间体,其合成路线如图:

(1)化合物A可由卤代烃与NaCN反应获得。CN-中σ键与π键的数目比为______ 。
(2)已知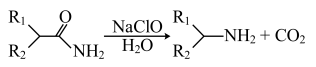 ,则B→C反应的化学方程式为
,则B→C反应的化学方程式为_____ 。
(3)过量NaClO与化合物C反应生成的副产物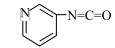 ,可分别与化合物B、C发生加成反应生成新的副产物,其结构简式分别为
,可分别与化合物B、C发生加成反应生成新的副产物,其结构简式分别为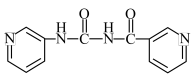 、
、______ 。
(4)化合物D中氮原子的轨道杂化类型为_______ 。
(5)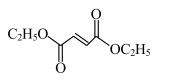 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式_______ 。
①只有一个六元环;
②只有一种化学环境的氢原子;
③能发生水解反应,水解产物只有一种。
(6)已知: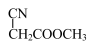 +BrCH2CH2Br→
+BrCH2CH2Br→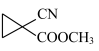 。写出以CH2=CH2和
。写出以CH2=CH2和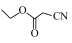 为原料制备
为原料制备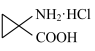 的合成路线流程图
的合成路线流程图_______ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

(1)化合物A可由卤代烃与NaCN反应获得。CN-中σ键与π键的数目比为
(2)已知
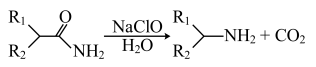 ,则B→C反应的化学方程式为
,则B→C反应的化学方程式为(3)过量NaClO与化合物C反应生成的副产物
 ,可分别与化合物B、C发生加成反应生成新的副产物,其结构简式分别为
,可分别与化合物B、C发生加成反应生成新的副产物,其结构简式分别为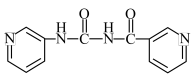 、
、(4)化合物D中氮原子的轨道杂化类型为
(5)
 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式①只有一个六元环;
②只有一种化学环境的氢原子;
③能发生水解反应,水解产物只有一种。
(6)已知:
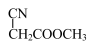 +BrCH2CH2Br→
+BrCH2CH2Br→ 。写出以CH2=CH2和
。写出以CH2=CH2和 为原料制备
为原料制备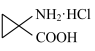 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
2021-01-07更新
|
716次组卷
|
4卷引用:江苏扬州市2021届高三1月调研考试化学试题
江苏扬州市2021届高三1月调研考试化学试题江苏省扬州市2021届高三上学期检测化学试题江苏省南京市中华中学2021届高三第二次适应性训练(选修)化学试题(已下线)02 有机物的综合推断(2)——利用有机物的转化关系推断 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
解答题-原理综合题
|
适中(0.65)
名校
解题方法
15. Co3O4在磁性材料、电化学领域应用广泛,可通过先获得CoCO3沉淀,再加热CoCO3的方法制备。
(1)以CoCl2溶液为原料,制备CoCO3的主要实验流程如图:

①“反应”时需控制温度为50~60℃,其反应的离子方程式为___ 。
②已知:Ksp[Co(OH)2]=1.6×10-15,Ksp(CoCO3)=1.4×10-13。制备CoCO3时不宜使用Na2CO3溶液代替NH4HCO3溶液,其原因是___ 。
(2)加热CoCO3制备Co3O4时有部分Co2+转化为Co3+。取1molCoCO3在空气中加热,反应温度对反应产物的影响如图1所示。参与该反应的物质还有___ (写化学式)。Co3O4晶体中包含A、B两种结构单元,如图2所示( 、
、 表示两种不同价态的Co原子,
表示两种不同价态的Co原子, 表示O原子)。其中Co原子的配位数分别为
表示O原子)。其中Co原子的配位数分别为___ 、___ 。
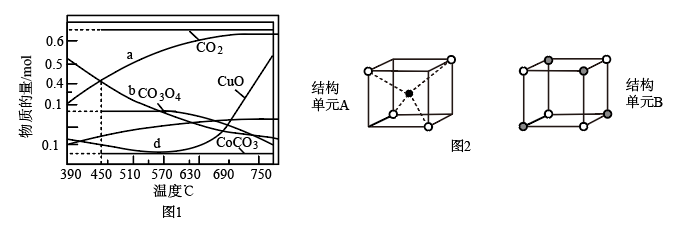
(3)以尿素为原料也可获得CoCO3并制备Co3O4。已知:尿素水溶液呈弱碱性,在70℃以上能缓慢水解产生CO ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素、盐酸为原料,制备Co3O4的实验方案:
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素、盐酸为原料,制备Co3O4的实验方案:___ 。
(1)以CoCl2溶液为原料,制备CoCO3的主要实验流程如图:

①“反应”时需控制温度为50~60℃,其反应的离子方程式为
②已知:Ksp[Co(OH)2]=1.6×10-15,Ksp(CoCO3)=1.4×10-13。制备CoCO3时不宜使用Na2CO3溶液代替NH4HCO3溶液,其原因是
(2)加热CoCO3制备Co3O4时有部分Co2+转化为Co3+。取1molCoCO3在空气中加热,反应温度对反应产物的影响如图1所示。参与该反应的物质还有
 、
、 表示两种不同价态的Co原子,
表示两种不同价态的Co原子, 表示O原子)。其中Co原子的配位数分别为
表示O原子)。其中Co原子的配位数分别为
(3)以尿素为原料也可获得CoCO3并制备Co3O4。已知:尿素水溶液呈弱碱性,在70℃以上能缓慢水解产生CO
 ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素、盐酸为原料,制备Co3O4的实验方案:
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素、盐酸为原料,制备Co3O4的实验方案:
您最近一年使用:0次
2021-01-07更新
|
239次组卷
|
4卷引用:江苏扬州市2021届高三1月调研考试化学试题
16. 燃煤烟气中的NOx、SO2经处理后可被吸收。
(1)若烟气主要成分为NO、SO2,可通过电解法除去,其原理如图1所示。阴极的电极反应式为___ 。电解过程得到产物为___ 。
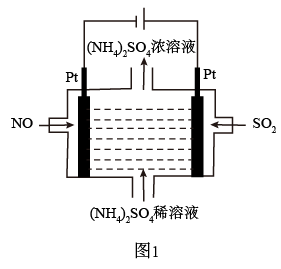
(2)若烟气主要成分为NO2、SO2,可通入NaOH溶液将NO2完全转化为NO 。则NO2、SO2与NaOH反应的离子方程式为
。则NO2、SO2与NaOH反应的离子方程式为___ 。
(3)O3氧化性强于O2,能更有效地氧化NO。
①2NO(g)+O2(g)=2NO2(g)ΔH1=-114kJ·mol-1
2O3(g)=3O2(g)ΔH2=-284.2kJ·mol-1(活化能Ea=119.2kJ·mol-1)
NO(g)+O3(g)=NO2(g)+O2(g)ΔH3=___ kJ·mol-1(活化能Ea=3.2kJ·mol-1)
②NO可经O3处理后再用碱液吸收而实现脱除。为分析氧化时温度对NO脱除率的影响,将NO与O3混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,NO脱除率随NO与O3混合反应时温度变化如图2所示。温度在50~150℃时,随着温度升高,NO脱除率无明显变化;温度超过150℃时,随着温度升高,NO脱除率下降。其可能原因是___ 。

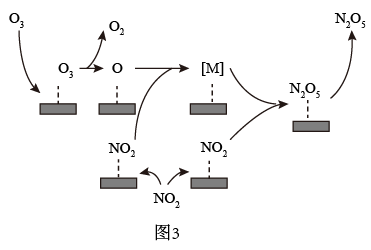
(4)用O3氧化NO2时,使用催化剂可提高氧化效率。研究发现NO2在某催化剂表面被O3氧化时反应机理如图3所示,反应过程中,氮氧化物[M]与NO2按物质的量1∶1反应生成N2O5,[M]的化学式为___ 。该催化氧化过程总反应的化学方程式为___ 。
(1)若烟气主要成分为NO、SO2,可通过电解法除去,其原理如图1所示。阴极的电极反应式为

(2)若烟气主要成分为NO2、SO2,可通入NaOH溶液将NO2完全转化为NO
 。则NO2、SO2与NaOH反应的离子方程式为
。则NO2、SO2与NaOH反应的离子方程式为(3)O3氧化性强于O2,能更有效地氧化NO。
①2NO(g)+O2(g)=2NO2(g)ΔH1=-114kJ·mol-1
2O3(g)=3O2(g)ΔH2=-284.2kJ·mol-1(活化能Ea=119.2kJ·mol-1)
NO(g)+O3(g)=NO2(g)+O2(g)ΔH3=
②NO可经O3处理后再用碱液吸收而实现脱除。为分析氧化时温度对NO脱除率的影响,将NO与O3混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,NO脱除率随NO与O3混合反应时温度变化如图2所示。温度在50~150℃时,随着温度升高,NO脱除率无明显变化;温度超过150℃时,随着温度升高,NO脱除率下降。其可能原因是

(4)用O3氧化NO2时,使用催化剂可提高氧化效率。研究发现NO2在某催化剂表面被O3氧化时反应机理如图3所示,反应过程中,氮氧化物[M]与NO2按物质的量1∶1反应生成N2O5,[M]的化学式为

您最近一年使用:0次
2021-01-07更新
|
286次组卷
|
4卷引用:江苏扬州市2021届高三1月调研考试化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、物质结构与性质、化学反应原理、化学实验基础、认识化学科学、有机化学基础
试卷题型(共 16题)
题型
数量
单选题
10
多选题
2
填空题
1
解答题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 铜的其他化合物 | |
| 2 | 0.65 | 化学键与物质类别关系的判断 洪特规则 轨道表示式 价层电子对数的确定 | |
| 3 | 0.65 | 氯气与碱溶液反应 酸性氧化物的通性 铁与非氧化性酸的反应 铜与强氧化性酸的反应 | |
| 4 | 0.65 | 二氧化硫的制备 测定溶液pH的方法 探究铁的吸氧腐蚀 物质分离、提纯的常见化学方法 | |
| 5 | 0.65 | 沉淀溶解平衡的应用 | |
| 6 | 0.65 | 电解原理的理解及判断 电解池电极反应式及化学方程式的书写与判断 | |
| 7 | 0.65 | 氧化性、还原性强弱的比较 电离平衡常数及影响因素 盐溶液中离子浓度大小的比较 化学实验方案的设计与评价 | |
| 8 | 0.65 | 同周期元素性质递变规律 微粒半径大小的比较方法 电离能变化规律 氢键对物质性质的影响 | |
| 9 | 0.65 | 氮气组成、结构与性质 元素非金属性强弱的比较方法 碳元素及其化合物 亚硫酸及其盐 | |
| 10 | 0.65 | 常见官能团名称、组成及结构 取代反应 苯酚的显色反应 含酯基有机物水解消耗NaOH的量的计算 | |
| 二、多选题 | |||
| 11 | 0.4 | 影响盐类水解程度的主要因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 12 | 0.4 | 催化剂对化学反应速率的影响 温度对化学平衡移动的影响 | |
| 三、填空题 | |||
| 13 | 0.65 | 氧化还原反应方程式的配平 酸碱中和滴定原理的应用 价层电子对互斥理论的应用 相似相溶原理及应用 | |
| 四、解答题 | |||
| 14 | 0.65 | 同分异构体书写 卤代烃 酯的结构 | 有机推断题 |
| 15 | 0.65 | 常见氧化剂与还原剂 浓度对电离平衡的影响 溶度积规则及其应用 物质制备的探究 | 原理综合题 |
| 16 | 0.65 | 盖斯定律的应用 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |



